Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Coloration des protéines dans les gels de Coomassie G-250, sans solvant et l'acide acétique organique
Dans cet article
Résumé
Un protocole court pour la coloration des protéines de Coomassie Brilliant Blue (CBB) G-250 dans des gels de polyacrylamide est décrite sans utiliser de solvants organiques ou d'acide acétique comme dans les procédures de coloration classique avec CBB.
Résumé
Dans classiques protocoles de coloration des protéines à l'aide de Coomassie Brilliant Blue (CBB), des solutions à haute teneur en toxiques et inflammables solvants organiques (méthanol, éthanol ou 2-propanol) et l'acide acétique sont utilisés pour la fixation, coloration et de décoloration des protéines dans un gel après SDS -PAGE. Pour accélérer la procédure, le chauffage de la solution de coloration dans le four à micro-ondes pour un court laps de temps est fréquemment utilisé. Ce qui cause l'évaporation du méthanol toxiques ou dangereux, l'éthanol ou propanol-2 et une forte odeur d'acide acétique dans le laboratoire qui doivent être évitées à cause de considérations de sécurité. Dans un protocole initialement publié en deux demandes de brevet par EM Wondrak (US2001046709 (A1), US6319720 (B1)), une composition alternative de la solution de coloration est décrit dans lequel aucun solvant organique ou de l'acide est utilisé. Le CBB est dissous dans l'eau bidistillée (60-80mg de CBB G-250 par litre) et 35 mM HCl est ajoutée comme le seul composé d'autres dans la solution de coloration. Le CBB staning du gel est effectué après un lavage de SDS-PAGE et approfondie du gel dans l'eau bidistillée. En chauffant le gel pendant le lavage et coloration étapes, le processus peut être terminé plus rapidement et aucune photo-oxydés toxiques ou dangereux sont s'évaporer. La coloration des protéines se fait déjà au sein de 1 minute après le chauffage du gel dans la solution de coloration et est entièrement développé après 15-30 minutes avec un fond bleu qui est légèrement décolorés complètement par lavage prolongé du gel coloré à l'eau bidistillée, sans affecter la protéine tachés bandes.
Protocole
Partie 1: Préparation de la solution de coloration CBB
- 60-80 mg de CBB G-250 sont dissous dans 1 litre d'eau bidistillée en remuant pendant 2-4 heures. Enfin, 3 ml d'HCl concentré est ajouté à la solution bleu foncé avec agitation pendant une minute et stockés dans l'obscurité pour une utilisation ultérieure. La solution peut être stockée pendant des semaines jusqu'à plusieurs mois sans perdre son efficacité coloration.
- HCl concentré doit être manipulé avec les précautions d'usage und utilisée sous une hotte. La solution finale sera d'environ pH 2, alors les gants doivent être utilisés et tout contact avec la peau doit être évité.
Partie 2: SDS-PAGE
- Aliquotes appropriée des échantillons de protéines sont mélangées avec un tampon de charge à une concentration finale de 1x tampon de chargement. Nous utilisons un tampon de charge 2x 125mm Tris/H3PO4 (pH 7,5 à 25 ° C), 2 mM EDTA, 4% SDS, 200 mM de DTT, 0,02% bleu de bromophénol et du glycérol 50%. Autres équipements de chargement tampons pour SDS-PAGE peut être utilisé aussi bien.
- Les échantillons de protéines sont chauffés pendant environ 5 min avant le chargement. Pendant ce temps, la chambre de l'électrophorèse sur gel est préparé pour la course. Nous utilisons NuPAGE préfabriqué 4-12% © Bis-Tris gels (Invitrogen) dans un SureLock XCell ® Mini-Cell (Invitrogen) avec MES-tampon comme le tampon courant, mais aucun autre gel et le système d'électrophorèse peut être utilisé aussi bien.
- Les échantillons de protéines sont chargées sur le gel et l'électrophorèse fonctionner pendant 50 min à 220V.
Partie 3: coloration du gel
- La cassette de gel est démonté et le gel placé dans une boîte pour les étapes ultérieures à laver.
- Environ 100 ml d'eau bidistillée est ajouté au gel et chauffés au four micro-ondes pendant 30 secondes. Le chauffage doit être arrêté avant l'ébullition se produit. La boîte avec le gel est ensuite placé sur un agitateur pendant 3-5 min. et cette étape de lavage est répétée deux fois avec de l'eau fraîche.
- Assez solution de coloration CBB est ajouté pour couvrir le gel dans la boîte et la boîte chauffée au micro-ondes pendant 10 secondes. sans faire bouillir. La boîte avec le gel est ensuite placé sur un agitateur pour la finition de la coloration. Déjà après 1 minute, bandes de protéines peuvent être observées, après 15-30 min. la coloration est assez forte dans la plupart des cas.
- La solution de coloration est évacuée et 50-100 ml d'eau bidistillée est ajoutée afin de poursuivre l'Décolorer fond bleu clair du gel sur un agitateur. L'eau peut être remplacée par l'eau douce pour plus de décoloration, si nécessaire.
- Le gel peut être scanné, photographié ou séché pour stockage à long terme
Partie 4: Résultats du représentant:
Voir Fig. 1 pour un gel teinté correctement en suivant la procédure décrite.
Voir Fig. 2 pour un gel qui n'a pas été lavé suffisamment longtemps avant la coloration et la coloration résiduelle SDS inhibe efficace. Notez que les voies de marqueur (*) contient la même quantité de protéines marqueurs.

Fig. 1: gel coloré représentant après le chargement des échantillons d'une purification de protéines (*: marqueur de poids moléculaire).
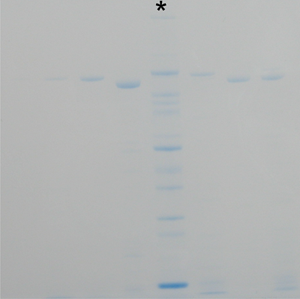
Fig. 2: CBB gel coloré qui n'a pas été lavés assez longtemps avant la coloration CBB. Les bandes de protéines apparaissent plus faibles (à noter que l'* Lane marqueur contient la même quantité de protéines que dans la Fig. 1).
Discussion
- Les étapes de lavage sont essentiels pour la coloration efficace des protéines. Une réduction du temps de lavage en dessous de 2 min ou diminution du volume de l'eau (<50 ml) peut entraîner des pâles bandes protéiques bleu, très probablement due à des montants plus élevés des matières résiduelles de SDS dans le gel.
- Si les protéines vont être analysés par spectrométrie de masse, les étapes de chauffage dans le four micro-ondes devrait être ignorés, le temps pour le lavage du gel étendu à environ 10...
Déclarations de divulgation
Remerciements
Nous tenons à souligner l'aide technique de Ines Racke.
matériels
| Name | Company | Catalog Number | Comments |
| Coomassie Brilliant Blue G-250 | AppliChem | A3480 | any other CBB G-250 could be used as well |
| Concentrated HCl |
Références
- Wondrak, E. M. Process for fast visualization of protein. US patent. , (2001).
- Wondrak, E. M. Solution for fast visualization of protein. US patent. , (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon