Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación de Drosophila Células S2 para microscopía de luz
En este artículo
Resumen
Drosophila Schneider (S2), las células son un sistema cada vez más popular para el descubrimiento y el análisis funcional de los genes. Nuestro objetivo es describir algunas de las técnicas microscópicas que hacen que las células S2 como un sistema experimental cada vez más importante.
Resumen
El sistema experimental ideal sería barato y fácil de mantener, susceptibles de una variedad de técnicas, y sería apoyado por una extensa bibliografía y base de datos de secuencia del genoma. Cultivos de células S2 de Drosophila, el producto de desvincularse 20-24 embriones horas de edad 1, posee todas estas propiedades. En consecuencia, las células S2 son extremadamente bien adaptado para el análisis de los procesos celulares, incluyendo el descubrimiento de los genes que codifican los componentes moleculares del proceso o mecanismo de interés. Las características de las células S2 que son más responsables de su utilidad son la facilidad con que se mantienen, su exquisita sensibilidad a doble cadena (ds) mediada por RNA de interferencia (RNAi), y su docilidad a la microscopía de fluorescencia, ya sea en vivo o fija las células.
S2 células pueden ser cultivadas en una variedad de medios, incluyendo un número de bajo costo, disponibles en el mercado, completamente definido, medio libre de suero 2. Además, crecen de manera óptima y rápida a 21-24 ° C y se pueden cultivar en una variedad de recipientes. A diferencia de las células de mamíferos, las células S2 no requieren de un ambiente regulado, sino hacer bien con el aire normal, e incluso se puede mantener en frascos sellados.
Como complemento a la facilidad de ARNi en las células S2 es la capacidad de analizar rápidamente fenotipos inducidos experimentalmente por fase o microscopía de fluorescencia de células fijas o en vivo. S2 células crecen en la cultura como una sola monocapa, pero no muestran inhibición por contacto. En cambio, las células tienden a crecer en colonias en cultivos densos. A baja densidad, las culturas S2 crecido en el vidrio o el plástico de cultivo de tejidos tratados son redondos y poco adheridas. Sin embargo, la citología de las células S2 puede ser mejorado mediante la inducción de ellos para aplanar ampliamente cultivando brevemente sobre una superficie recubierta con la lectina, concanavalina A (ConA) 3. S2 células también pueden ser transfectadas establemente con marcadores de fluorescencia con etiquetas a las estructuras de la etiqueta u orgánulos de interés en las células vivas o fijas. Por lo tanto, el escenario habitual para el análisis microscópico de las células es la siguiente: las primeras células, S2 (que puede tener para expresar transgenes marcadores etiquetados) son tratados por RNAi para eliminar una proteína diana (s). Tiempo de tratamiento RNAi puede ser ajustado para permitir que las diferencias en las proteínas a su vez-sobre la cinética y para minimizar el trauma de células / la muerte si la proteína diana es importante para la viabilidad. A continuación, las células tratadas se transfirió a una placa que contiene un cubreobjetos pre-recubiertos con ConA inducir a las células para difundir y se adhieren firmemente al vidrio. Finalmente, las células son expuestas con la elección del investigador de los modos de microscopía. S2 células son particularmente buenos para los estudios que requieren la visualización ampliada de células vivas ya que estas células mantenerse saludable a temperatura ambiente y la atmósfera normal.
Protocolo
1. Preparación de las células S2 para microscopía
Schneider células S2 se derivan de embriones con tripsina a finales de Oregon R Drosophila. Cultura original de Schneider consistió en una mezcla de tipos de células, pero se hizo más homogéneo con el paso continuo 1. Ellos han sido descritos como similares a los macrófagos (que son fagocíticas), con expresión de los genes-como hemocitos. S2 células pueden ser obtenidas de la ATCC, DGRC o Invitrogen.
A. Selección del medio de cultivo
Una serie de medios de comunicación han sido utilizados para cultivar células S2. Ninguno de los medios de comunicación se mencionan a continuación requieren un 5% de CO2 la atmósfera.
- Schneider originalmente utilizó su medio definido (medio de Schneider Drosophila), complementado con inactivado por calor, 10% de suero fetal bovino (SFB). Mientras FBS hace este medio más caro que los medios de comunicación libres de suero se mencionan a continuación, se ha autofluorescencia relativamente bajo y por lo tanto es una buena opción para la microscopía de epifluorescencia de células vivas. Sin embargo, contiene elementos de metal suficiente para estimular un bajo nivel de expresión de los transgenes bajo el control del promotor inducible metalotioneína (por ejemplo, los genes se subclonaron en el vector de Invitrogen PMT), causando "fugas" la expresión del gen antes de la inducción.
- Varios medios libres de suero están disponibles comercialmente (por ejemplo, SF900 II, HyClone SFX-insectos, insectos y Xpress-). Estos medios son relativamente baratos, pero por lo general estimular mayores niveles de expresión cuando se utiliza la metalotioneína regulado promotor de transgenes en comparación con el medio de Schneider. Además, estos medios producen autofluorescencia significativa en comparación con el medio Schneider '/ FBS (una consideración importante cuando se realiza la microscopía de fluorescencia de células en vivo).
- Opcionalmente, los antibióticos pueden ser añadidos al medio, por lo general son la penicilina G y sulfato de estreptomicina (50 a 100 unidades / ml y 50-100 mg / ml concentración final, respectivamente). Además, el reactivo anti-fúngica, anfotericina B, se puede agregar a 250 ng / ml (concentración final).
B. Las condiciones de cultivo
S2 células se mantienen fácilmente a temperatura de laboratorio normales y condiciones de la atmósfera. Cuando la imagen en vivo de las células S2 períodos prolongados, las principales causas de muerte de las células son la deshidratación y la toxicidad de fotos. La deshidratación se puede prevenir fácilmente por medio de mantener suficientes en el plato en el microscopio. Foto-toxicidad es un problema complicado que requiere reducir al mínimo la exposición de las células acumuladas de alta intensidad, luz de alta energía, mientras que imágenes con la frecuencia suficiente para capturar eventos de interés con una resolución espacial adecuada y temporal.
- S2 células que crecen en cultivo de tejido de plástico son generalmente redondeadas y adherentes libremente. Las células confluentes crecer como una monocapa densa y luego, cada vez, más células se levantará y crecer en suspensión. Para la microscopía de las dos células fijas y en directo, la imagen es mucho mejor si las células son inducidas a aplanarse en la hoja de la cubierta. Este truco se describe a continuación (2. A. 2.).
2. Microscopía de células S2
A. microscopia de células vivas
Usamos microscopios invertidos para visualizar las células vivas S2 chapada en platos con fondo de cristal. Los platos de fondo de cristal se describe a continuación va a mantener las células en un estado muy similar a su estado normal de cultivo, y también permite que las células vivas para ser examinados a través del cristal de microscopía de grado.
- Preparación de platos con fondo de cristal
Componentes:- Sylgard 184 kit de silicona de elastómero
Este es el pegamento para unir la cubierta se desliza a los platos. El juego tiene dos partes, el componente base de resina y el endurecedor, que se mezclan en un 10:1 (resina: agente de curado) la relación peso justo antes de su uso.
Para preparar la mezcla de agente de resina / curado:- Pesar aproximadamente 5 g de la resina en un plástico pesan barco. Tenga en cuenta el peso de la resina.
- Calcular la cantidad de agente de curado es necesario para multiplicar el peso de la resina en un 0,1. Añadir esta cantidad de agente de curado de la misma pesan barco usando una pipeta de transferencia.
- Revuelva para mezclar bien los componentes. No se preocupe por las burbujas que aparecen, sino que poco a poco desaparecerá.
- El pegamento está listo. Tiene una consistencia similar a la miel y se podrá utilizar por lo menos durante una hora. 5,5 g de cola es suficiente para alrededor de 75 platos, pero esto depende de cómo usted es tacaño cuando se aplica el pegamento.
- De plástico de 35 mm Petri
Nosotros no utilizamos células platos grado de cultura, porque sólo estamos interesados en que las células se adhieren a la parte inferior de cristal (y no de plástico) - así que en vez usamos más barato, de serie cajas de Petri. Algunas etapas microscopio tienen abrazaderas circular para mantener 35mm platos, si usted tiene esto, asegúrese de que sus platos se ajuste la abrazadera. Sorprendentemente, no todos los platos de 35 mm tienen el mismo diámetro exterior. - Cubierta de vidrio
Elija cubreobjetos adecuado para su microscopio y sus necesidades. Nada de vidrios especiales caro con fotograbados redes (por ejemplo, Microscopía Electrónica de Ciencias, 23x23 mm circular, cuadriculada, no. 2, cat.. 72264-23) al vidrio cubrir mucho más barato a granel (por ejemplo, VWR, 22x22 mm cuadrados de vidrio , no. 1,5, cat.. 48366-227) se podrían utilizar. Atención: El cristal debe ser ligeramente más grande (al menos 1 mm) que el agujero que va a hacer en la placa de Petri, y también debe ser menor que el diámetro de la antena. Si va a comprar de vidrio cuadrado, asegúrese de que el cristal por completo la cubierta (y extender un poco más allá) el agujero circular, pero no llegará a los lados del plato. Si prefiere limpiar su cubierta de cristal, que lo hagan antes de pegarlas a los platos. - Taladradora eléctrica
Utilizamos un taladro de velocidad variable y un botón de bloqueo en uso continuo. Platos de perforación es mucho más fácil con un taladro, pero la producción a pequeña escala de los platos de fondo de cristal-no justifica la compra de un taladro. - Broca
Use un poco de ¾ de pulgada broca de pala (una broca de pala es la foto en esta página web: http://en.wikipedia.org/wiki/Drill_bit). Por supuesto, el diámetro de la broca determina el diámetro del agujero en el fondo del plato. - Cónica de perforación de molienda poco
Use un poco de forma cónica con una molienda de grano grueso y un diámetro de aproximadamente la misma que la broca de pala. Después de todos los agujeros se han perforado, utilice este granito de arena para fresa de distancia fragmentos de plástico en el borde del agujero que se proyectan desde la parte inferior del plato. Fragmentos de plástico en la cara exterior del plato evitará que el cristal de la cubierta de sentarse a ras del plato. No se preocupe por pequeñas piezas de plástico que sobresalen en el interior del plato: no van a afectar a la cubierta de vidrio o las células. - Espuma de poliestireno caja con paredes gruesas
Esto se utiliza como la superficie de perforación. Cubre un lado exterior de la caja de espuma de poliestireno con tiras de cinta de sellado (usamos la cinta 1,5 pulgadas de sellado escocés), la cinta de sellado minimiza el escape de los trozos de espuma de poliestireno durante la perforación.
Asamblea- Coloque la mitad inferior de un plato de Petri de 35 mm en la superficie de la caja de espuma de poliestireno grabado es, colocar el plato de manera que es su parte inferior está en contra de la caja de espuma de poliestireno. Mientras mantiene los lados del plato con firmeza, perfore un agujero en el plato. Atención: Su dedos que sostienen el plato será una fracción de una pulgada de una broca giratoria. Naturalmente, esto es peligroso. Detener la perforación si el plato comienza a girar. Si usted tiene un taladro de columna y / o una forma inteligente de mantener el plato con firmeza, los utilizan. Nunca hemos tenido un accidente, pero lo que usted necesita para hacer este procedimiento seguro.
- Después de perforar todos sus platos, suavizar el borde exterior de los orificios con la broca de molienda. Ponemos el taladro de la energía de su lado, con el poco que sobresale sobre el borde del mostrador. El taladro se mantiene en su lugar mediante la colocación de algo pesado pero flexible en la que (nosotros usamos una bolsa de plástico pesado que contiene 10 kg de arena). Utilice el botón de bloqueo para mantener en el ejercicio de funcionamiento continuo, y luego suavizar el borde de todos sus platos mediante la celebración de cada plato y en movimiento contra el poco pulido para suavizar el borde áspero del nuevo agujero.
- Ponga todos los fondos de plato en un vaso grande y enjuague varias veces con agua destilada para remover las piezas pequeñas sueltas de plástico o de espuma de poliestireno (que va a flotar). Después, coloque el plato de fondo para que se sequen.
- Cuando los platos están secos, prepare su Sylgard 184 de pegamento. Aplicar un pequeño círculo de pegamento alrededor del agujero en la superficie exterior de cada plato. Pegamento no se necesita mucho, de hecho, la cola demasiado hará un lío. Coloque una cubierta de vidrio sobre el agujero, en contacto con el pegamento. La cubierta de vidrio deben sentarse frente al plato de manera suave y uniforme. Si el pegamento no se ha distribuido perfectamente alrededor del agujero, es posible que haya pequeñas lagunas donde pegamento que falta entre la cubierta de vidrio y el fondo plato. Inicialmente no se preocupe por estas lagunas, por lo general el pegamento se meten en estos vacíos para llenarlos.
- Después de pegar en todo el cristal de la cubierta, volver atrás y comprobar los platos vacíos que no han sido cerrados con pegamento. En cualquier espacio, aplique una cantidad muy pequeña de pegamento en el borde de la cubierta de vidrio cerca de la laguna, el pegamento se mecha en la brecha.
- Establecer los platos a un lado, parte de abajo hacia arriba, a secas. Esto puede tomar un día o más a temperatura ambiente, pero puede aumentar la tasa de curación, poniendo los platos en un ambiente cálido incubadora.
- Si usted necesita placas estériles, poner el fondo de plato y tapas en una campana de cultivo de tejidos y se extendió a cabo. No coloque la tapa en el fondo plato. En cambio, a su vez las piezas para que sus superficies interiores son nefastasctly frente a la lámpara de rayos UV. Encienda la luz UV de esterilización para por lo menos 45 min. Si tiene previsto para cubrir los platos ConA (ver más abajo), no esterilizar los platos hasta después de que se recubren.
- Los platos están listos para su uso.
- Sylgard 184 kit de silicona de elastómero
- Utilizando concanavalina A
La lectina, concanavalina A (ConA), se encontró que estimulan a las células S2 para aplanar contra una superficie recubierta con ConA 3. Cuando las células S2 son sembradas en cubreobjetos recubiertos con ConA, se extienden y se convierten en excelentes ejemplares para microscopía.- Resbalones ConA capa cubierta de llanura, se extendió la cubierta se desliza limpia en la parte superior de un trozo de Parafilm pegarse con cinta adhesiva a una mesa de trabajo. Lugar 10 μLs de 0,5 mg / ml de solución de ConA (en agua estéril) en la superficie de cada hoja de la cubierta, y luego esparcir el material sobre toda la parte superior de la hoja de la cubierta. Después de secar, almacenar la cubierta se desliza en un recipiente limpio y seco. El vidrio recubierto pueden ser esterilizados con la luz UV en una campana de cultivo de tejidos.
- Para ConA escudo con fondo de cristal platos, del mismo modo diferencial a 10 μLs de la solución de ConA en la parte superior (es decir, la tapa de cara lateral) de la copa. Después del secado, los platos pueden ser esterilizadas como se describió anteriormente. ConA recubierto platos o laminillas se almacenan a temperatura ambiente y se puede utilizar después de meses de preparación.
- Imágenes
- Resuspenda suavemente las células tratadas con RNAi S2 y transferirlos a un ConA con cubierta, con fondo de cristal plato que contiene 2 ml de medio. Las células sanas que en contacto con la hoja de la cubierta ConA recubiertos puede adherirse fuertemente a ella y comenzar a propagarse. Este proceso debe ser evidente por unos 15 minutos, y se debe completar en 45 minutos a 1 hora. Tenga en cuenta que las células adjunto no puede realizar la citocinesis, debido a su apego estricto a la superficie ConA-revestidos y se convertirá en poliploides con el tiempo. Las células sembradas en ConA recubierto platos se mantendrán sanos durante largos períodos de tiempo, pero no va a proliferar en estos platos.
- Después las células se ha fijado, el medio puede ser intercambiado si el medio de edad es autofluorescentes. Esto puede no ser necesario para los estudios que utilizan microscopios confocal o deconvolución o microscopios de campo amplio con pequeña profundidad de campo objetivos.
- Dado que las células S2 son saludables a temperatura ambiente / atmósfera normal, entonces no hay condiciones especiales o equipos son necesarios cuando las células están en el microscopio. A menudo toma mucho tiempo de time-lapse películas de células vivas S2. En la práctica, el tiempo de ejecución de estos experimentos es limitado por los problemas habituales de photobleaching y fototoxicidad.
B. microscopia de células fijas
- Con fondo de cristal platos vs desliza llanura cubierta: Cualquiera de estos puede ser utilizado para fijar las células. Cuando se utilizan hojas llanura cubierta, colocar un sólo ConA recubierto cubreobjetos en un plato individual de 35 mm (que no es necesario que sea el grado de cultivo de tejidos), añadir 2 ml de los medios de comunicación, a continuación, transferir las células tratadas con RNAi en el plato. Después las células se han adherido a la hoja de la cubierta, se elimina el medio, en pocas palabras se lavan las células con una solución amortiguadora (PBS funciona bien), y añadir el fijador (ver más abajo) al plato. Posteriormente, la hoja de la cubierta se puede quitar de la antena y la procesa, por ejemplo, por inmunotinción.
- Fijación: Una variedad de métodos han sido utilizados para fijar las células S2. El mejor método de fijación se determina por lo bien un fijador conserva las características de interés, sin destruir o perder epítopos o proteínas etiquetadas. Algunos procedimientos requieren una etapa de extracción antes de la fijación con el fin de exponer a los epítopos de algunas proteínas localizadas en estructuras densas y compactas. Puesto que la literatura de células S2 es bastante extensa, por lo general es posible encontrar un método publicado para solucionar de manera óptima su estructura celular S2 de interés.
- El metanol es un fijador común. El metanol debe estar fría (por lo menos -20 º C) y anhidro (tamices moleculares [tipo 3a] se puede agregar a la de metanol para extraer agua). Nos frío de 300 ml de metanol anhidro en un vaso de vidrio de 1 litro en una cubierta a prueba de explosiones 20 ° C congelador. Cuando el metanol es frío, sacarlo del congelador, eliminar rápidamente el medio del plato de fondo de cristal (o cápsula que contiene una hoja de cubierta), y luego rápidamente hundir el plato hacia abajo en el metanol y dejarlo allí. El vaso de metanol por lo general tiene una docena de platos. Trabaje con rapidez y devolver el vaso (que contiene los platos) en el congelador tan pronto como sea posible. La fijación se completa en 10-15 min. A continuación, retire los platos del vaso, verter cualquier metanol queda en ellos, y rehidratar ellos mediante la adición de PBS / 0,1% Triton X-100. Ahora están listos para los procedimientos estándar de tinción.
- El formaldehído es otro fijador común. Nosotros usamos el 10% de formaldehído en buffer (PBS es aceptable, pero el uso de la memoria intermedia más adecuada a sus necesidades). Usamos esta concentración relativamente alta de formaldehído, porque las células S2falta citoplasma filamentos intermedios que de otro modo contribuirían a mantener la morfología celular y la organización durante el proceso de fijación.
- Vierta el fijador en un vaso de residuos y lavado de las células fijadas con tres lavados breve PBST (PBS + 0,1% TritonX-100).
- A continuación, añadir 1 ml de solución de bloqueo a las células durante 15 minutos. Nosotros usamos el 5% de suero normal de cabra en PBST.
- Vierta la solución de bloqueo y añadir el anticuerpo primario (diluida en solución de bloqueo) directamente sobre las células. 100 l de solución de anticuerpos debe cubrir completamente las células. Coloque la tapa de nuevo en el plato de Petri para evitar la evaporación de la solución de anticuerpos. Deje que el anticuerpo se incuban con las células durante 30 minutos a temperatura ambiente.
- Retire la solución de anticuerpos y realizar tres lavados con PBST. Use una pipeta para agregar 2 ml de PBST al plato. Espere 5 minutos entre cada lavado (sin necesidad de girar el plato).
- Vierta el último lavado y añadir 100 ml de anticuerpo secundario (diluida en solución de bloqueo) directamente sobre las células. Coloque la tapa de nuevo en el plato de Petri para evitar la evaporación de la solución de anticuerpos. Deje que el anticuerpo se incuban con las células durante 30 minutos a temperatura ambiente.
- Eliminar el anticuerpo secundario y realizar tres lavados de 5 minutos con PBST. Después de volcar el último lavado, se añaden unas gotas de sus medios de montaje de la elección directamente en las células. Usamos 0,1 M galato de propilo se disolvió en una solución de glicerol: PBS (9:1) y se almacena a 20 ° C. Vuelva a colocar la tapa de Petri y guardar el plato en un ambiente oscuro.
3. Limitaciones / problemas
Como con cualquier sistema experimental, hay limitaciones a la utilización de células S2. En primer lugar, las células cultivadas S2 generalmente presentan un bajo índice mitótico (aproximadamente el 1% en el medio libre de suero), mientras que los índices mitóticos para muchas líneas de células transformadas de mamíferos son hasta 10 veces mayor. Por lo tanto, para los estudios de fenotipos mitótico, culturas S2 células requieren una búsqueda de más tiempo para encontrar las células adecuadamente etapas. En segundo lugar, para los estudios del ciclo celular, los tratamientos con fármacos son muy efectivos para detener a las células S2 durante fases específicas del ciclo celular. Sin embargo, los compuestos que tienen reversible del ciclo celular efectos detención en cultivos de células de mamíferos no son fáciles de lavado en las células S2. Por lo tanto, los protocolos para la sincronización de la proliferación de células S2 no se han establecido. Las células en tercer lugar, S2 no son migratorias ni mostrar las características del epitelio.
4. Resultados esperados
El mayor punto de venta para las células S2 es su utilidad como un sistema modelo. Son particularmente útiles para la evaluación de las funciones celulares de la proteína de interés: las células S2 son tratados por dsRNA utilizando RNAi es fácil (y relativamente barato) sintetizado en el laboratorio, y sirven también para el análisis de células vivas y de inmunofluorescencia de células fijas . Además, una ventaja clave para las células S2 es la facilidad con la que se puede mantener en el laboratorio, utilizando relativamente barato medio libre de suero y no el cultivo de tejidos incubadora.
Un experimento típico implicaría placas células S2 en un recipiente de cultivo de tejidos adecuados (por ejemplo, una placa de 6 o de 96), la adición de fabricación casera dsRNA a los pozos, y el posterior mantenimiento de los cultivos como las proteínas dirigidas por el agotamiento gradual de RNAi. En función de las proteínas diana están agotando, las células pueden mostrar un cambio morfológico y / o de comportamiento como resultado de la proteína objetivo derribar al adversario. El tiempo necesario para reducir la expresión de la proteína diana a un mínimo específico de la proteína y debe ser determinada por Western Blot.
Normalmente las células S2 no se adhieren firmemente al plástico o vidrio, y esto supondría un problema para los experimentos que requieren el examen microscópico de las células tratadas. Sin embargo, las células S2 pueden ser inducidas a aplanar ampliamente por simplemente sembrando en una superficie recubierta con la lectina, concanavalina A (ConA). Dentro de una hora de la siembra de ConA, la mayoría de las células han perdido su aspecto redondeado, como resultado de la difusión en gran medida en la superficie de ConA (Figura 1). Las células están listas para su procesamiento (por ejemplo, mediante la fijación y tinción) o la observación microscópica de las células vivas.
S2 células también pueden ser transfectadas (usando una variedad de reactivos químicos o electroporación) que sea de forma transitoria expresa un gen exógeno o incorporar de manera estable el gen en el genoma (por lo tanto la creación de una línea celular que mantiene el gen exógeno a través de repetidas divisiones). Transfecciones puede servir para muchos propósitos, como la expresión de proteínas de marcado con fluorescencia que las estructuras de la marca de interés fijo o en las células vivas (Figura 2), o que se utilizan como cebo en los experimentos in vivo pull-down o inmunoprecipitación, etc
El método de análisis depende de COURSE, sobre la cuestión biológica siendo abordados por el experimento. Un método común de análisis de RNAi tratados con células S2 es la inmunofluorescencia de células fijas (Figura 3). Por ejemplo, la inmunofluorescencia se suele utilizar con las pantallas de todo el genoma de Drosophila bibliotecas de genes para identificar rápidamente las proteínas con actividades interesantes en vivo. El análisis se puede hacer más elaborado de forma simultánea múltiples proteínas que agotan la meta en las células S2 con el fin de examinar las posibles interacciones funcionales entre las proteínas diana. Y el análisis se puede extender a las células vivas, para observar el efecto de RNAi en los procesos dinámicos. Una vez más, las células S2 son especialmente adecuados para este tipo de análisis, ya que pueden chapada en ConA recubiertos con fondo de cristal platos y se visualizan durante muchas horas en un microscopio invertido, sin la necesidad de una cámara ambiental.

Figura 1. Imágenes de contraste de fase (20 aumentos) de las células S2 después de la siembra en un concanavalina A recubierto con fondo de cristal plato. Los números indican los minutos después de la siembra. Tenga en cuenta que las células se vuelven fase oscura como se aplanan en la hoja de cubierta de revestimiento. Aplanamiento celular es evidente por 15 minutos (flechas) y es prácticamente completa a los 60 minutos. Panel de la derecha: imagen ampliada de las células adjunto; sus márgenes extendida y aplanada son claramente visibles (cabeza de flecha). Barra de escala (para los cuatro paneles de la izquierda), 20 micras.
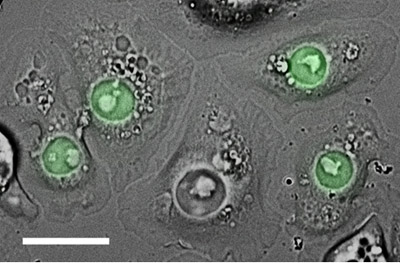
Figura 2. S2 células transfectadas transitoriamente con la construcción de una fusión que consiste en nucleofosmina (un marcador para el núcleo), fusionado con el fluoróforo, EGFP (verde). Estas células fueron colocadas en un ConA recubiertos con fondo de cristal plato, y luego con imágenes de la CID y de epifluorescencia. Barra de escala, 15 micras.
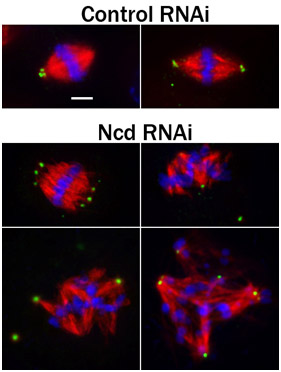
. Figura 3 S2 células fijadas immunostained de PLP (verde, un marcador centríolo), microtúbulos (rojo), y Hoechst-manchada (azul) de los cromosomas. Antes de la fijación y la tinción, las células fueron sometidas a un tratamiento de 4 días, ya sea con el control de RNAi o RNAi para derribo de las ENT, una proteína kinesin-como que promueve polo del huso "concentración" 4. Tenga en cuenta las abiertas polos del huso y desorganizada husos en las células tratadas con ENT RNAi. Barra de escala de 2,5 micras.
Access restricted. Please log in or start a trial to view this content.
Discusión
Para el campo de la biología celular, un sistema ideal sería barato de mantener, fácil de manipular, y es susceptible de una variedad de técnicas. Células S2 de Drosophila satisfacer estos requisitos, por lo que han convertido rápidamente en el sistema de elección para un creciente número de celular biología de los laboratorios.
Hemos presentado un breve resumen de los métodos para preparar las células S2 para microscopía. Una virtud notable de las células S2 es el hech...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Este trabajo fue apoyado en parte por el Instituto Nacional del Cáncer P30 CA23074, la Sociedad Americana del Cáncer Investigación Institucional subvención 74-001-31, y la Universidad del. de Arizona GI SPORE (NCI / NIH CA9506O).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| S2 cells | ATCC | CRL-1963 | http://www.atcc.org/ |
| S2 cells | DGRC | stock number 6 | https://dgrc.cgb.indiana.edu/ |
| S2 cells | Invitrogen | R690-07 | |
| Sf900 II | Invitrogen | 10902-096 | serum-free medium |
| HyClone SFX-Insect | Thermo Fisher Scientific, Inc. | SH30278 | serum-free medium |
| Insect-Xpress | BioWhittaker | 12-730 | serum-free medium |
| Schneider’s S2 medium | Invitrogen | 11720-034 | Add 10% (final) heat-inactivated FBS to make complete medium. |
| Fetal bovine serum | Invitrogen | 10438026 | heat inactivated |
| 100x antibiotic solution | MP Biomedicals | 91674049 | contains penicillin (10000 U/mL), streptomycin (10000 μg/mL), and amphotericin B (25 μg/mL) |
| Concanavalin A | MP Biomedicals | 195283 | |
| Formaldehyde | Electron Microscopy Sciences | 15714 | 32% solution |
| Methanol | Mallinckrodt Baker Inc. | 9049 | anhydrous, ACS grade |
| Molecular sieves | Acros Organics | 19724 | type 3A |
Referencias
- Schneider, I. Cell lines derived from late embryonic stages of Drosophila melanogaster. J Embryol Exp Morphol. 27, 353-365 (1972).
- Rogers, S. L., Rogers, G. C. Culture of Drosophila S2 cells and their use for RNAi-mediated loss-of-function studies and immunofluorescence microscopy. Nat Protoc. 3, 606-611 (2008).
- Rogers, S. L., Rogers, G. C., Sharp, D. J., Vale, R. D. Drosophila EB1 is important for proper assembly, dynamics, and positioning of the mitotic spindle. J Cell Biol. 158, 873-884 (2002).
- Goshima, G. Genes required for mitotic spindle assembly in Drosophila S2 cells. Science. 316, 417-421 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados