É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação de Drosophila Células S2 para microscopia de luz
Neste Artigo
Resumo
Drosophila Schneider (S2), as células são um sistema cada vez mais popular para a descoberta e análise funcional de genes. Nosso objetivo é descrever algumas das técnicas microscópicas que formam células S2 tal sistema cada vez mais importante experimental.
Resumo
O sistema experimental ideal seria barato e fácil de manter, passíveis de uma variedade de técnicas, e seria apoiado por uma extensa literatura e banco de dados seqüência do genoma. Células cultivadas Drosophila S2, o produto de embriões disassociated 20-24 horas de idade 1, possui todas essas propriedades. Conseqüentemente, as células S2 são extremamente bem adaptados para a análise de processos celulares, incluindo a descoberta de genes que codificam os componentes moleculares do processo ou mecanismo de interesse. As características de células S2 que são mais responsáveis pela sua utilidade é a facilidade com que eles sejam mantidos, a sua sensibilidade apurada para double-stranded (ds) RNA de interferência mediada (RNAi), e sua docilidade para microscopia de fluorescência como ao vivo ou fixo células.
Células S2 podem ser cultivadas em uma variedade de meios, incluindo uma série de baixo custo, disponíveis comercialmente, totalmente definido, sem soro media 2. Além disso, eles crescem de forma otimizada e rapidamente a 21-24 ° C e podem ser cultivadas em uma variedade de recipientes. Ao contrário das células de mamíferos, as células S2 não necessitam de um ambiente regulado, mas sim fazer o bem com o ar normal e pode até mesmo ser mantido em frascos lacrados.
Complementando a facilidade de RNAi em células S2 é a capacidade de analisar rapidamente fenótipos experimentalmente induzida por fase ou microscopia de fluorescência de células fixas ou ao vivo. Células S2 crescer em cultura como uma monocamada única, mas não exibem inibição por contato. Em vez disso, as células tendem a crescer em colônias nas culturas densas. Em baixa densidade, culturas S2 cultivadas em vidro ou plástico da cultura de tecidos tratados são redondos e fracamente ligados. No entanto, a citologia de células S2 pode ser muito melhorada, induzindo-os a se achatar extensivamente através da cultura brevemente as sobre uma superfície revestida com a lectina, concanavalina A (ConA) 3. Células S2 também pode ser estavelmente transfectadas com marcadores fluorescentes marcadas para estruturas rótulo ou organelas de interesse em células vivas ou fixos. Portanto, o cenário habitual para a análise microscópica de células é esta: primeiro, as células S2 (que pode possuir para expressar transgenes marcadores marcados) são tratados por RNAi para eliminar uma proteína-alvo (s). RNAi tempo de tratamento pode ser ajustado para permitir que as diferenças em proteína turn-over cinética e para minimizar o trauma celular / morte, se a proteína-alvo é importante para a viabilidade. Em seguida, as células tratadas são transferidos para um prato contendo uma lamela pré-revestida com ConA para induzir as células a se espalhar e firmemente aderem ao vidro. Finalmente, as células são gravadas com a escolha do pesquisador de modos de microscopia. Células S2 são particularmente bons para estudos que necessitem de visualização alargado de células vivas uma vez que estas células se manter saudável à temperatura ambiente e atmosfera normal.
Protocolo
1. Preparar as células para microscopia S2
Schneider células S2 foram derivadas de embriões tripsinizados tardia de Oregon R Drosophila. Cultura original Schneider consistia em uma mistura de tipos de células, mas tornou-se mais homogênea com passagem contínua 1. Eles foram descritos como sendo de macrófagos-like (são fagocíticas) com hemócitos-como a expressão do gene. Células S2 pode ser obtido a partir da ATCC, DGRC, ou Invitrogen.
A. Seleção de meio de crescimento
Um número de meios de comunicação têm sido utilizados para cultura de células S2. Nenhum dos meios de comunicação mencionados abaixo exigem a 5% CO 2 atmosfera.
- Schneider originalmente usou seu meio definido (médio Schneider Drosophila) suplementado com 10% inativado pelo calor soro fetal bovino (FBS). Enquanto FBS faz este meio mais caro do que a mídia sem soro abaixo mencionados, tem autofluorescência relativamente baixo e por isso é uma boa escolha para a microscopia de epifluorescência de células vivas. No entanto, ele conter metal suficiente para estimular um baixo nível de expressão dos transgenes sob controle do promotor de metalotioneína induzível (por exemplo, genes subclonado em vetor Invitrogen da PMT), causando a expressão "fuga" do gene antes da indução.
- Vários soro de mídia livre estão disponíveis comercialmente (por exemplo, Sf900 II, HyClone SFX-Insect, e Insect-Xpress). Estes meios são relativamente baratas, mas geralmente estimular níveis mais elevados de expressão quando se utiliza metalotioneína promotor-regulado transgenes em relação ao meio Schneider. Além disso, essas mídias produzem autofluorescência significativa em relação ao meio Schneiders '/ FBS (uma consideração importante ao realizar a microscopia de fluorescência de células vivas).
- Opcionalmente, os antibióticos podem ser adicionados ao meio, que são normalmente penicilina G e sulfato de estreptomicina (50-100 unidades / ml e 50-100 mg / mL concentrações finais, respectivamente). Além disso, o reagente anti-fungos, a anfotericina B, podem ser adicionados a 250 ng / mL (concentração final).
Cultura condições B.
Células S2 são facilmente mantidos sob temperatura de laboratório normais e as condições de atmosfera. Imagens ao vivo, quando as células S2 por longos períodos, as principais causas de morte celular são a desidratação e foto-toxicidade. A desidratação é facilmente prevenida, mantendo média suficiente no prato no microscópio. Foto-toxicidade é um problema que requer mais complicado minimizar a exposição das células cumulativa a alta intensidade, luz de alta energia, enquanto imagens com freqüência suficiente para capturar eventos interessantes com resolução espacial e temporal adequada.
- Células S2 crescendo em cultura de tecido de plástico são geralmente arredondados e pouco aderente. Células confluentes crescer como uma monocamada densa e, em seguida, cada vez mais, as células mais vai decolar e crescer em suspensão. Para microscopia de ambas as células fixas e ao vivo, a imagem é muito melhor se as células são induzidas a se achatar sobre a lamínula. Este truque é descrito abaixo (2. A. 2.).
2. Microscopia de células S2
A. microscopia de células vivas
Nós usamos microscópios invertidos para visualizar ao vivo as células S2 semeadas em pratos com fundo de vidro. Os pratos com fundo de vidro descrito abaixo irá manter as células em uma condição muito semelhante à sua condição normal de cultivo, e também permite que as células vivas para ser examinado por meio de microscopia grau de vidro.
- Preparação de pratos com fundo de vidro
Componentes:- Sylgard 184 kit elastômero de silicone
Esta é a cola para fixar as lamínulas para os pratos. O kit tem uma duas partes, o componente de base de resina eo agente de cura, que são misturados em um 10:1 (resina: agente de cura) relação de peso imediatamente antes da utilização.
Para preparar a mistura de resina de agente / cura:- Pesar cerca de 5 g da resina em um plástico pesam barco. Observe o peso da resina.
- Calcular a quantidade de agente de cura é necessária multiplicando o peso de resina de 0,1. Adicionar esta quantidade de agente de cura para o barco pesa mesmo usando uma pipeta de nova transferência.
- Mexa para misturar os componentes. Não se preocupe com as bolhas que aparecem, pois eles vão desaparecer lentamente.
- A cola está pronto. Tem uma consistência de mel e como será utilizável para pelo menos uma hora. 5,5 g de cola é suficiente para fazer cerca de 75 pratos, mas isso depende de como você é mesquinho quando você aplicar a cola.
- 35 milímetros placas de Petri de plástico
Nós não usamos pratos célula grade cultura, porque só estamos interessados em ter células anexar ao fundo de vidro (e não o de plástico) - assim, em vez usamos mais baratas, pratos de Petri padrão. Alguns estágios microscópio têm grampos circular para manter 35pratos mm; se você tiver isso, ter certeza de que seus pratos caberá a braçadeira. Surpreendentemente, nem todos os pratos têm 35 milímetros o mesmo diâmetro externo. - Tampa de vidro
Escolha lamínulas apropriadas para seu microscópio e necessidades. Qualquer coisa de vidros especiais caros com foto-gravado redes (por exemplo, Ciências Microscopia Eletrônica, mm 23x23 circular, em grade, não. 2, gato. Não. 72264-23) ao vidro muito mais barato a granel tampa (por exemplo, VWR, 22x22 mm de vidro quadrado , não. 1.5, gato. não. 48.366-227) poderia ser usado. Atenção: O vidro deve ser ligeiramente maior (pelo menos cerca de 1 mm) que o buraco que você vai fazer na placa de Petri, e também deve ser menor que o diâmetro do prato. Se você pretende comprar vidro quadrado, certifique-se que o vidro vai cobrir completamente (e estender um pouco além) do buraco circular, mas não vai atingir os lados do prato. Se você prefere para limpar a sua tampa de vidro, faça isso antes de colar-los para os pratos. - Furadeira
Nós usamos uma broca com velocidade variável e um botão de lock-on para uso contínuo. Pratos de perfuração é muito mais fácil com uma imprensa de broca, mas a produção em pequena escala de pratos com fundo de vidro não justifica a compra de uma furadeira. - Broca
Use uma broca de ¾ polegadas pá (um pouco pá é retratado nesta página: http://en.wikipedia.org/wiki/Drill_bit). Claro, o diâmetro do bit determina o diâmetro do buraco no fundo do prato. - Broca cônica de moagem
Use um pouco em forma cônica com um grão de moagem grossa e um diâmetro de aproximadamente o mesmo que o bit pá. Depois de todos os furos foram perfurados, use este bit para broca longe fragmentos de plástico à beira do buraco que o projeto do fundo do prato. Fragmentos de plástico na face exterior do prato vai impedir que o vidro da tampa do assento flush contra o prato. Não se preocupe com pequenos pedaços de plástico que fura acima para o interior do prato: elas não afetarão a tampa de vidro ou as células. - Caixa de isopor com paredes espessas
Isso é usado como a superfície de perfuração. Cobrir uma parte externa da caixa de isopor com tiras de fita de vedação (usamos 1,5 polegadas fita de vedação Scotch); a fita de vedação minimiza a fuga de pedaços de isopor durante a perfuração.
Montagem- Coloque a metade inferior de uma placa de Petri 35 milímetros sobre a superfície gravada a caixa de isopor é, coloque o prato de modo que é seu lado inferior é contra a caixa de isopor. Enquanto mantém os lados do prato com firmeza, faça um furo através do prato. Cuidado: Seus dedos segurando o prato será uma fração de uma polegada de uma broca giratória. Naturalmente, isso é perigoso. Pare de perfurar se o prato começa a girar. Se você tem uma imprensa de broca e / ou uma maneira inteligente de manter o prato firmemente, usá-los. Nunca tivemos um acidente, mas fazer o que você precisa para fazer este procedimento seguro.
- Depois de perfurar todos os seus pratos, suavizar a borda fora dos buracos usando a broca de moagem. Nós colocamos os furadeira de lado, com o bit projeta para fora sobre a borda do balcão. A broca é mantida no lugar, colocando algo pesado, mas flexível sobre ele (nós usamos um saco plástico contendo 10 kg pesados de areia). Use o botão de lock-on para manter a broca de execução contínua, lisa e depois as jantes de todos os seus pratos, segurando cada prato e movê-lo contra o bit de moagem para atenuar a aspereza do novo buraco.
- Coloque todos os fundos de prato em um copo grande e lave-os várias vezes com água destilada para remover as pequenas peças soltas de plástico ou de isopor (que vai flutuar). Depois, coloque o prato fundo para secar.
- Quando os pratos são secas, prepare sua cola 184 Sylgard. Aplicar um pequeno círculo de cola ao redor do furo na superfície externa de cada prato. Cola não é preciso muito, na verdade, cola demais vai fazer uma bagunça. Coloque uma tampa de vidro em cima do buraco, em contacto com a cola. A tampa de vidro deve sentar-se contra o prato de forma suave e uniformemente. Se a cola não era perfeitamente distribuídas ao redor do buraco, então pode haver pequenos espaços, onde está faltando cola entre a tampa de vidro e no fundo do prato. Inicialmente, não se preocupe com essas lacunas, geralmente a cola vai rastejar essas lacunas para preenchê-las.
- Depois de colar em todos os cobertura de vidro, volte e verifique os pratos para as lacunas que não foram fechados por cola. Em qualquer lacuna, aplicar uma pequena bagatela de cola para a borda da tampa de vidro perto do fosso; a cola vai pavio na abertura.
- Definir os pratos de lado, do lado de baixo para cima, para secar. Isso pode demorar um dia ou mais à temperatura ambiente, mas você pode aumentar a taxa de cura, colocando os pratos em uma incubadora acolhedor.
- Se você precisar de pratos esterilizados, coloque o prato fundo e tampas em uma capa de cultura de tecidos e espalhá-los para fora. Não coloque as tampas no fundo do prato. Em vez disso, vire as peças para que suas superfícies internas são terríveisctly de frente para a lâmpada UV. Acender a luz UV esterilização por pelo menos 45 min. Se você pretende ConA coat os pratos (ver abaixo), não esterilizar os pratos depois que eles são revestidos.
- Os pratos estão prontos para uso.
- Sylgard 184 kit elastômero de silicone
- Usando concanavalina A
A lectina, concanavalina A (ConA), foi encontrada para estimular as células S2 para achatar contra uma superfície revestida com ConA 3. Quando as células S2 são semeados em lamínulas revestido com ConA, elas se espalham e se tornam excelentes exemplares para microscopia.- Para revestir ConA lamínulas simples, espalhar a lamínulas limpos em cima de um pedaço de Parafilm gravada para baixo a uma bancada. Coloque 10 μLs de uma solução 0,5 mg / mL de ConA (em água estéril) na superfície de cada lamínula, e depois se espalhou o material sobre a parte superior inteira da lamínula. Após a secagem, armazenar as lamínulas em um recipiente limpo e seco. O vidro revestidas podem ser esterilizados com a luz UV em uma capa de cultura de tecidos.
- Para revestir ConA com fundo de vidro pratos, da mesma forma se espalhar 10 μLs da solução ConA sobre o lado superior (ou seja, a tampa virada para lado) do vidro. Após a secagem, os pratos podem ser esterilizados, conforme descrito acima. ConA revestido pratos ou lamelas são armazenados em temperatura ambiente e pode ser utilizado mês após a preparação.
- Imagem
- Delicadamente ressuspender as células tratadas com RNAi S2 e transferi-los para um ConA-revestido, prato fundo de vidro contendo 2 ml de meio. Células saudáveis que contacte o lamínula ConA revestido irá aderir firmemente a ela e começar a se espalhar. Este processo deve se tornar aparente por cerca de 15 min, e deverá estar concluído até 45 min a 1 hr. Note-se que células associadas não pode executar citocinese devido ao seu apego firme à superfície ConA-revestido e irá tornar-se poliplóide ao longo do tempo. Células semeadas em ConA revestido pratos permanecerá saudável por longos períodos, mas não se proliferam nesses pratos.
- Depois de ter anexado células, o meio pode ser trocado se o meio de idade é autofluorescent. Isto pode não ser necessário para os estudos utilizando microscópios confocal ou deconvolução ou microscópios de campo amplo com pequenas profundidades de campo objetivos.
- Como as células S2 são saudáveis em temperatura ambiente / atmosfera normal, então não há condições especiais ou equipamentos são necessários quando as células estão no microscópio. Que muitas vezes demora muito tempo-lapso filmes de células vivas de S2. Na prática, o tempo de execução destes experimentos é limitada pelos problemas habituais de fotodegradação e fototoxicidade.
B. microscopia celular fixo
- Com fundo de vidro pratos vs lamínulas simples: Qualquer um destes pode ser usado na fixação das células. Ao usar lamínulas simples, coloque uma lamínula única ConA revestido em um prato individual 35mm (que não precisam ser de grau de cultura de tecidos), adicionar 2 mL de mídia, e depois transferir as células tratadas com RNAi para o prato. Depois que as células têm ligado à lamínula, remova a mídia, brevemente lavar as células com um tampão apropriado (PBS funciona bem), e adicione o fixador (veja abaixo) para o prato. Depois, a lamínula pode ser removido do prato e processada posteriormente, por exemplo, por imunocoloração.
- Fixação: Uma variedade de métodos têm sido utilizados para fixar as células S2. O melhor método de fixação será determinado por quão bem um fixador preserva características de interesse, sem destruir ou perder epítopos ou proteínas marcadas. Alguns procedimentos requerem uma etapa de extração antes da fixação, a fim de expor os epítopos de algumas proteínas localizadas em estruturas densas ou compacto. Uma vez que a literatura de células S2 é bastante extensa, geralmente é possível encontrar um método para otimizar publicado corrigir sua estrutura de células S2 de interesse.
- O metanol é um fixador comum. O metanol deve ser frio (pelo menos -20 ° C) e anidro (peneiras moleculares [3A tipo] pode ser adicionado ao metanol para a água abstract). Nós frio cerca de 300 mL de metanol anidro em um copo de vidro cobertos 1L em 20 ° à prova de explosão freezer C. Quando o metanol é frio, retire-o do freezer, remover rapidamente o meio do prato com fundo de vidro (ou um prato contendo uma lamínula), e depois rapidamente mergulhar o prato para dentro do metanol e deixá-lo lá. O copo de metanol normalmente tem cerca de uma dúzia de pratos. Trabalhar com rapidez e devolver o copo (contendo os pratos) para o freezer o mais rápido possível. A fixação é completa em 10-15 min. Depois, retire os pratos do copo, derramar qualquer metanol remanescente nelas, e hidratar-las adicionando Triton PBS / 0,1% X-100. Eles estão agora prontos para procedimentos de coloração normal.
- O formaldeído é um outro fixador comum. Nós usamos formol a 10% em tampão (PBS é aceitável, mas usar o tampão mais adequado às suas necessidades). Usamos essa concentração relativamente elevada de formol porque as células S2falta citoplasmática filamentos intermediários que, de outra forma ajudar a manter a morfologia das células e organização durante o processo de fixação.
- Deitar fora o fixador para um copo de resíduos e lavar as células fixas com três lavagens breve PBST (PBS + 0,1% tritonX-100).
- Em seguida, adicione 1 ml de solução de bloqueio para as células por 15 minutos. Rotineiramente use soro de cabra de 5% em PBST.
- Decantar a solução de bloqueio e adicionar o anticorpo primário (diluído em solução de bloqueio) diretamente sobre as células. 100 ml de solução de anticorpo deve cobrir completamente as células. Coloque a tampa de volta no prato Petri para evitar a evaporação da solução de anticorpos. Deixe o incube de anticorpos com as células por 30 minutos em temperatura ambiente.
- Remover a solução de anticorpos e executar três lavagens PBST. Use uma pipeta de transferência para adicionar 2 ml de PBST ao prato. Aguarde 5 minutos entre cada lavagem (não precisa rodar o prato).
- Deitar fora a última lavagem, e adicionar 100 ml de anticorpo secundário (diluído em solução de bloqueio) diretamente sobre as células. Coloque a tampa de volta no prato Petri para evitar a evaporação da solução de anticorpos. Deixe o incube de anticorpos com as células por 30 minutos em temperatura ambiente.
- Remover o anticorpo secundário e realizar três minutos 5 lavagens com PBST. Depois de dumping a última lavagem, adicione algumas gotas de sua mídia de montagem de escolha diretamente sobre as células. Usamos 0,1 M propil galato dissolvido em uma solução de glicerol: PBS (9:1) e armazenadas a 20 ° C. Recoloque a tampa Petri e armazenar o prato em ambiente escuro.
3. Limitações / problemas
Como em qualquer sistema experimental, existem limitações para o uso de células S2. Primeiro, cultura de células S2 geralmente apresentam um baixo índice mitótico (cerca de 1% no soro livre de media), enquanto os índices mitótico para muitos transformado linhas de células de mamíferos são tanto quanto 10 vezes maior. Portanto, para estudos de fenótipos mitótico, culturas de células S2 requerem um tempo mais pesquisa para encontrar as células-encenado de forma adequada. Segundo, para estudos de ciclo celular, tratamentos com medicamentos são muito eficazes na prisão de células S2 durante as fases específicas do ciclo celular. No entanto, compostos que têm reversível do ciclo celular efeitos prender em cultura de células de mamíferos não são facilmente washout em células S2. Assim, os protocolos para sincronizar a proliferar as células S2 não foram estabelecidas. Em terceiro lugar, as células S2 não são migratórias nem apresentar características epiteliais.
4. Resultados esperados
O maior ponto de venda para as células S2 é a sua utilidade como um sistema modelo. Eles são particularmente úteis para avaliar as funções celulares de sua proteína de interesse: as células S2 são tratados por RNAi dsRNA usando que é facilmente (e relativamente barato) sintetizado em laboratório, e que servem também para a análise de células vivas e por imunofluorescência de células fixas . Além disso, um dos principais benefícios para as células S2 é a facilidade com que podem ser mantidos no laboratório, utilizando-se relativamente barato meio isento de soro e não de cultura de tecidos incubadora.
A experiência típica envolveria cultivo de células S2 em um recipiente apropriado de cultura de tecidos (por exemplo, uma placa de 6 ou 96 poços), acrescentando home-made dsRNA aos poços, e depois manter a culturas como as proteínas-alvo são gradualmente esgotado por RNAi. Dependendo das proteínas-alvo se esgotando, as células podem apresentar uma alteração morfológica e / ou comportamentais como resultado da proteína alvo knock-down. O tempo necessário para reduzir a expressão da proteína-alvo a um mínimo é específico para a proteína e deve ser determinada por Western blotting.
Normalmente, as células S2 não aderem firmemente ao plástico ou vidro, e isso seria um problema para experimentos que exigem o exame microscópico das células tratadas. No entanto, as células S2 pode ser induzida a se achatar extensivamente simplesmente plating-los em uma superfície revestida com a lectina, concanavalina A (ConA). Dentro de uma hora de plaqueamento em ConA, a maioria das células perderam sua aparência arredondada, como resultado de difundir amplamente na superfície ConA (Figura 1). As células estão agora prontos para processamento posterior (por exemplo, fixação e imunocoloração) ou observação microscópica de células vivas.
Células S2 também podem ser transfectadas (usando uma variedade de reagentes químicos ou eletroporação), quer transitoriamente expressar um gene exógeno ou para incorporar o gene de maneira estável no genoma (criando assim uma linha de células que mantém o gene exógeno através de repetidas divisões). Transfections pode servir a muitos propósitos, como expressão de proteínas fluorescentes marcados que as estruturas marca de interesse em células fixas ou ao vivo (Figura 2), ou que são usados como isca em experimentos in vivo suspenso ou imunoprecipitação, etc
O método de análise depende, course, sobre a questão biológica a ser abordada pelo experimento. Um método comum de análise de células tratadas com RNAi S2 é de imunofluorescência de células fixo (Figura 3). Por exemplo, a imunofluorescência é normalmente usado com telas de todo o genoma de Drosophila bibliotecas gene para identificar rapidamente proteínas com atividades interessantes in vivo. A análise pode ser feita simultaneamente por mais elaborado esgotando as proteínas-alvo múltiplas em células S2 a fim de analisar as interações potencial funcional entre as proteínas-alvo. E a análise pode ser estendida para células vivas, para observar o efeito do RNAi em processos dinâmicos. Novamente, as células S2 são particularmente bem adequado para este tipo de análise porque podem semeadas em ConA-revestido com fundo de vidro pratos e visualizados por muitas horas em um microscópio invertido, sem a necessidade de uma câmara ambiental.

Figura 1. Imagens de contraste de fase (ampliação de 20x) das células S2 após o plaqueamento em um A-revestido concanavalina prato fundo de vidro. Os números indicam os minutos após o plaqueamento. Note-se que as células se tornam fase escura como eles achatam a lamínula revestido. Achatamento das células é aparente por 15 min (setas) e está essencialmente completa em 60 min. Painel da direita: Imagem ampliada das células anexas, as suas margens alargadas e achatadas são claramente visíveis (cabeça de seta). Escala de bar (para os quatro painéis à esquerda), 20 mM.
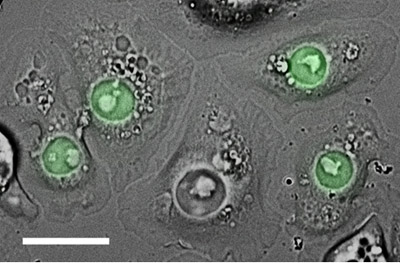
Figura 2. Células S2 transfectadas transitoriamente com uma fusão que consiste em construir nucleophosmin (um marcador para o núcleo) fundida ao fluoróforo, eGFP (verde). Essas células foram semeadas em uma ConA revestido prato de vidro de fundo, e depois fotografada com DIC e epifluorescência. Barra de escala, 15 mm.
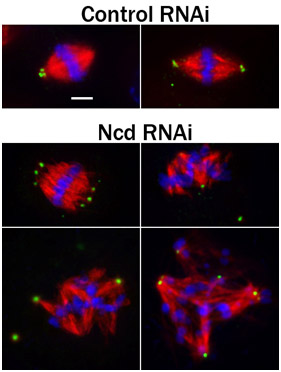
. Figura 3 Fixed células S2 histoquímica para PLP (verde; um marcador centríolo), os microtúbulos (vermelho), e Hoechst-coradas (azul) para cromossomos. Antes de fixação e imunomarcação, as células foram submetidas a um tratamento de 4 dias com um controle de RNAi, ou RNAi para knock-down Ncd, uma proteína cinesina-like que promove a pole fuso "foco" 4. Observe o splayed pólos do fuso e fusos desorganizado nas células tratadas com Ncd RNAi. Barra de escala, 2,5 mM.
Access restricted. Please log in or start a trial to view this content.
Discussão
Para o campo de biologia celular, um sistema ideal seria barato de manter, fácil de manipular, e passíveis de uma variedade de técnicas. Células Drosophila S2 satisfazer essas exigências, e assim eles tornaram-se rapidamente o sistema de escolha para um crescente número de celular laboratórios de biologia.
Nós apresentamos um breve resumo dos métodos para preparar células S2 para microscopia. Uma virtude notável de células S2 é o fato de que eles crescem bem em atmosfer...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecimentos
Este trabalho foi financiado em parte pelo Instituto Nacional do Câncer P30 CA23074, a American Cancer Society Research Grant Institucional 74-001-31, ea Univ. do Arizona GI SPORE (NCI / NIH CA9506O).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| S2 cells | ATCC | CRL-1963 | http://www.atcc.org/ |
| S2 cells | DGRC | stock number 6 | https://dgrc.cgb.indiana.edu/ |
| S2 cells | Invitrogen | R690-07 | |
| Sf900 II | Invitrogen | 10902-096 | serum-free medium |
| HyClone SFX-Insect | Thermo Fisher Scientific, Inc. | SH30278 | serum-free medium |
| Insect-Xpress | BioWhittaker | 12-730 | serum-free medium |
| Schneider’s S2 medium | Invitrogen | 11720-034 | Add 10% (final) heat-inactivated FBS to make complete medium. |
| Fetal bovine serum | Invitrogen | 10438026 | heat inactivated |
| 100x antibiotic solution | MP Biomedicals | 91674049 | contains penicillin (10000 U/mL), streptomycin (10000 μg/mL), and amphotericin B (25 μg/mL) |
| Concanavalin A | MP Biomedicals | 195283 | |
| Formaldehyde | Electron Microscopy Sciences | 15714 | 32% solution |
| Methanol | Mallinckrodt Baker Inc. | 9049 | anhydrous, ACS grade |
| Molecular sieves | Acros Organics | 19724 | type 3A |
Referências
- Schneider, I. Cell lines derived from late embryonic stages of Drosophila melanogaster. J Embryol Exp Morphol. 27, 353-365 (1972).
- Rogers, S. L., Rogers, G. C. Culture of Drosophila S2 cells and their use for RNAi-mediated loss-of-function studies and immunofluorescence microscopy. Nat Protoc. 3, 606-611 (2008).
- Rogers, S. L., Rogers, G. C., Sharp, D. J., Vale, R. D. Drosophila EB1 is important for proper assembly, dynamics, and positioning of the mitotic spindle. J Cell Biol. 158, 873-884 (2002).
- Goshima, G. Genes required for mitotic spindle assembly in Drosophila S2 cells. Science. 316, 417-421 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados