Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Подготовка Drosophila S2 клеток для световой микроскопии
В этой статье
Резюме
Дрозофилы Шнайдер (S2) клетки становятся все более популярной системой для обнаружения и функционального анализа генов. Нашей целью является описание некоторых из микроскопических методов, которые делают S2 клетках, таких все более важной экспериментальной системы.
Аннотация
The ideal experimental system would be cheap and easy to maintain, amenable to a variety of techniques, and would be supported by an extensive literature and genome sequence database. Cultured Drosophila S2 cells, the product of disassociated 20-24 hour old embryos1, possess all these properties. Consequently, S2 cells are extremely well-suited for the analysis of cellular processes, including the discovery of the genes encoding the molecular components of the process or mechanism of interest. The features of S2 cells that are most responsible for their utility are the ease with which they are maintained, their exquisite sensitivity to double-stranded (ds)RNA-mediated interference (RNAi), and their tractability to fluorescence microscopy as either live or fixed cells.
S2 cells can be grown in a variety of media, including a number of inexpensive, commercially-available, fully-defined, serum-free media2. In addition, they grow optimally and quickly at 21-24°C and can be cultured in a variety of containers. Unlike mammalian cells, S2 cells do not require a regulated atmosphere, but instead do well with normal air and can even be maintained in sealed flasks.
Complementing the ease of RNAi in S2 cells is the ability to readily analyze experimentally-induced phenotypes by phase or fluorescence microscopy of fixed or live cells. S2 cells grow in culture as a single monolayer but do not display contact inhibition. Instead, cells tend to grow in colonies in dense cultures. At low density, S2 cultures grown on glass or tissue culture-treated plastic are round and loosely-attached. However, the cytology of S2 cells can be greatly improved by inducing them to flatten extensively by briefly culturing them on a surface coated with the lectin, concanavalin A (ConA)3. S2 cells can also be stably transfected with fluorescently-tagged markers to label structures or organelles of interest in live or fixed cells. Therefore, the usual scenario for the microscopic analysis of cells is this: first, S2 cells (which can possess transgenes to express tagged markers) are treated by RNAi to eliminate a target protein(s). RNAi treatment time can be adjusted to allow for differences in protein turn-over kinetics and to minimize cell trauma/death if the target protein is important for viability. Next, the treated cells are transferred to a dish containing a coverslip pre-coated with conA to induce cells to spread and tightly adhere to the glass. Finally, cells are imaged with the researcher's choice of microscopy modes. S2 cells are particularly good for studies requiring extended visualization of live cells since these cells stay healthy at room temperature and normal atmosphere.
протокол
1. Подготовка S2 клеток для микроскопии
Шнайдер S2 клетки были получены из эмбрионов трипсином конце Орегон R дрозофилы. Самобытную культуру Шнайдера состояла из смеси типов клеток, но стал более однородным с продолжающимся проход 1. Они были описаны как макрофагами, как (они фагоцитарную) с гемоцитов типа экспрессии генов. S2 клетки могут быть получены из АТСС, DGRC или Invitrogen.
А. Выбор питательной среды
Ряд СМИ были использованы для культуры S2 клетках. Ни один из указанных ниже средств массовой информации требует 5% СО 2 атмосферы.
- Шнайдер изначально использовал ее определенной среде (Drosophila среду Шнайдера) с добавлением 10% тепла инактивированной эмбриональной телячьей сыворотки (FBS). Хотя FBS делает эту среду дороже, чем сыворотки среде, упомянутые ниже, она имеет относительно низкую аутофлюоресценция и так является хорошим выбором для epifluorescence микроскопии живых клеток. Тем не менее, она содержит достаточное металла, чтобы стимулировать низкий уровень экспрессии этих трансгенов под контролем промотора индуцибельной металлотионеина (например, гены субклонировали в PMT вектор Invitrogen в), в результате чего "дырявые" экспрессии гена до индукции.
- Несколько сыворотки среде имеются в продаже (например, Sf900 II, Hyclone SFX-насекомых, а насекомые-Xpress). Эти средства являются относительно недорогими, но обычно стимулировать более высокие уровни выражения при использовании металлотионеина промоутер регулируемой трансгенов как по сравнению со средними Шнайдера. Кроме того, эти средства массовой информации производить значительные аутофлюоресценция по сравнению со средними Schneiders '/ FBS (важным фактором при микроскопии живых выступлений флуоресценции клеток).
- При желании, антибиотики могут быть добавлены к среде, они, как правило пенициллин G и стрептомицин сульфат (50-100 ЕД / мл и 50-100 мкг / мл конечных концентрациях, соответственно). Кроме того, противогрибковые реагента, амфотерицин В, может быть добавлено до 250 нг / мл (конечная концентрация).
Условия В. Культура
S2 клетки легко поддерживается при нормальной температуре лаборатории и атмосферных условиях. При визуализации жить S2 клетках в течение длительного время, основными причинами гибели клеток являются обезвоживание и фото-токсичности. Обезвоживание легко предотвращается достаточной среды в блюдо на микроскоп. Фото-токсичность сложнее проблема, которая требует минимизации клеток кумулятивное воздействие высокой интенсивности, высокой энергии света в то время как изображения достаточно часто, чтобы захватить интересные события с адекватным пространственным и временным разрешением.
- S2 клеток, растущих на ткани пластической культуры, как правило, округлые и свободно присоединенными. Сливной клетки растут в виде плотного монослоя, а затем, все чаще, больше клеток стартует и расти во взвешенном состоянии. Для микроскопии фиксированных и живых клеток, изображения значительно улучшается, если клетки индуцируются для выравнивания на покрытие скольжения. Этот трюк описан ниже (2. A. 2.).
2. Микроскопия S2 клетках
А. Живая клетка микроскопии
Мы используем инвертированных микроскопов для визуализации живой S2 клетки высевают на стеклянным дном посуды. Стеклянным дном блюда, описанные ниже будет держать клетки в состояние очень похоже на обычное состояние культивирования, а также позволяет живые клетки должны быть рассмотрены через микроскопию класса стекла.
- Подготовка стеклянным дном блюда
Компоненты:- Sylgard 184 силиконового эластомера комплект
Это клей, чтобы прикрепить крышку скользит к блюдам. Комплекта из двух частей, компонент смолы базы и отвердителя, которые смешиваются в 10:01 (смола: отвердитель) веса непосредственно перед употреблением.
Для подготовки смолы / отвердителя смесь:- Взвесьте из примерно 5 г смолы в пластиковый весят лодке. Обратите внимание на вес смолы.
- Рассчитайте, сколько отвердителя необходимо путем умножения веса смолы на 0,1. Добавить это количество отвердителя к тому же весит лодка с использованием новой пипеткой передачи.
- Движение, чтобы тщательно перемешать компоненты. Не беспокойтесь о том, что пузыри появляются, они будут постепенно исчезать.
- Клей готов к работе. Это мед консистенцию и будет использоваться, по крайней мере час. 5,5 г клея достаточно, чтобы сделать примерно 75 блюд, но это зависит от того, как скупой вы при применении клея.
- Пластиковые 35мм чашки Петри
Мы не используем ячейку блюда культуры класса, потому что мы заинтересованы только в том, клетки прикрепляются к стеклянным дном (а не пластиковый) - так что вместо этого мы использовать более дешевые, стандартные чашки Петри. Некоторые микроскопом этапы круговой зажимы провести 35мм блюд, если у вас есть это, убедитесь, что ваши блюда подойдет зажим. Удивительно, но не все 35 блюд имеют одинаковый внешний диаметр. - Крышка стекла
Выберите крышка скользит соответствующий вашим микроскопом и потребностей. Все, начиная от дорогого стекла специальности с фото-травления сетки (например, электронная микроскопия наук, 23x23 мм, круглого, сетке, нет. 2, кот. Нет. 72264-23), чтобы значительно дешевле стекла масса крышки (например, VWR, 22x22 мм, квадратные стекла , нет. 1.5, кот. нет. 48366-227) могут быть использованы. Осторожно: стекло должно быть немного больше (по крайней мере, около 1 мм), чем отверстие, которое вы будете делать в чашке Петри, а также должно быть меньше, чем диаметр тарелки. Если вы собираетесь купить квадратные стекла, будьте уверены, что стекло будет полностью покрывать (и продлить немного за ее пределами) круглое отверстие, но не достигнет стороны блюдо. Если вы предпочитаете для очистки покровного стекла, сделайте это перед склеиванием их блюда. - Электрическая дрель
Мы используем ручная дрель с переменной скоростью и блокировки на кнопку для непрерывного использования. Бурение блюда намного легче с сверлильный станок, но небольшие масштабами производства стеклянным дном блюда не оправдывает покупку сверлильный станок. - Сверло
Используйте ¾ дюйма сверло лопаты (лопата бит изображенные на эту страницу: http://en.wikipedia.org/wiki/Drill_bit). Конечно, диаметр бит определяет диаметр отверстия в нижней части блюда. - Конические шлифовальные сверло
Использование конической формы шлифовальных немного с грубой зернистостью и диаметром примерно столько же, лопатой немного. После того как все отверстия были просверлены, использовать этот бит для бора от пластиковых фрагментов на краю отверстия, что проект из нижней части блюда. Пластиковые фрагменты на внешнюю сторону блюдо будет препятствовать покровного стекла от сидения вплотную блюдо. Не беспокойтесь о маленьких пластмассовых частей торчали в интерьер блюдо: они не повлияют на стеклянной крышкой или клеток. - Пенополистирола коробки с толстыми стенками
Это используется как для бурения с поверхности. Обложка одного внешнего стороне коробки пенополистирола полосками уплотнительную ленту (используется 1,5-дюймовый уплотнительная лента скотч); уплотнительная лента минимизирует побега биты пенополистирола в процессе бурения.
Сборка- Место нижней половине блюдо Петри на 35-мм пленку поверхности холодильных боксах из пенопласта это, место блюдо так, чтобы в ее нижней стороне против холодильных боксах из пенопласта. Удерживая стороны блюдо твердо, сверлить отверстие, через антенну. Внимание: Ваши пальцы проведение блюдо будет доля дюйма от вращающегося сверла. Естественно, что это опасно. Стоп бурения, если блюдо начинает вращаться. Если у вас есть пресс дрель и / или умный способ держать блюдо крепко, используйте их. У нас никогда не было случайностью, но делать все, что вам нужно сделать эту процедуру безопасной.
- После бурения всех ваших блюд, гладкой вне края отверстия использованием шлифовальных сверло. Мы размещаем дрель на боку, с установленным битом выступающие над краем счетчика. Сверла удерживается на месте, поставив что-то тяжелое, но гибкая на нем (мы используем тяжелую сумку пластиковую долг содержащих 10 кг песка). Использование блокировки на кнопку, чтобы держать дрель в непрерывном режиме, а затем гладкие диски всех ваших блюд, удерживая каждое блюдо и перемещая его от шлифовального немного сгладить грубые края новые дыры.
- Положите все основания блюдо в большой стакан и промойте их несколько раз дистиллированной водой, чтобы удалить небольшие, свободные куски пластика или пенопласта (который будет плавать). После этого лежал блюдо нижнего предела для просушки.
- Когда блюда сухой, подготовить Sylgard 184 клей. Нанесите небольшое круг клеем вокруг отверстия на внешней поверхности каждого блюда. Не так много клея, необходимо, в самом деле, слишком много клея сделают беспорядок. Место покровного стекла над отверстием, при контакте с клеем. Покровного стекла должны сидеть на блюдо плавно и равномерно. Если клей не идеально распределены вокруг отверстия, то там могут быть небольшие пробелы там, где не хватает клея между стеклянной крышкой и блюдо дно. Первоначально не беспокоиться об этих пробелов; обычно клей будет проникать в эти пробелы заполнить их.
- После склеивания всех покровного стекла, вернуться и проверить блюд на пробелы, которые не были закрыты клея. В любую щель, нанесите небольшое прикосновение клея к краю покровного стекла вблизи щели; клей фитиль в зазор.
- Установить блюда в сторону, снизу вверх, чтобы высохнуть. Это может занять сутки и более при комнатной температуре, но вы можете увеличить скорость отверждения, поставив посуду в теплом инкубаторе.
- Если вам нужны стерильные чашки, положить блюдо днища и крышки капота в культуре ткани и разложил их. Не кладите крышки на блюдо основания. Вместо этого, свою очередь, куски так, что их внутренняя поверхность тяжелымctly перед УФ-лампа. Включите стерилизации УФ-светом, по крайней мере 45 мин. Если вы планируете ConA пальто блюд (см. ниже), не стерилизовать посуду, пока они покрыты.
- Блюда готов к использованию.
- Sylgard 184 силиконового эластомера комплект
- Использование конканавалин
Лектина, конканавалин (ConA), был найден, чтобы стимулировать S2 клетках, чтобы сгладить против поверхности, покрытой ConA 3. Когда S2 клетки высевают на покрытие скользит покрытая ConA, они распространяются и становятся отличным образцов для микроскопии.- Для ConA пальто равнине скользит крышка, распространение очищены крышка скользит поверх кусок парафильмом выявляется до скамейки наверху. Место 10 μLs от 0,5 мг / мл раствора ConA (в стерильной воды) на поверхности каждого покровным стеклом, а затем распределите материал по всей верхней части крышки скольжения. После сушки, хранения крышка сползает в чистый, сухой контейнер. Стекла с покрытием можно стерилизовать с помощью УФ-света в капот культуры ткани.
- Для ConA пальто со стеклянным дном посуды, так же распространяется на 10 μLs ConA раствор на верхней стороне (то есть, крышка-лицевой стороны) стекла. После сушки блюда можно стерилизовать как описано выше. ConA покрытием блюда или покровные хранятся при комнатной температуре и может быть использован месяцев после приготовления.
- Изображений
- Аккуратно ресуспендирования RNAi обработанных S2 клетках и перевести их на ConA покрытием, стеклянным дном блюдо, содержащий 2 мл среды. Здоровые клетки, что контакт ConA покрытием покровным стеклом будет придерживаться плотно к нему и начать распространяться. Этот процесс должен проявляться примерно на 15 мин, и должна быть завершена к 45 мин до 1 часа. Обратите внимание, что прилагается клетки не могут выполнять цитокинеза из-за их жесткой привязанности к ConA покрытием поверхности и станет полиплоидных с течением времени. Клетки высевали в ConA покрытием блюда будут оставаться здоровыми в течение длительного периода, но не будут размножаться в этих блюд.
- После клетки прилагается, среда может быть обменен, если старый среды autofluorescent. Это не может быть необходимой для исследований с использованием конфокальной или деконволюции микроскопов или широким полем зрения микроскопа с небольшой глубины резкости целей.
- Так как S2 клетки здоровых при комнатной температуре / нормальной атмосфере, то никаких специальных условий или оборудования, которые необходимы при клетки под микроскопом. Мы часто занимает много времени замедленной фильмы живых S2 клетках. На практике выполнения этих экспериментов ограничивается обычными проблемами фотообесцвечивания и фототоксичности.
Б. Исправлена микроскопии ячейки
- Стекло-дно блюда по сравнению с простой скользит обложки: Любой из них может быть использован при фиксации клеток. При использовании обычной квитанции покрова, место одного ConA покрытием крышки скольжения в отдельных 35мм блюдо (что не должны быть класса культур тканей), добавьте 2 мл средствах массовой информации, а затем передать RNAi обработанных клеток в блюдо. После клетки прикреплены к покровным стеклом, удалите среды, кратко мыть клетки с соответствующим буфером (PBS работает хорошо), а также добавить фиксатором (см. ниже), чтобы блюдо. После этого покровное стекло может быть удален из тарелки и дальнейшей обработке, например, иммунной окраски.
- Фиксация: разнообразные методы были использованы для исправления S2 клетках. Лучший способ фиксации будет определяться тем, насколько хорошо фиксирующий сохраняет особенности интересов, не разрушая или потери эпитопов или на ярлыке белков. Некоторые процедуры требуют извлечения шаг, прежде чем фиксация того, чтобы разоблачить эпитопов некоторые белки, расположенные в плотных или компактных структур. Так как S2 литературы ячейки довольно обширна, как правило, можно найти опубликовал метод оптимально исправить вашу S2 клеточная структура интересов.
- Метанол является общим фиксатором. Метанола должна быть холодной (по крайней мере от -20 ° C) и безводный (молекулярных сит [тип 3А] могут быть добавлены в метаноле к абстрактным воды). Мы холод около 300 мл безводного метанола в закрытом 1L стакан стекло в взрывозащищенные 20 морозильник ° C. Когда метанол холодной, удалите его из морозильника, быстро удалить среды от стеклянным дном блюдо (или блюдо с покровным стеклом), а затем быстро окунуться блюдо вниз в метаноле и оставить его там. Стакан метанола обычно содержит около десятка блюд. Работают быстро и вернуть стакан (содержащей блюд) в морозильную камеру как можно скорее. Фиксация полна в 10-15 мин. Затем удалить блюда из стакана, залить любую метанола, остающихся в них, и увлажняет их, добавляя PBS / 0,1% Тритон Х-100. Теперь они готовы для стандартной процедуры окрашивания.
- Формальдегид является еще одним распространенным фиксатором. Мы используем 10% формальдегида в буфере (PBS является приемлемым, но и использовать буфер наиболее подходящий для ваших нужд). Мы используем это относительно высокая концентрация формальдегида, потому S2 клеткахотсутствие цитоплазматических промежуточных филаментов, которые иначе помогают поддерживать морфологии клеток и организации в ходе фиксации процесса.
- Вылейте фиксатором в отходы стакан и мыть фиксированной клетки с тремя краткими моет из PBST (PBS + 0,1% TritonX-100).
- Затем добавьте 1 мл блокирование решения клетки в течение 15 минут. Мы регулярно использовать 5% нормальной козьей сывороткой в PBST.
- Вылейте блокирующий раствор и добавить первичных антител (разбавленный в блокировании решения) непосредственно на клетки. 100 мкл раствора антител должна полностью закрывать клеток. Место крышкой Петри обратно на блюдо для предотвращения испарения раствора антител. Пусть антител инкубировать с клетками в течение 30 минут при комнатной температуре.
- Удалить раствора антител и выполнить три моет PBST. Использование передачи пипетки добавить 2 мл PBST к блюду. Подождите 5 минут между каждым мыть (не нужно вращать блюдо).
- Вылейте последние вымыть и добавить 100 мкл вторичные антитела (разбавленный в блокировании решения) непосредственно на клетки. Место крышкой Петри обратно на блюдо для предотвращения испарения раствора антител. Пусть антител инкубировать с клетками в течение 30 минут при комнатной температуре.
- Удалить вторичных антител и выполнить три 5 минут смывает с PBST. После захоронения последнего мыть, добавьте несколько капель вашего монтажа средств по выбору непосредственно на клетки. Мы используем 0,1 М пропилгаллат растворенного в раствор глицерина: PBS (9:1) и хранить при температуре 20 ° C. Замените крышку Петри и хранить блюдо в темную зону.
3. Ограничения / проблемы
Как и в любой экспериментальной системы, Есть ограничения на использование S2 клетках. Во-первых, культурный S2 клетки обычно имеют низкий индекс митотической (около 1% в бессывороточной СМИ), в то время митотического индексов для многих превращается клеточных линий млекопитающих находятся целых 10 раз выше. Поэтому для исследования митотических фенотипы, S2 клеточных культур требуют больше поиска, чтобы найти надлежащий-ступенчатую клеток. Во-вторых, для изучения клеточного цикла, медикаментозного лечения очень эффективны при аресте S2 клетки в определенные фазы клеточного цикла. Тем не менее, соединений, которые обратимо клеточного цикла ареста эффекты в культивируемых клетках млекопитающих не легко вымывания в S2 клетках. Таким образом, протоколы для синхронизации пролиферирующих S2 клетки не установлена. В-третьих, S2 клетки не мигрирующие они не отображать эпителиальных характеристик.
4. Ожидаемые результаты
Самым продаваемым точкой для S2 клетках их полезность в качестве модельной системы. Они особенно полезны для оценки клеточных функций вашего белок: S2 клетки лечат RNAi использованием дсРНК, который легко (и относительно дешево), синтезированных в лаборатории, и они служат также для живых клеток и анализа для иммунофлуоресценции основных клетки . Кроме того, ключевым преимуществом в S2 клетках легкость, с которой они могут храниться в лаборатории, с использованием относительно недорогих бессывороточной среде и никакой культуры тканей инкубатора.
Типичный эксперимент будет включать покрытие S2 клеток в соответствующий контейнер культуры ткани (скажем, 6 или 96 лунками), добавив, самодельные дсРНК в лунки, а затем поддержание культуры как целевые белки постепенно исчерпывается RNAi. В зависимости от целевых белков истощаются, клетки могут показать, морфологических и / или изменение поведения в результате целевого белка нокдаун. Время, необходимое для снижения выражения целевого белка до минимума специфична для белок и должны определяться Западной блоттинга.
Обычно S2 клетках не придерживаются плотно пластика или стекла, и это создаст проблему для экспериментов, требующих микроскопическом исследовании обработанных клеток. Тем не менее, S2 клетки могут быть вызваны, чтобы сгладить широко просто покрытие их на поверхности, покрытой лектина, конканавалин (ConA). В течение часа покрытие на ConA, большинство клеток потеряли округлый вид, как результат распространения широко на поверхности ConA (рис. 1). Клетки теперь готовы для дальнейшей обработки (например, путем фиксации и иммунной) или микроскопические наблюдения живых клеток.
S2 клетки могут также быть трансфекции (с использованием различных химических реагентов или электропорации) либо временно выразить экзогенного гена или стабильно включить ген в геном (таким образом, создавая клеточную линию, которая поддерживает экзогенных генов путем многократных подразделений). Трансфекции может служить многим целям, как и выражение флуоресцентно меткой белки, которые отмечают структур интерес к фиксированным или живые клетки (рис. 2), или которые используются в качестве приманки в естественных условиях в выпадающем или иммунопреципитации экспериментов и т.д.
Метод анализа, зависит, кулоновскогоРФБ, на биологические вопрос решается путем эксперимента. Общий метод анализа RNAi обработанных S2 клетках иммунофлюоресценции основных клеток (рис. 3). Например, иммунофлюоресценции обычно используется с генома экраны библиотек дрозофилы ген быстро идентифицировать белки с интересными деятельности в естественных условиях. Анализ можно сделать более сложные одновременного истощения нескольких белков цели в S2 клетках, чтобы исследовать потенциал функциональных взаимодействий между белков-мишеней. И анализ может быть распространен на живые клетки, чтобы наблюдать эффект РНК-интерференции на динамических процессов. Опять же, S2 клетки являются особенно хорошо подходит для такого рода анализа, поскольку они могут высевают на ConA покрытые прозрачным дном посуды и визуализируется в течение многих часов на инвертированный микроскоп без необходимости экологической палаты.

Рисунок 1. Фазового контраста изображения (20-кратным увеличением) на S2 клетках при посеве на конканавалин покрытые прозрачным дном тарелку. Цифры указывают минут после металлизации. Обратите внимание, что клетки становятся фазы темно, как только они сглаживаются на покрытие скольжения покрытия. Сотовые уплощение видно на 15 мин (стрелки) и, по сути завершена к 60 мин. Справа: увеличенное изображение прилагается клеток, их расширенных и уплощенных полях четко видны (стрелки). Шкала бар (за четыре левой панели), 20 мкм.
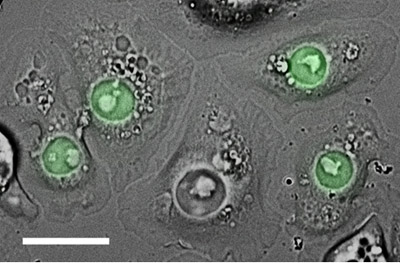
Рисунок 2. S2 клетках временно трансфицированных слияние построить состоящий из nucleophosmin (маркер для ядра), слитый с флуорофора, EGFP (зеленого цвета). Эти клетки высевают на ConA покрытые прозрачным дном тарелку, а затем полученную с ДВС и epifluorescence. Шкала бар, 15 мкм.
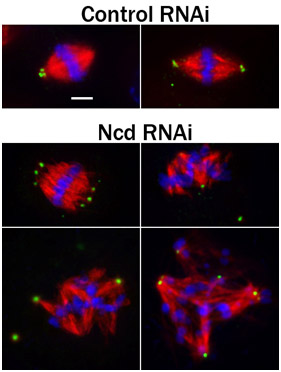
. Рисунок 3 Исправлены S2 клетках immunostained для ПЛП (зеленый, маркер центриоль), микротрубочки (красный), и Hoechst-окрашенные (синий) для хромосом. Перед фиксацией и иммунной, клетки были подвергнуты 4-й день лечения или с контролем РНК-интерференции, или RNAi в нокдаун НИЗ, кинезин-подобный белок, который способствует шпинделя полюса "фокусировки" 4. Обратите внимание, растопыренными шпинделя полюсов и дезорганизованы шпинделей в клетках, обработанных НИЗ RNAi. Шкала бар, 2,5 мкм.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Для поля клеточной биологии, идеальная система была бы недорогой в обслуживании, легко манипулировать, и поддаются различных методов. Drosophila S2 клетках удовлетворяют этим требованиям, и поэтому они быстро стали системой для все большего числа клеточных биологии лаборатории.
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Благодарности
Эта работа была выполнена при частичной поддержке Национального института рака P30 CA23074, American Cancer Society институциональных исследований Грант 74-001-31, а Univ. Аризона И. SPORE (NCI / NIH CA9506O).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| S2 cells | ATCC | CRL-1963 | http://www.atcc.org/ |
| S2 cells | DGRC | stock number 6 | https://dgrc.cgb.indiana.edu/ |
| S2 cells | Invitrogen | R690-07 | |
| Sf900 II | Invitrogen | 10902-096 | serum-free medium |
| HyClone SFX-Insect | Thermo Fisher Scientific, Inc. | SH30278 | serum-free medium |
| Insect-Xpress | BioWhittaker | 12-730 | serum-free medium |
| Schneider’s S2 medium | Invitrogen | 11720-034 | Add 10% (final) heat-inactivated FBS to make complete medium. |
| Fetal bovine serum | Invitrogen | 10438026 | heat inactivated |
| 100x antibiotic solution | MP Biomedicals | 91674049 | contains penicillin (10000 U/mL), streptomycin (10000 μg/mL), and amphotericin B (25 μg/mL) |
| Concanavalin A | MP Biomedicals | 195283 | |
| Formaldehyde | Electron Microscopy Sciences | 15714 | 32% solution |
| Methanol | Mallinckrodt Baker Inc. | 9049 | anhydrous, ACS grade |
| Molecular sieves | Acros Organics | 19724 | type 3A |
Ссылки
- Schneider, I. Cell lines derived from late embryonic stages of Drosophila melanogaster. J Embryol Exp Morphol. 27, 353-365 (1972).
- Rogers, S. L., Rogers, G. C. Culture of Drosophila S2 cells and their use for RNAi-mediated loss-of-function studies and immunofluorescence microscopy. Nat Protoc. 3, 606-611 (2008).
- Rogers, S. L., Rogers, G. C., Sharp, D. J., Vale, R. D. Drosophila EB1 is important for proper assembly, dynamics, and positioning of the mitotic spindle. J Cell Biol. 158, 873-884 (2002).
- Goshima, G. Genes required for mitotic spindle assembly in Drosophila S2 cells. Science. 316, 417-421 (2007).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены