Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation des Drosophile Les cellules S2 pour la microscopie optique
Dans cet article
Résumé
Drosophila Schneider (S2), les cellules sont un système de plus en plus populaire pour la découverte et l'analyse fonctionnelle des gènes. Notre objectif est de décrire quelques-unes des techniques microscopiques qui rendent les cellules S2 un tel système en plus important d'expérimentation.
Résumé
Le système idéal d'expérimentation serait bon marché et facile à entretenir, se prêtant à une variété de techniques, et serait soutenu par une abondante littérature et de base de données la séquence du génome. Des cultures de cellules S2 de drosophile, le produit des embryons de 20 à 24 heures dissocié ancienne 1, possèdent toutes ces propriétés. Par conséquent, les cellules S2 sont extrêmement bien adapté pour l'analyse des processus cellulaires, y compris la découverte des gènes codant pour les composants moléculaires du processus ou mécanisme d'intérêts. Les caractéristiques des cellules S2 qui sont les plus responsables de leur utilité sont la facilité avec laquelle ils sont maintenus, leur sensibilité exquise à double brin (ds) ARN médiée par l'interférence ARN (ARNi), et leur traçabilité à la microscopie par fluorescence que ce soit en direct ou fixes cellules.
Les cellules S2 peuvent être cultivés dans une variété de médias, y compris un certain nombre de bon marché, disponibles dans le commerce, entièrement défini, un milieu sans sérum 2. De plus, ils poussent de façon optimale et rapide à 21-24 ° C et peuvent être cultivées dans une variété de conteneurs. Contrairement aux cellules de mammifères, les cellules S2 ne nécessitent pas une atmosphère régulée, mais plutôt bien faire avec l'air normal et peut même être maintenu dans des flacons étanches.
Complétant la facilité de l'ARNi dans les cellules S2 est la capacité à analyser les phénotypes facilement induite expérimentalement par phase ou la microscopie à fluorescence de cellules fixées ou vivantes. Les cellules S2 grandir dans la culture comme une seule monocouche, mais ne pas afficher l'inhibition de contact. Au lieu de cela, les cellules ont tendance à croître en colonies dans les cultures denses. A faible densité, les cultures cultivées sur S2 en verre ou en culture de tissus traités en plastique sont ronds et peu-joint. Toutefois, l'examen cytologique des cellules S2 peut être grandement améliorée en les incitant à aplatir en cultivant intensivement brièvement eux sur une surface revêtue de la lectine, la concanavaline A (ConA) 3. Les cellules S2 peut aussi être transfectées de façon stable avec des marqueurs marqués par fluorescence à des structures étiquette ou organites d'intérêt dans les cellules vivantes ou fixées. Par conséquent, le scénario habituel pour l'analyse microscopique des cellules est la suivante: d'abord, les cellules S2 (qui peuvent posséder des transgènes à exprimer des marqueurs marqués) sont traitées par RNAi pour éliminer une protéine cible (s). Temps de traitement ARNi peut être ajusté pour tenir compte des différences dans les protéines turn-over cinétique et pour minimiser les traumatismes de cellules / décès si la protéine cible est importante pour la viabilité. Ensuite, les cellules traitées sont transférés dans une boîte contenant une lamelle pré-enduites de conA d'induire les cellules à se répandre et bien adhérer au verre. Enfin, les cellules sont imagés avec le choix du chercheur de modes de microscopie. Les cellules S2 sont particulièrement bonnes pour les études nécessitant la visualisation prolongée des cellules vivantes, puisque ces cellules rester en bonne santé à la température ambiante et une atmosphère normale.
Protocole
1. Préparation des cellules S2 pour la microscopie
Cellules Schneider S2 ont été tirées de la trypsine embryons fin de l'Oregon R drosophile. Culture d'origine de Schneider se composait d'un mélange de types de cellules, mais sont devenus plus homogènes avec passage continu 1. Ils ont été décrits comme étant de type macrophage (ils sont phagocytaire) avec l'expression du gène hémocytes-like. Les cellules S2 peuvent être obtenus auprès de l'ATCC, DGRC, ou Invitrogen.
A. Sélection de milieu de croissance
Un certain nombre de médias ont été utilisées pour cultiver des cellules S2. Aucun des médias mentionnés ci-dessous nécessitent un 5% de CO 2 atmosphérique.
- Schneider à l'origine utilisé son milieu défini (milieu de Schneider drosophile) complété avec 10% inactivés par la chaleur du sérum de veau fœtal (FBS). Bien FBS rend ce moyen plus coûteux que les milieux sans sérum mentionnés ci-dessous, il a autofluorescence relativement faible et est donc un bon choix pour la microscopie à épifluorescence de cellules vivantes. Toutefois, il ne contient en métal suffisante pour stimuler un faible niveau d'expression de ces transgènes sous le contrôle du promoteur de la métallothionéine inductible (par exemple, les gènes sous-clonés dans le vecteur d'Invitrogen PMT), causant des "fuites" l'expression du gène avant l'induction.
- Plusieurs milieux exempts de sérum sont commercialement disponibles (par exemple, SF900 II, HyClone SFX-Insecte, et les insectes-Xpress). Ces médias sont relativement peu coûteux, mais stimulent généralement des niveaux plus élevés d'expression lors de l'utilisation métallothionéine promoteur régulé transgènes par rapport aux moyennes de Schneider. En outre, ces médias produisent autofluorescence significative par rapport à moyenne Schneiders / FBS (une considération importante lors de l'exécution en direct de microscopie par fluorescence cellulaire).
- Optionnellement, les antibiotiques peuvent être ajoutés dans le milieu, qui sont habituellement la pénicilline G et du sulfate de streptomycine (50-100 unités / ml et 50-100 pg / ml concentrations finales, respectivement). En outre, le réactif anti-fongique, l'amphotéricine B, peuvent être ajoutés à 250 ng / ml (concentration finale).
Les conditions de culture B.
Les cellules S2 sont facilement maintenus sous une température de laboratoire normales et les conditions de l'atmosphère. Quand l'imagerie des cellules vivantes S2 pendant des périodes prolongées, les principales causes de la mort cellulaire sont la déshydratation et la photo-toxicité. La déshydratation est facilement évitée en gardant suffisamment de moyens dans le plat sur le microscope. Photo-toxicité est un délicat problème qui nécessite en minimisant l'exposition des cellules cumulatif à haute intensité, lumière de haute énergie tout en imagerie assez souvent pour capturer des événements intéressants avec une résolution spatiale et temporelle suffisante.
- Les cellules S2 croissante sur la culture de tissus en plastique sont généralement arrondis et faiblement adhérentes. Les cellules confluentes grandir comme une monocouche dense et puis, en plus, plusieurs cellules se décoller et pousser en suspension. Pour la microscopie des deux cellules fixes et de vivre, l'imagerie est grandement améliorée si les cellules sont induites pour aplatir sur la lamelle. Cette astuce est décrit ci-dessous (2. A. 2.).
2. Microscopique des cellules S2
A. microscopie de cellules vivantes
Nous utilisons des microscopes inversés de visualiser en direct les cellules S2 plaqué sur un fond en verre plats. Les plats à fond de verre décrite ci-dessous maintenir les cellules dans un état très semblable à leur état normal de la culture, et permet également de cellules vivantes pour être examinés par microscopie de qualité en verre.
- Préparation du fond de verre plats
Composants:- Sylgard 184 kit d'élastomère de silicone
Il s'agit de la colle pour fixer les lamelles de la vaisselle. Le kit dispose d'un deux pièces, le composant de base de résine et le durcisseur, qui sont mélangés à un 10h01 (résine: durcisseur) rapport poids juste avant utilisation.
Pour préparer le mélange d'agent de résine / durcissement:- Peser environ 5 g de la résine dans un plastique pèsent bateau. Notez le poids de la résine.
- Calculez combien l'agent de durcissement est nécessaire en multipliant le poids de la résine de 0,1. Ajouter cette quantité d'agent de durcissement pour les mêmes pèsent bateau à l'aide d'une pipette de transfert.
- Remuer pour bien mélanger les composants. Ne vous inquiétez pas les bulles qui apparaissent, ils vont lentement disparaître.
- La colle est maintenant prêt. Il a une consistance de miel et sera utilisable pour au moins une heure. 5,5 g de colle est assez pour faire environ 75 plats, mais cela dépend de combien vous êtes radin quand vous appliquez la colle.
- Plastique 35mm boîtes de Pétri
Nous n'utilisons pas les plats de culture de cellules de grade parce que nous sommes seulement intéressés à avoir des cellules attacher au fond de verre (et non pas le plastique) - de sorte qu'au lieu que nous utilisons moins chers, standard des boîtes de Petri. Certaines étapes ont microscope pinces circulaires de détenir 35plats mm; si vous avez cela, être sûr que votre vaisselle s'adaptera la pince. Étonnamment, tous les plats de 35mm ont le même diamètre extérieur. - Couverture en verre
Choisissez lamelles appropriée à votre microscope et les besoins. Tout de verre de spécialité coûteux avec photogravé grilles (par exemple, en sciences Electron Microscopy, 23x23 mm circulaires, rectangulaires, non. 2, cat. Aucune. 72264-23) pour couvrir le verre en vrac beaucoup moins cher (par exemple, VWR, 22x22 mm carré de verre , non. 1.5, cat. aucune. 48366-227) pourraient être utilisés. Attention: Le verre doit être légèrement plus grande (au moins environ 1mm) que le trou que vous ferez dans la boîte de Petri, et doit également être plus petit que le diamètre de l'assiette. Si vous avez l'intention d'acheter en verre carré, être sûr que le verre se couvrir complètement (et prolonger un peu au-delà), le trou circulaire, mais n'atteindra pas les côtés du plat. Si vous préférez nettoyer votre couvercle en verre, le faire avant de les coller sur les plats. - Perceuse électrique
Nous utilisons une perceuse à main à vitesse variable et un bouton de verrouillage pour une utilisation continue sur. Plats de forage est beaucoup plus facile avec une perceuse à colonne, mais la production à petite échelle de fond de verre plats ne justifie pas l'achat d'une perceuse à colonne. - Mèche
Utilisez un ¾ pouces bits forage chat (un peu bêche est représenté sur cette page: http://en.wikipedia.org/wiki/Drill_bit). Bien sûr, le diamètre du bit détermine le diamètre du trou dans le fond du plat. - Conique foret meulage
Utilisez un peu de forme conique de broyage avec un gros grain et un diamètre d'environ le même que le petit chat. Après tous les trous ont été forés, utiliser ce bit à fraise loin fragments de plastique sur le bord du trou que le projet du fond du plat. Les fragments de plastique sur la face extérieure du plat va empêcher le couvercle en verre de la position assise tout contre le plat. Ne vous préoccupez pas de petites pièces en plastique collant vers le haut dans l'intérieur du plat: ils n'affecteront pas le couvercle en verre ou les cellules. - Boîte en polystyrène avec des murs épais
Il est utilisé comme la surface de forage. Couvrir un côté extérieur de la boîte de styromousse avec des bandes de ruban adhésif (nous utilisons 1,5 pouces de bandes d'étanchéité Scotch), le ruban adhésif minimise la fuite des morceaux de styromousse en cours de forage.
Assemblée- Placer la moitié inférieure d'un plat de Pétri de 35mm sur la surface de la boîte de styromousse scellés de; placer le plat afin que le fond est de son côté contre la boîte de styromousse. Tout en tenant les côtés du plat fermement, percer un trou dans le plat. Attention: Vos doigts tenant le plat sera une fraction de pouce d'un foret en rotation. Naturellement, cela est dangereux. Arrêter le forage si le plat commence à tourner. Si vous avez une perceuse à colonne et / ou une façon habile de tenir fermement le plat, les utiliser. Nous n'avons jamais eu un accident, mais faire tout ce dont vous avez besoin pour faire de cette procédure sécuritaire.
- Après le perçage de tous vos plats, lisses le rebord extérieur des trous avec la mèche de meulage. On place la perceuse sur le côté, avec le bit saillie sur le bord du comptoir. Le forage est maintenu en place en plaçant quelque chose de lourd, mais souple sur elle (nous utilisons un sac en plastique contenant lourds 10 kg de sable). Utilisez le bouton de verrouillage pour maintenir le fonctionnement continu du forage, puis lisser les bords de tous vos plats en tenant chaque plat et en le déplaçant contre la meule pour lisser les bords rugueux du nouveau trou.
- Mettre tous les fonds plat dans un grand bécher et rincer plusieurs fois avec de l'eau distillée pour éliminer les petites, perdre des morceaux de plastique ou de styromousse (qui flottent). Ensuite, poser le fond plat pour sécher.
- Lorsque les plats sont secs, préparez votre Sylgard 184 de la colle. Appliquer un petit cercle de colle autour du trou foré sur la surface extérieure de chaque plat. Pas beaucoup de colle est nécessaire, en fait, trop de colle va faire un gâchis. Placez un couvercle en verre sur le trou, en contact avec la colle. Le couvercle en verre doit s'asseoir contre le plat en douceur et uniformément. Si la colle n'était pas parfaitement distribuées autour du trou, puis il pourrait y avoir de petites trouées où la colle est manquant entre le couvercle en verre et en bas plat. Initialement ne vous inquiétez pas au sujet de ces lacunes; généralement la colle va se glisser dans ces lacunes pour les combler.
- Après le collage sur l'ensemble de la lamelle, revenir en arrière et vérifier les plats pour les lacunes qui n'ont pas été fermées par de la colle. À tout écart, appliquer une mince couche de colle sur le bord du verre couvre près de l'écart, la colle sera mèche dans le fossé.
- Régler les plats de côté, côté bas en haut, à sécher. Cela peut prendre une journée ou plus à la température ambiante, mais vous pouvez augmenter la vitesse de durcissement en mettant les petits plats dans une ambiance chaleureuse incubateur.
- Si vous avez besoin des boites stériles, mettre le fond plat et les couvercles dans une hotte de culture de tissus et de les étaler. Ne pas mettre le couvercle sur le fond plat. Au lieu de cela, tournez les morceaux de sorte que leurs surfaces intérieures sont désastreusescte face à la lampe UV. Allumez la lumière UV de stérilisation pour au moins 45 min. Si vous envisagez de manteau de ConA les plats (voir ci-dessous), ne pas stériliser les plats qu'après ils sont enduits.
- Les plats sont maintenant prêts à utiliser.
- Sylgard 184 kit d'élastomère de silicone
- En utilisant la concanavaline A
La lectine, la concanavaline A (ConA), a été trouvé pour stimuler les cellules S2 à aplatir contre une surface revêtue ConA 3. Lorsque les cellules S2 sont ensemencées sur des lamelles enduits de ConA, ils se propagent et deviennent d'excellents spécimens pour la microscopie.- Pour ConA glisse couche de couverture simple, réparties sur les lamelles nettoyé au sommet d'un morceau de parafilm scellés jusqu'à une paillasse. Placer 10 μLs de 0,5 mg / ml solution de ConA (dans l'eau stérile) sur la surface de chaque lamelle, et ensuite passer le matériau sur tout le sommet de la lamelle. Après séchage, de stocker les lamelles dans un récipient propre et sec. Le verre à couche peut être stérilisé à la lumière UV dans une hotte de culture de tissus.
- Pour ConA manteau à fond de verre plats, de la même écart de 10 μLs de la solution de ConA sur la face supérieure (ie, le couvercle côté faisant face) de la vitre. Après séchage, les plats peuvent être stérilisés comme décrit ci-dessus. ConA enduit de la vaisselle ou des lamelles sont stockés à température ambiante et peut être utilisé mois après la préparation.
- Imagerie
- Doucement remettre les cellules traitées à l'ARNi S2 et les transférer à un ConA-couché, à fond de verre plat contenant 2 ml de milieu. Les cellules saines que le contact de la lamelle ConA enduit adhère étroitement à elle et commencent à se répandre. Ce processus devrait être apparent d'environ 15 min, et devrait être terminée d'ici 45 minutes à 1 heure. Notez que les cellules attachées ne pouvez pas effectuer cytokinèse en raison de leur attachement serrés à la surface de ConA-couché et deviendra au fil du temps polyploïdes. Les cellules ensemencées dans ConA enduits plats restera pendant de longues périodes, mais ne sera pas proliférer dans ces plats.
- Après les cellules ont joint, le milieu peut être échangé, si l'ancien milieu est autofluorescente. Cela peut ne pas être nécessaire pour des études à l'aide de microscopes confocaux ou déconvolution ou à grand champ microscopes à de faibles profondeurs de champ des objectifs.
- Comme les cellules S2 sont en bonne santé à la température ambiante / atmosphère normale, alors pas de conditions spéciales ou des équipements sont nécessaires lorsque les cellules sont sur le microscope. Nous prenons souvent à long time-lapse films de cellules vivantes S2. En pratique, l'exécution de ces expériences est limitée par les problèmes habituels de photoblanchiment et de phototoxicité.
B. microscopie cellulaire fixe
- À fond de verre plats vs lamelles clair: soit ces éléments peuvent être utilisés lors de la fixation des cellules. Lors de l'utilisation des lamelles simples, placer une lamelle simple ConA enduit dans un plat individuel de 35mm (ce qui n'a pas besoin d'être de qualité culture de tissus), ajouter 2 ml de médias, puis de transférer les cellules traitées à l'ARNi dans le plat. Après les cellules ont attaché à la lamelle, éliminer le milieu, brièvement laver les cellules avec un tampon approprié (PBS fonctionne bien), et ajouter le fixatif (voir ci-dessous) à l'antenne. Ensuite, la lamelle peut être retiré de l'antenne parabolique et traitées ultérieurement, par exemple, par immunomarquage.
- Fixation: Une variété de méthodes ont été utilisées pour fixer les cellules S2. La meilleure méthode de fixation sera déterminé par la façon dont un fixateur préserve les caractéristiques d'intérêt, sans détruire ou de perdre des épitopes ou des protéines marquées. Certaines procédures nécessitent une étape d'extraction avant la fixation afin d'exposer les épitopes de certaines protéines situées dans les structures denses ou compactes. Depuis la littérature cellules S2 est assez vaste, il est généralement possible de trouver une méthode publiée de façon optimale fixer votre structure cellulaire S2 d'intérêt.
- Le méthanol est un fixateur commun. Le méthanol doit être froide (au moins -20 ° C) et anhydre (tamis moléculaires [type 3A] peut être ajouté à la méthanol pour extraire l'eau). Nous réfrigérer environ 300 ml de méthanol anhydre dans un récipient en verre 1L couverte dans un congélateur anti-déflagrant 20 ° C. Lorsque le méthanol est froid, retirez-le du congélateur, enlever rapidement le support de l'antenne à fond de verre (ou un plat contenant une lamelle), puis rapidement plonger le plat vers le bas dans le méthanol et l'y laisser. Le bécher de méthanol tient habituellement environ une douzaine de plats. Travaillez rapidement et retourner le bécher (contenant les mets) au congélateur dès que possible. La fixation est complète en 10-15 min. Ensuite, retirer les plats du bécher, versez tout le méthanol reste en eux, et les réhydrater en ajoutant du PBS / 0,1% de Triton X-100. Ils sont maintenant prêts pour les procédures de coloration standard.
- Le formaldéhyde est un autre fixateur commun. Nous utilisons 10% de formaldéhyde dans un tampon (PBS est acceptable, mais utiliser le tampon le plus approprié à vos besoins). Nous utilisons cette concentration relativement élevée de formaldéhyde, car les cellules S2le manque cytoplasmique filaments intermédiaires qui seraient autrement aider à maintenir la morphologie cellulaire et de l'organisation pendant le processus de fixation.
- Verser le fixateur dans un bécher de déchets et de laver les cellules fixées avec trois lavages brève de PBST (PBS + 0,1% TritonX-100).
- Ensuite, ajoutez 1 ml d'une solution de blocage sur les cellules pendant 15 minutes. Nous utilisons régulièrement 5% sérum de chèvre normal dans le PBST.
- Décanter la solution de blocage et ajouter l'anticorps primaire (dilué dans une solution de blocage) directement sur les cellules. 100 ul de solution d'anticorps doit couvrir complètement les cellules. Placez le couvercle sur le plat de Pétri de retour pour empêcher l'évaporation de la solution d'anticorps. Laissez incuber des anticorps avec les cellules pendant 30 minutes à température ambiante.
- Retirer la solution d'anticorps et d'effectuer trois lavages PBST. Utiliser une pipette de transfert d'ajouter 2 ml de PBST à l'antenne. Attendre 5 minutes entre chaque lavage (pas besoin de remuer le plat).
- Décanter le dernier lavage et ajouter 100 ul d'anticorps secondaire (diluée dans une solution de blocage) directement sur les cellules. Placez le couvercle sur le plat de Pétri de retour pour empêcher l'évaporation de la solution d'anticorps. Laissez incuber des anticorps avec les cellules pendant 30 minutes à température ambiante.
- Retirez l'anticorps secondaire et effectuer trois lavages de 5 minutes avec du PBST. Après le dumping le dernier lavage, ajoutez quelques gouttes de vos supports de fixation de choix directement sur les cellules. Nous utilisons 0,1 M gallate de propyle dissous dans une solution de glycérol: PBS (9:1) et stocké à 20 ° C. Replacez le couvercle de Petri et de stocker le plat dans un environnement sombre.
3. Limitations / problèmes
Comme avec n'importe quel système expérimental, il ya des limites à l'utilisation de cellules S2. Tout d'abord, les cellules cultivées S2 présentent généralement un index mitotique faible (environ 1% en milieu sans sérum), tandis que les indices mitotiques pour beaucoup transformé lignées cellulaires de mammifères sont autant que 10 fois plus élevée. Par conséquent, pour les études des phénotypes mitotiques, des cultures de cellules S2 nécessitent une plus longue recherche pour trouver les cellules convenablement mis en scène. Deuxièmement, pour les études du cycle cellulaire, les traitements médicamenteux sont très efficaces pour arrêter les cellules S2 cours spécifiques phases du cycle cellulaire. Cependant, des composés qui ont réversibles cycle cellulaire effets arrêtant dans des cultures de cellules de mammifères ne sont pas facilement dans les cellules S2 de lavage. Ainsi, les protocoles pour la synchronisation de la prolifération des cellules S2 n'ont pas été établies. Troisièmement, les cellules S2 ne sont pas migrateurs et ils ne présentent des caractéristiques épithéliales.
4. Résultats attendus
Le principal argument de vente pour les cellules S2 est leur utilité en tant que système modèle. Ils sont particulièrement utiles pour évaluer les fonctions cellulaires de votre protéine d'intérêt: les cellules S2 sont traités par ARNdb ARNi utilisant qui est facilement (et relativement bon marché) synthétisé en laboratoire, et elles servent bien pour l'analyse de cellules vivantes et pour l'immunofluorescence des cellules fixées . En outre, un avantage clé pour les cellules S2 est la facilité avec laquelle ils peuvent être maintenus dans le laboratoire, en utilisant relativement peu coûteux milieu sans sérum et sans incubateur de culture tissulaire.
Une expérience typique impliquerait plaquage cellules S2 dans un récipient de culture de tissus appropriés (par exemple, une plaque de 6 ou 96 puits), en ajoutant home-made ARNdb dans les puits, et ensuite l'entretien des cultures comme les protéines ciblées sont progressivement épuisés par RNAi. Selon les protéines cibles étant épuisé, les cellules peuvent montrer un changement morphologique et / ou de comportement en raison de protéine cible le knock-down. Le temps nécessaire pour réduire l'expression des protéines cibles au minimum est spécifique à la protéine et devrait être déterminée par Western blot.
Normalement, les cellules S2 n'adhèrent pas bien au plastique ou en verre, et cela poserait un problème pour les expériences nécessitant l'examen microscopique des cellules traitées. Cependant, les cellules S2 peut être induite à aplatir abondamment par simple placage sur une surface revêtue de la lectine, la concanavaline A (ConA). Moins d'une heure de placage sur ConA, la plupart des cellules ont perdu leur aspect arrondi à la suite de la diffusion de nombreux articles sur la surface ConA (figure 1). Les cellules sont maintenant prêtes pour un traitement ultérieur (par exemple, par la fixation et immunocoloration) ou l'observation microscopique des cellules vivantes.
Les cellules S2 peut aussi être transfectées (en utilisant une variété de réactifs chimiques ou électroporation) soit transitoirement exprimer un gène exogène ou de façon stable intégrer le gène dans le génome (créant ainsi une lignée cellulaire qui maintient le gène exogène par des divisions répétées). Transfections peuvent servir à plusieurs fins, comme l'expression des protéines par fluorescence marqués que les structures de marque d'intérêt dans les cellules fixes ou en direct (figure 2), ou qui sont utilisées comme appât dans les expériences in vivo déroulant ou immunoprécipitation, etc
La méthode d'analyse dépend de la CUOrse, sur la question biologique abordés par l'expérience. Une méthode d'analyse commune de l'ARNi cellules traitées S2 est immunofluorescence de cellules fixes (figure 3). Par exemple, l'immunofluorescence est généralement utilisé avec l'échelle du génome écrans des banques de gènes chez la drosophile pour identifier rapidement des protéines avec des activités intéressantes in vivo. L'analyse peut être faite plus élaborés en même temps appauvrissant protéines cibles multiples dans les cellules S2 en vue d'examiner les interactions potentielles fonctionnelles entre les protéines cibles. Et l'analyse peut être étendue à des cellules vivantes, pour observer l'effet de l'ARNi sur les processus dynamiques. Encore une fois, les cellules S2 sont particulièrement bien adaptés pour ce type d'analyse car ils peuvent plaqué sur ConA enduit de fond de verre plats et visualisés pendant de nombreuses heures sur un microscope inversé, sans la nécessité d'une chambre environnementale.

Figure 1. Images par contraste de phase (grossissement de 20x) de cellules S2 après étalement sur une concanavaline A enduit de fond de verre plat. Les chiffres indiquent les minutes après le placage. Notez que les cellules deviennent phase sombre comme ils s'aplatissent sur la lamelle enduit. Cellule aplatissement est apparent de 15 min (flèches) et est essentiellement complète de 60 min. Panneau de droite: l'image agrandie de cellules attachées, leurs marges étendues et aplatis sont clairement visibles (flèche). La barre d'échelle (pour les quatre panneaux de gauche), 20 um.
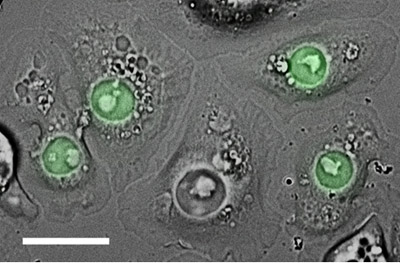
Figure 2 cellules. S2 transfectées transitoirement avec une construction de fusion composée de nucléophosmine (un marqueur pour le noyau) fusionné au fluorophore, EGFP (vert). Ces cellules ont été étalées sur un enduit de ConA à fond de verre plat, puis imagées avec DIC et à épifluorescence. La barre d'échelle, 15 um.
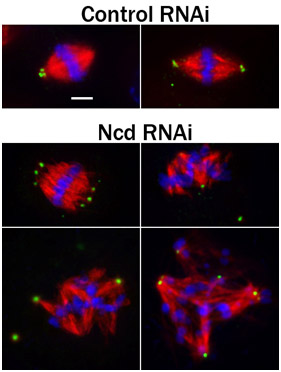
. Figure 3 fixe cellules S2 immunocolorées pour PLP (vert; un marqueur centriole), les microtubules (rouge), et Hoechst-colorées (bleu) pour les chromosomes. Avant de fixation et immunomarquage, les cellules ont été soumises à un traitement de 4 jours avec soit de contrôle ou d'ARNi ARNi pour le knock-down NCD, une protéine kinésine-like qui favorise pôle du fuseau «focalisation» 4. Notez le écartés pôles du fuseau et désorganisé broches dans les cellules traitées avec Ncd ARNi. La barre d'échelle, de 2,5 um.
Access restricted. Please log in or start a trial to view this content.
Discussion
Pour le domaine de la biologie cellulaire, un système idéal serait peu coûteux à entretenir, facile à manipuler, et se prêtent à une variété de techniques. Cellules S2 de drosophile satisfaire à ces exigences, et donc ils sont rapidement devenus le système de choix pour un nombre croissant de cellules les laboratoires de biologie.
Nous avons présenté un bref aperçu des méthodes pour préparer les cellules S2 pour la microscopie. Une vertu notable de cellules S2 est le...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Remerciements
Ce travail a été soutenu en partie par le National Cancer Institute P30 CA23074, la American Cancer Society Research Grant 74-001-31 institutionnels, et l'Univ. de l'Arizona IG SPORE (NCI / NIH CA9506O).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| S2 cells | ATCC | CRL-1963 | http://www.atcc.org/ |
| S2 cells | DGRC | stock number 6 | https://dgrc.cgb.indiana.edu/ |
| S2 cells | Invitrogen | R690-07 | |
| Sf900 II | Invitrogen | 10902-096 | serum-free medium |
| HyClone SFX-Insect | Thermo Fisher Scientific, Inc. | SH30278 | serum-free medium |
| Insect-Xpress | BioWhittaker | 12-730 | serum-free medium |
| Schneider’s S2 medium | Invitrogen | 11720-034 | Add 10% (final) heat-inactivated FBS to make complete medium. |
| Fetal bovine serum | Invitrogen | 10438026 | heat inactivated |
| 100x antibiotic solution | MP Biomedicals | 91674049 | contains penicillin (10000 U/mL), streptomycin (10000 μg/mL), and amphotericin B (25 μg/mL) |
| Concanavalin A | MP Biomedicals | 195283 | |
| Formaldehyde | Electron Microscopy Sciences | 15714 | 32% solution |
| Methanol | Mallinckrodt Baker Inc. | 9049 | anhydrous, ACS grade |
| Molecular sieves | Acros Organics | 19724 | type 3A |
Références
- Schneider, I. Cell lines derived from late embryonic stages of Drosophila melanogaster. J Embryol Exp Morphol. 27, 353-365 (1972).
- Rogers, S. L., Rogers, G. C. Culture of Drosophila S2 cells and their use for RNAi-mediated loss-of-function studies and immunofluorescence microscopy. Nat Protoc. 3, 606-611 (2008).
- Rogers, S. L., Rogers, G. C., Sharp, D. J., Vale, R. D. Drosophila EB1 is important for proper assembly, dynamics, and positioning of the mitotic spindle. J Cell Biol. 158, 873-884 (2002).
- Goshima, G. Genes required for mitotic spindle assembly in Drosophila S2 cells. Science. 316, 417-421 (2007).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon