Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación del tejido de cerebro de ratón para inmunomicroscopía
En este artículo
Resumen
Se describe un protocolo para la perfusión transcardiaca de los ratones, la eliminación y la sección del cerebro, así como la tinción con inmunoperoxidasa, la incrustación de resina, y ultrafinas de seccionamiento de las secciones del cerebro. Al término de estos procedimientos, el material immunostained está listo para el examen con microscopio electrónico de transmisión.
Resumen
Microscopía electrónica de transmisión (TEM) es extremadamente útil para la visualización de los compartimentos microglial, subcelular oligodendrocíticos, astrocitos y neuronas (las dendritas, la espina dendrítica, axón, axón terminal, pericarion), así como sus organelos intracelulares y el citoesqueleto, en el sistema nervioso central en alta resolución espacial. En combinación con TEM, pre-incrustación inmunocitoquímica permite la discriminación de los elementos celulares con algunos rasgos distintivos y los criterios de identificación (por ejemplo, la microglia perikarya y procesos, cuando se utiliza un anticuerpo contra el marcador de microglia específicos Iba1 (molécula ionizada de unión de calcio adaptador 1, tal como se presenta aquí)), la identificación de los contenidos de neurotransmisores de los elementos celulares (por ejemplo, serotoninérgicos) y su localización ultraestructural de las proteínas solubles o de membrana (por ejemplo, 5 HT1A y los receptores de EphA4). Aquí se describe un protocolo para la perfusión transcardiaca de ratones con acroleína fijador, la eliminación y la sección del cerebro, así como inmunoperoxidasa-tinción Diaminobencidina (DAB), la incrustación de resina, y ultrafinas de seccionamiento de las secciones del cerebro. Al término de estos procedimientos, el material immunostained está listo para el examen de TEM. Cuando se realiza con rigor, esta técnica proporciona un excelente compromiso entre la conservación óptima ultraestructurales y detección inmunohistoquímica.
Protocolo
1. Los animales fueron perfundidos
- El día antes de la perfusión, preparar:
- 2 L de tampón fosfato (PB; 100 mM, pH 7,4) y 1 l de sodio fosfato (PBS, 0,9% de NaCl en 50 mM PB, pH 7,4) con agua destilada. Guarde el PBS y 1 litro de PB a 4 ° C. Estos serán utilizados para la perfusión y la inmunocitoquímica pre-inclusión.
- 1 litro de 4,0% de paraformaldehído (PFA, pH 7,4), la solución de fijación, que permitirá a la perfusión de 6 ratones. A tal efecto, calentar 1 L de PB en una campana extractora. Pesar 40 g de paraformaldehído granular (PFA) y se vierte en la solución de PB cuando llega a 60 ° C. Cuando la solución es clara, con la PFA completamente disuelta, enfriar a temperatura ambiente (TA) y se almacenan a 4 ° C. - En el día de la perfusión, preparar 500 ml de solución de acroleína 3,5% en PB bajo una campana extractora. A continuación, filtrar el 3,5% y 4,0% acroleína soluciones PFA con papel de filtro.
- Para la anestesia del ratón, se inyectan pentobarbital sódico (80 mg / kg) en el peritoneo con una calibre 27 ½ "de la aguja.
- Durante la perfusión, 50 ml de PBS, 75 ml de acroleína, y 150 ml de PFA secuencialmente pasar a la circulación del ratón. Para configurar la bomba peristáltica, llenar el tubo con PBS y fijar un calibre 23 ¾ "aguja de mariposa en un extremo. Sumerja el otro extremo de la tubería en la solución de perfusión (PBS, acroleína o PFA). Ajuste la velocidad de la peristáltica bomba a 20-25 ml / min para los ratones jóvenes y adultos. A lo largo de la perfusión, con cuidado de evitar cualquier burbujas de aire que se forman en el tubo.
- Espere hasta que el ratón anestesiado ya no responde a los estímulos dolorosos, como una pizca de cola, antes de proceder. Coloque el animal en una bandeja de disección y fijar las patas con cinta adhesiva. Con pinzas y tijeras, abrir la piel y la cavidad torácica para exponer el corazón. Para minimizar la isquemia cerebral, la perfusión debe iniciarse rápidamente. Abrir la aurícula derecha con unas tijeras pequeñas y arrancar la bomba peristáltica. Mientras sostiene el corazón con unas pinzas, insertar la aguja de mariposa en el ápex del ventrículo izquierdo.
- Cuando se cambia la solución, detenga la bomba peristáltica, la transferencia de los tubos de una solución a otra, y reiniciar inmediatamente la bomba.
- Cuando 150 ml de PFA, pare la bomba peristáltica. Con la tijera pequeña, corte la cabeza, abrir la piel, y romper el cráneo entre los ojos. Con unas pinzas pequeñas, con cuidado de chips pequeños pedazos del cráneo hasta el cerebro se puede quitar fácilmente. Después de fijar el cerebro durante 2 horas a 4 ° C en PFA. Lavar 3 veces 10 minutos en PBS.
- Inmediatamente corte transversal en el cerebro (50 secciones micras de espesor) en PBS enfriado con hielo usando un vibratome. Con un pincel fino, la transferencia de las secciones seleccionadas para inmunocitoquímica en un frasco de vidrio que contiene PBS. Guarde el resto de las secciones a -20 ° C en el crioprotector (30% glicol de etileno y 30% de glicerol en PBS) durante un máximo de varios años.
2. Pre-incrustación inmunocitoquímica
- Por inmunocitoquímica, se elaboran secciones de flotación libre en frascos de vidrio. A lo largo del procedimiento, hay que evitar con cuidado dejando que las secciones se sequen.
- En primer lugar, eliminar el PBS utilizando una pipeta de transferencia y de inmediato sustituirlo por una nueva solución de borohidruro de sodio al 0,1% en PBS durante 30 minutos a temperatura ambiente.
- Aclarar las secciones con PBS 3 veces 10 minutos, eliminando todas las burbujas, y se incuba durante 2 horas a temperatura ambiente en una solución de bloqueo de PBS que contenía 0,5% de gelatina y 5% de suero normal de los animales en los que el anticuerpo secundario se ha generado (suero normal de cabra en el ejemplo actual de Iba1-tinción).
- Incubar durante 48 horas con el anticuerpo primario en solución de bloqueo. Para Iba1-inmunoticción, el uso de conejo anti-Iba1 anticuerpos (1:1000).
- Aclarar las secciones con PBS 3 veces 10 minutos y se incuban en anticuerpo secundario conjugado con biotina (1:1000) en solución de bloqueo durante 2 horas a temperatura ambiente.
Para Iba1-inmunoticción, el uso de cabra anti-conejo IgG. - Aclarar las secciones con PBS 3 veces 10 minutos y se incuban en estreptavidina-peroxidasa (1:1000) en solución de bloqueo durante 1 hora a temperatura ambiente.
- Aclarar las secciones con PBS de 10 minutos y con Tris / HCl-buffer salino (TBS, 50 mM, pH 7,4), 2 veces 10 minutos. Para revelar el etiquetado, se incuban las secciones con un 0,05% y 0,01% DAB peróxido de hidrógeno en TBS (solución recién preparada). Cuando la mancha es de color marrón oscuro (ver ejemplo en Figura 1), detener la reacción mediante lavado en TBS. En cualquier caso, poner fin a la reacción después de un máximo de 5 minutos. Aclarar las secciones con TBS 10 minutos y con PB 2 veces 10 minutos.
3. Procesamiento para microscopía electrónica
- Transferencia de las secciones en el PP en una placa de cultivo multipocillo con un pincel fino. Prepare una solución de tetróxido de osmio% en PB bajo una campana echando humo. Quitar PB de los pozos de la placa de cultivo y difundir las secciones planas con un pincel fino. Secciones inmediatamente sumergirse en el 1% de osmio durante 30 minutos a temperatura ambiente.
- Transferencia de las secciones en viales de vidrio, enjuague con PB 3 veces 10 minutos, y se deshidratan a través de dos inmersiones minutos en subir las concentraciones de etanol: 2 veces el 35%, una vez cada uno de 50%, 70%, 80%, 90% y el 95 %, 3 veces al 100%, seguido por tres veces de óxido de propileno.
- Para preparar la resina Durcupan, se combinan 20 g del componente A, 20 g de componente B, 0,6 g de componente C, y 0,4 g de componente D en un vaso desechable, mezclar bien hasta que el color se vuelve uniforme, y se vierte en una lata de aluminio pesan plato. Si es necesario, los bloques de resina se puede preparar mediante el vertido de resina en los moldes y la incrustación de curado en un horno a 55 ° C durante 48-72 horas.
- El uso de un pincel fino enjuagarse con óxido de propileno, eliminar las secciones del óxido de propileno y sumergirse en la resina de impregnación Durcupan durante la noche a temperatura ambiente.
- Al día siguiente, poner el aluminio pesar la cápsula en un horno a 55 ° C durante 10 minutos para ablandar la resina. El uso de un cepillo de enjuagarse con óxido de propileno, una película de capa de incrustación ACLAR con una fina capa de resina, establecer las secciones, cubrir con otra película de inserción, y distribuir uniformemente el peso ligero (alrededor de 2 g, por ejemplo las tapas de plástico de los viales de vidrio) en la parte superior para ayudar a la difusión de resina. De polimerización de la resina, se incuban en el horno durante 48-72 horas (a 55 ° C).
- Después de la polimerización, quite los pesos ligeros y el cine incrustar en la parte superior de las secciones. Bajo un microscopio binocular, seleccionar las áreas de interés cuadrados (aproximadamente 2x2 mm) y con cuidado especial de la película con una cuchilla de afeitar.
- Pegue las áreas de interés en la punta de bloques de resina con un pegamento y la curación en el 55 ° C horno durante 1 hora.
- En preparación para el corte, recorte el bloque de resina a la forma de un trapecio isósceles con una cuchilla de afeitar.
- El uso de un ultramicrótomo y un cuchillo de vidrio, quitar el pegamento y la resina en la superficie del tejido. Llenar el bote de la cuchilla de vidrio con agua destilada y cortar algunos semi-secciones delgadas (0,5 a 1 m de espesor).
- Transferencia de las secciones a una diapositiva SuperFrost con un bucle perfecto. Seca las secciones mediante la colocación de la diapositiva en una placa de calentamiento a 80 º C durante 1 minuto. Cubrir con unas gotas de 0,1% la mancha azul de toluidina (2 g de borato de sodio y 0,2 g de azul de toluidina en 200 ml de agua bidestilada) durante 1 minuto. Enjuague el exceso de colorante con agua destilada. El examen de las secciones con un microscopio de luz permitirá distinguir los tejidos teñidos de la resina (Figura 2).
- Reanudar el corte hasta la frontera entre el tejido y la resina llega a la mitad de las secciones. Tenga en cuenta que el siguiente procedimiento requiere de un entrenamiento. Vuelva a colocar el cuchillo de vidrio con un cuchillo de diamante y llenar el bote con agua destilada. Tazón de plata de cortes ultrafinos de oro y plata (60-80 nm de espesor) y con cuidado se acumulan en las redes de malla de cobre con unas pinzas finas invertido. Seca las redes en un papel filtro.
- Para mejorar el contraste, las secciones ultrafinas pueden ser teñidas con citrato de plomo (0,03 g citrato de plomo y 0,1 ml de hidróxido de sodio 10 N en 10 ml de agua destilada doble 1). Utilizando unas pinzas finas invertida, la transferencia de una red a una caída del citrato de plomo durante 2 minutos. Retire la rejilla y delicadamente enjuague con tres baños sucesivos de agua destilada. Por último, secar las redes en un papel de filtro y almacenarlas en una celda de la malla hasta que el examen de microscopía electrónica (Figuras 3-6).
4. Resultados representante
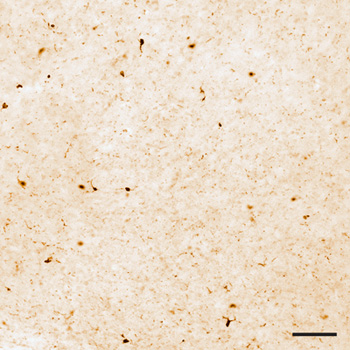
Figura 1. Iba1 manchado de la sección a nivel microscópico de luz. La distribución de celulares Iba1 se limita a la microglía, lo que demuestra la especificidad de la tinción. Barra de escala = 100 micras.
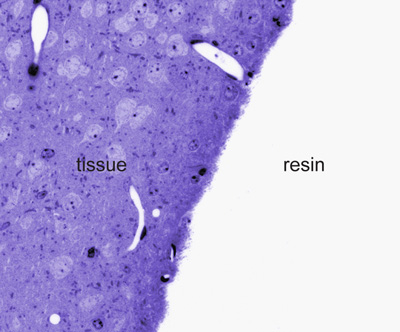
Figura 2. Toluidina azul manchado de semi-sección delgada a nivel microscópico de luz. Nota de la frontera entre el tejido y la resina en la inmunomarcación se parecen más intensos en el microscopio electrónico.
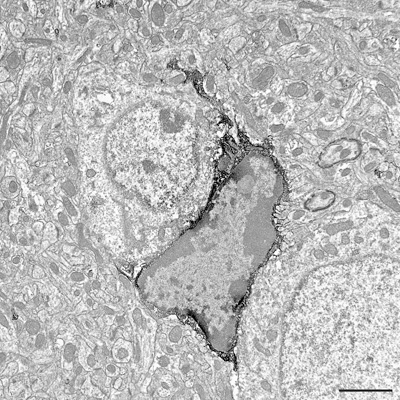
Figura 3. Ultrafinos sección que muestra Iba1-inmunopositivas pericarion la microglia y los procesos a nivel de microscopía electrónica. Elementos estructurales Iba1 positivos se reconocen por su inmunoperoxidasa-DAB electrón-densos precipitado. Barra de escala = 2 micras.

Figura 4. Ultrafinos sección mostrando Iba1-inmunopositivas procesos microgliales de diferentes tamaños y formas a nivel de microscopía electrónica. Barra de escala = 2 micras.
e 5 "/>
Figura 5. Sección ultrafina que muestra a mayor aumento de un proceso microglial Iba1 positivo en la Figura 4, que permita la identificación de los organelos intracelulares. Barra de escala = 1 micra.
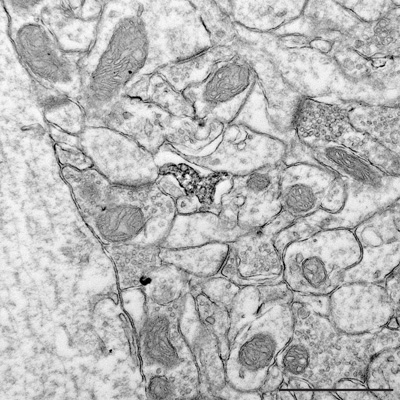
Figura 6. Ultrafinos sección revelar a mayor aumento de las relaciones ultraestructurales entre un proceso de microglial Iba1 positivos y elementos cercanos de neuropilo como sinapsis. Barra de escala = 1μm.
Discusión
Aquí hemos descrito un protocolo de preparación de tejido ratón cerebro para microscopía immunoelectron que proporciona un excelente compromiso entre conservación óptima ultraestructurales y detección inmunocitoquímicas, cuando los procedimientos son rigurosamente realizado.
Combinado con TEM, este método permite distinguir elementos celulares con pocos características distintivas y criterios identificación. En particular, el tinción inmunoperoxidasa-DAB de Iba1 permite identific...
Divulgaciones
Agradecimientos
Damos las gracias a Shao-Ming Lu y A. Harris Gelbard para el uso de una bomba peristáltica y vibratome, así como Karen L. Bentley y Schneider Gayle en el Fondo para el núcleo Microscopio Electrónico de Investigación de la Universidad de Rochester Medical Center para la asistencia técnica. Este trabajo fue financiado por subvenciones del NIH (EY019277), la Fundación de Whitehall, Burroughs Wellcome Fund, y la Fundación Alfred P. Sloan de AKM. M.-È.T. es financiado por una Fonds de la recherche en santé du Québec (FRSQ) Premio formación postdoctoral.
Materiales
* Siempre se debe trabajar bajo una campana de humos y usar guantes de nitrilo al manipular la acroleína, paraformaldehído, y el osmio y también debe disponer de sus residuos adecuadamente.
Referencias
- Venable, J. H., Coggeshall, R. A simplified lead citrate stain for use in electron microscopy. J Cell Biol. 25, 407-407 (1965).
- Riad, M. Somatodendritic localization of 5-HT1A and preterminal axonal localization of 5-HT1B serotonin receptors in adult rat brain. J Comp Neurol. 417 (2), 181-181 (2000).
- Tremblay, M. E. Localization of EphA4 in axon terminals and dendritic spines of adult rat hippocampus. J Comp Neurol. 501 (5), 691-691 (2007).
- Tremblay, M. E. Developmental course of EphA4 cellular and subcellular localization in the postnatal rat hippocampus. J Comp Neurol. 512 (6), 798-798 (2009).
- Bouvier, D. Pre-synaptic and post-synaptic localization of EphA4 and EphB2 in adult mouse forebrain. J Neurochem. 106 (2), 682-682 (2008).
- Bouvier, D. EphA4 is localized in clathrin-coated and synaptic vesicles in adult mouse brain. J Neurochem. , (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados