Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation du tissu cérébral de souris pour microscopie électronique
Dans cet article
Résumé
Nous décrivons un protocole pour perfusion transcardiaque de souris, l'enlèvement et la coupe du cerveau, ainsi que la coloration immunoperoxydase, résine d'enrobage, et ultraminces de sectionnement des sections du cerveau. A l'issue de ces procédures, le matériel est prêt pour immunocolorés examen par microscopie électronique à transmission.
Résumé
Microscopie électronique à transmission (MET) est extrêmement utile pour la visualisation de la microglie, oligodendrogliome, astrocytaire, et neuronale compartiments subcellulaires (dendrites, épines dendritiques, axone, axone terminal, péricaryon), ainsi que leurs organites intracellulaires et du cytosquelette, dans le système nerveux central à haute résolution spatiale. Combiné avec la TEM, pré-enrobage immunocytochimie permet la discrimination des éléments cellulaires avec peu de traits distinctifs et les critères d'identification (par exemple, microgliales péricaryon et des processus, en utilisant un anticorps dirigé contre le marqueur spécifique à la microglie Iba1 (ionisé molécule adaptatrice une fixation du calcium; tel que présenté ici)), en identifiant le contenu neurotransmetteur des éléments cellulaires (par exemple, sérotoninergiques) et leur localisation ultrastructurale des protéines solubles ou membranaires (par exemple, 5 HT1A et EphA4 récepteurs). Ici, nous décrivons un protocole pour perfusion transcardiaque de souris avec l'acroléine fixateur, l'enlèvement et le sectionnement du cerveau, ainsi que l'immunoperoxydase-diaminobenzidine (DAB) coloration, résine d'enrobage, et ultraminces de sectionnement des sections du cerveau. A l'issue de ces procédures, le matériel est prêt immunocolorés pour examen avec le TEM. Lorsque rigoureusement exécutée, cette technique fournit un excellent compromis entre la préservation ultrastructurale et la détection optimales immunocytochimiques.
Protocole
1. Perfusion des animaux
- Le jour avant la perfusion, préparer:
- 2 L de tampon phosphate (PB; 100 mM, pH 7,4) et 1 L de sodium tampon phosphate salin (PBS, 0,9% de NaCl dans 50 mM de PB, pH 7,4) dans de l'eau bidistillée. Stocker le PBS et 1L de PB à 4 ° C. Ils seront utilisés pour la perfusion et de pré-enrobage immunocytochimie.
- 1L de 4,0% paraformaldéhyde (PFA, pH 7,4) la solution de fixation, ce qui permettra à la perfusion de 6 souris. À cette fin, la chaleur jusqu'à 1 L de PB sous une hotte. Peser 40 g de paraformaldéhyde granulaire (PFA) et verser dans la solution PB quand elle atteint 60 ° C. Quand la solution est claire, avec l'IFP complètement dissous, refroidir à température ambiante (RT) et stocker à 4 ° C. - Le jour de la perfusion, préparer 500 ml de solution d'acroléine de 3,5% en PB sous une hotte. Ensuite, filtrer les 3,5% d'acroléine et de 4,0% en utilisant des solutions PFA papier filtre.
- Pour l'anesthésie de la souris, injecter du pentobarbital sodique (80 mg / kg) dans le péritoine avec une jauge de 27 ½ "aiguille.
- Pendant la perfusion, 50 ml de PBS, 75 ml d'acroléine, et 150 ml de PFA seront séquentielle passent dans la circulation de la souris. Pour configurer la pompe péristaltique, remplir le tube avec du PBS et de fixer une jauge 23 ¾ "aiguille à ailettes à une extrémité. Plongez l'autre extrémité du tube dans la solution de perfusion (PBS, l'acroléine ou PFA). Régler la vitesse de la péristaltique Pompe à 20-25 ml / min pour les souris adultes et juvéniles. Tout au long de la perfusion, soigneusement éviter toute formation de bulles d'air dans le tube.
- Attendez jusqu'à ce que la souris anesthésiée ne répond plus aux stimuli douloureux, comme un pincement de la queue, avant de procéder. Lay de l'animal dans un bac de dissection et de fixer les pattes avec du ruban. Avec une pince à épiler, ciseaux, ouvrir la peau et la cavité thoracique afin d'exposer le cœur. Afin de minimiser l'ischémie cérébrale, la perfusion doit être lancé rapidement. Couper l'oreillette droite avec de petits ciseaux et de démarrer la pompe péristaltique. Tout en maintenant le cœur avec des pincettes, insérer l'aiguille papillon dans la pointe du ventricule gauche.
- Lors du changement de solution, arrêter la pompe péristaltique, le transfert du tube d'une solution à l'autre, et de redémarrer la pompe immédiatement.
- Lorsque 150 ml de PFA est passé, arrêter la pompe péristaltique. L'utilisation de petits ciseaux, couper la tête, ouvrez la peau, et de briser le crâne entre les yeux. Utiliser des petites pinces, soigneusement puce petits morceaux de crâne jusqu'à ce que le cerveau peut être facilement enlevés. Post-fix du cerveau pendant 2 heures à 4 ° C en PFA. Lavez 3 fois 10 minutes dans du PBS.
- La coupure immédiate du cerveau dans transversale (50 sections um d'épaisseur) dans la glace refroidi par PBS en utilisant un vibratome. Avec un pinceau fin, le transfert des sections choisies pour immunocytochimie dans un flacon en verre contenant du PBS. Stocker les sections restantes à -20 ° C dans un cryoprotecteur (30% d'éthylène glycol et du glycérol 30% dans PBS) pendant jusqu'à plusieurs années.
2. Pré-enrobage immunocytochimie
- Pour l'immunocytochimie, les sections sont traitées flottant librement dans des flacons en verre. Tout au long de la procédure, on doit soigneusement éviter de laisser sécher les sections.
- Tout d'abord, retirer le CPE à l'aide d'une pipette de transfert et de remplacer immédiatement avec une solution fraîche de borohydrure de sodium à 0,1% dans PBS pendant 30 minutes à température ambiante.
- Rincer avec du PBS sections 3 fois 10 minutes, enlever toutes les bulles, et incuber pendant 2 heures à température ambiante dans une solution de blocage de PBS contenant 0,5% de gélatine et de 5% de sérum normal de l'animal dans lequel l'anticorps secondaire a été généré (sérum de chèvre normal dans le présent exemple de Iba1-immunomarquage).
- Incuber pendant 48 heures avec l'anticorps primaire dans une solution de blocage. Pour Iba1-immunomarquage, l'utilisation de lapin anti-Iba1 d'anticorps (1:1000).
- Rincer avec du PBS sections 3 fois 10 minutes et incuber en anticorps secondaire conjugué à la biotine (1:1000) dans une solution de blocage pendant 2 heures à température ambiante.
Pour Iba1-immunomarquage, l'utilisation de chèvre anti-IgG de lapin. - Rincer avec du PBS sections 3 fois 10 minutes et incuber dans streptavidine-peroxydase de raifort (1:1000) dans une solution de blocage pendant 1 heure à température ambiante.
- Rincer avec du PBS sections 10 minutes et avec du Tris / HCl solution saline tamponnée (SCT; 50 mM, pH 7,4) 2 fois 10 minutes. Pour révéler l'étiquetage, incuber sections avec DAB 0,05% et 0,01% de peroxyde d'hydrogène dans du TBS (solution fraîchement préparée). Lorsque la coloration est brun foncé (voir exemple en figure 1), arrêter la réaction en rinçant au SCT. En tout cas, la fin de la réaction après un maximum de 5 minutes. Rincer les sections avec le SCT 10 minutes et avec PB 2 fois 10 minutes.
3. Traitement pour la microscopie électronique
- Transfert sections en PB dans une plaque de culture multipuits en utilisant un pinceau fin. Préparer une solution de tétroxyde d'osmium% de PB sous une hotte fumant. Retirer PB provenant des puits de la plaque de culture et répandre les sections planes avec un pinceau fin. Immédiatement sections plonger dans osmium à 1% pendant 30 minutes à température ambiante.
- Transfert des sections dans des flacons en verre, rincez avec PB 3 fois 10 minutes, et déshydrater grâce à des immersions dans les deux minutes ascendante concentrations d'éthanol: 2 fois 35%, une fois chacun de 50%, 70%, 80%, 90%, et 95 %, 3 fois à 100%, suivie par l'oxyde de propylène 3 fois.
- Pour préparer la résine Durcupan, mélanger 20 g de composant A, 20 g de composant B, 0,6 g de composant C, et 0,4 g du composant D dans un bécher jetable, bien mélanger jusqu'à ce que la couleur devient uniforme, et versez-le dans une boîte en aluminium pèsent plat. Si nécessaire, des blocs de résine peuvent être préparés par coulage de résine dans les moules et les intégrer dans un four de séchage à 55 ° C pendant 48-72 heures.
- Utiliser une brosse fine rincés à l'oxyde de propylène, enlever les sections de l'oxyde de propylène et plonger dans la résine d'imprégnation Durcupan nuit à TA.
- Le lendemain, mettre de l'aluminium pèsent plat dans un four à 55 ° C pendant 10 minutes pour ramollir la résine. Avec un pinceau rincés à l'oxyde de propylène, le manteau d'un film intégrant ACLAR avec une fine couche de résine, de fixer les sections, couvrir avec un autre film d'enrobage, et à répartir uniformément les poids légers (environ 2 g, par exemple les bouchons en plastique des flacons en verre) sur le dessus pour aider à répandre la résine. Pour la polymérisation de résine, incuber dans le four pendant 48-72 heures (à 55 ° C).
- Après polymérisation, enlever les poids légers et le film intégrant sur le dessus des sections. Sous un microscope binoculaire, sélectionner des zones d'intérêt carrés (environ 2x2 mm) et soigneusement les exciser du film en utilisant une lame de rasoir.
- Collez les domaines d'intérêt, à la pointe de blocs de résine à l'aide Superglue et guérir dans le four à 55 ° C pendant 1 heure.
- En préparation pour la coupe, coupez le bloc de résine à la forme d'un trapèze isocèle avec une lame de rasoir.
- Utiliser un ultramicrotome et un couteau de verre, enlever la colle et la résine à la surface du tissu. Remplissez le bateau du couteau en verre avec de l'eau bidistillée et couper quelques coupes semi-fines (0,5-1 um d'épaisseur).
- Transfert des sections à une diapositive SuperFrost avec une boucle parfaite. Sécher les sections en plaçant la lame sur une plaque chauffante à 80 ° C pendant 1 minute. Couvrir avec quelques gouttes de bleu de toluidine 0,1% tache (2 g de borate de sodium et 0,2 g de bleu de toluidine dans 200 ml d'eau bidistillée) pendant 1 minute. Rincez la tache avec de l'excès d'eau bidistillée. L'examen des parties avec un microscope optique permettra de distinguer les tissus colorés de la résine (figure 2).
- Reprendre la coupe jusqu'à la frontière entre le tissu et la résine atteint le milieu des sections. Notez que la procédure suivante nécessite une formation. Remplacer le couteau en verre avec un couteau de diamant et de remplir le bateau à l'eau bidistillée. Couper l'argent à des coupes ultrafines argent-or (60-80 nm d'épaisseur) et soigneusement les recueillir sur les grilles de mailles fines cuivre en utilisant une pince à épiler inversé. Sécher les grilles sur un papier filtre.
- Pour améliorer le contraste, coupes ultrafines peuvent être colorées avec du citrate de plomb (0,03 g citrate de plomb et 0,1 ml d'hydroxyde de sodium 10N dans 10 ml d'eau bidistillée 1). En utilisant une pince à épiler fines inversé, le transfert d'une grille à une baisse de citrate de plomb pendant 2 minutes. Retirez délicatement la grille et rincer à trois bains successifs d'eau bidistillée. Enfin, sécher les grilles sur un papier filtre et rangez-les dans une boîte de grille jusqu'à examen au microscope électronique (Figures 3-6).
4. Les résultats représentatifs
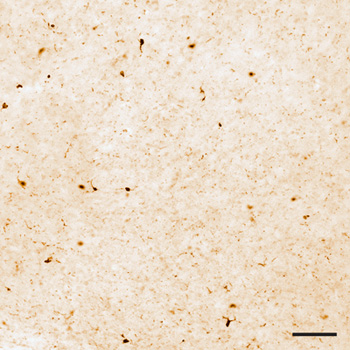
Figure 1. Iba1 teinté section au niveau de lumière microscopiques. La distribution cellulaire des Iba1 est limitée à la microglie, qui montre la spécificité de l'immunomarquage. Barre d'échelle = 100 pm.
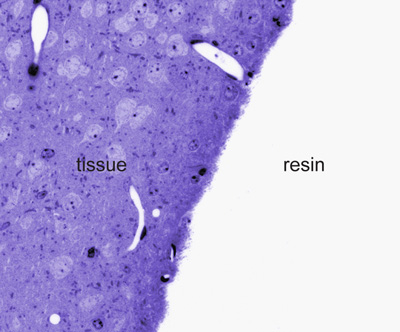
Figure 2. Toluidine colorées en bleu semi-fines section au niveau de lumière microscopiques. Notez la frontière entre le tissu et résine où l'immunomarquage apparaîtra plus intense au microscope électronique.
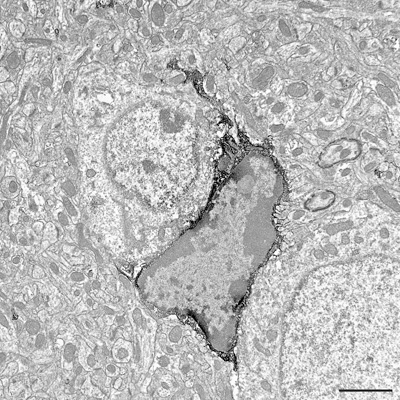
Figure 3. Section ultrafine montrant Iba1-immunopositives péricaryon microgliales et les processus au niveau microscope électronique. Iba1 positifs des éléments de structure sont reconnus par leurs immunoperoxydase-DAB denses aux électrons précipité. Barre d'échelle = 2 um.

Figure 4. Ultrathin la section affichant Iba1-immunopositives processus microgliales de tailles et de formes différentes au niveau microscope électronique. Barre d'échelle = 2 um.
e 5 "/>
Figure 5. Ultraminces montrant la section au plus fort grossissement d'un processus positif Iba1 microgliales de la figure 4, permettant l'identification de ses organites intracellulaires. Barre d'échelle = 1 um.
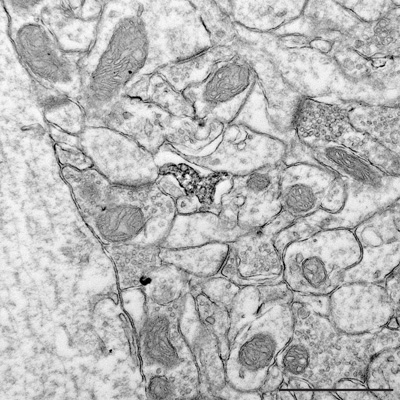
Figure 6. Section ultrafine révélant au plus fort grossissement les relations entre un processus ultrastructurale Iba1 positif microgliales et des éléments proches du neuropile dont les synapses. Barre d'échelle = 1 um.
Discussion
Ici, nous avons décrit un protocole de préparation de tissu cérébral de souris pour immunoélectromicroscopie qui offre un excellent compromis entre la préservation ultrastructurale et la détection optimales immunocytochimiques, lorsque les procédures sont rigoureusement exécutée.
Combiné avec la TEM, cette méthode permet de distinguer les éléments cellulaires avec peu de traits distinctifs et les critères d'identification. En particulier, la coloration immunoperoxydase-DAB...
Déclarations de divulgation
Remerciements
Nous remercions Shao-Ming Lu et Harris A. Gelbard pour l'utilisation d'une pompe péristaltique et vibratome, ainsi que Karen L. Bentley et Gayle Schneider au Core Facility microscope électronique à la recherche de l'Université de Rochester Medical Center de l'assistance technique. Ce travail a été financé par des subventions du NIH (EY019277), Whitehall Fondation Burroughs Wellcome Fund et la Fondation Alfred P. Sloan pour AKM. M.-È.T. est financé par un Fonds de recherche en santé du Québec (FRSQ) de bourses de formation postdoctorale.
matériels
* On doit toujours travailler sous une hotte et porter des gants en nitrile lorsque vous manipulez l'acroléine, le paraformaldéhyde, et l'osmium et devrait également disposer de leurs déchets de façon appropriée.
Références
- Venable, J. H., Coggeshall, R. A simplified lead citrate stain for use in electron microscopy. J Cell Biol. 25, 407-407 (1965).
- Riad, M. Somatodendritic localization of 5-HT1A and preterminal axonal localization of 5-HT1B serotonin receptors in adult rat brain. J Comp Neurol. 417 (2), 181-181 (2000).
- Tremblay, M. E. Localization of EphA4 in axon terminals and dendritic spines of adult rat hippocampus. J Comp Neurol. 501 (5), 691-691 (2007).
- Tremblay, M. E. Developmental course of EphA4 cellular and subcellular localization in the postnatal rat hippocampus. J Comp Neurol. 512 (6), 798-798 (2009).
- Bouvier, D. Pre-synaptic and post-synaptic localization of EphA4 and EphB2 in adult mouse forebrain. J Neurochem. 106 (2), 682-682 (2008).
- Bouvier, D. EphA4 is localized in clathrin-coated and synaptic vesicles in adult mouse brain. J Neurochem. , (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon