È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione del tessuto cerebrale del mouse per la microscopia Immunoelectron
In questo articolo
Riepilogo
Abbiamo descritto un protocollo per la perfusione transcardiac di topi, rimozione e sezionamento del cervello, così come colorazione immunoperossidasi, incorporando resina, ultrasottili e sezionamento delle sezioni cervello. Al termine di queste procedure, il materiale immunostained è pronto per l'esame con microscopia elettronica a trasmissione.
Abstract
Microscopia elettronica a trasmissione (TEM) è estremamente utile per la visualizzazione della microglia, scomparti oligodendrocytic, astrociti, neuroni e subcellulare (dendrite, spine dendritiche, assone, assone terminale, pericarion), così come i loro organelli intracellulari e citoscheletro, nel sistema nervoso centrale a ad alta risoluzione spaziale. In combinazione con TEM, pre-embedding immunocitochimica consente la discriminazione di elementi cellulari con pochi tratti distintivi e dei criteri di identificazione (ad esempio microglia perikarya e processi, quando si utilizza un anticorpo contro la microglia specifico marcatore Iba1 (ionizzato molecola adattatrice calcio vincolante 1; presentato qui)), che indicano il contenuto neurotrasmettitore degli elementi cellulari (ad esempio, serotoninergici) e la loro localizzazione ultrastrutturale di proteine solubili o di membrana (ad esempio, 5 HT1A e EphA4 recettori). Qui, descriviamo un protocollo per la perfusione transcardiac di topi con acroleina fissativo, rimozione e sezionamento del cervello, così come immunoperossidasi-diaminobenzidina (DAB) colorazione, l'incorporamento resina, ultrasottili e sezionamento delle sezioni cervello. Al termine di queste procedure, il materiale immunostained è pronto per l'esame con TEM. Quando rigorosamente eseguito, questa tecnica offre un ottimo compromesso tra ottimale conservazione ultrastrutturali e rilevamento immunocitochimica.
Protocollo
1. Animal perfusione
- Il giorno prima di perfusione, preparare:
- 2 L di tampone fosfato (PB, 100 mM, pH 7,4) e 1 l di sodio PBS (PBS, 0.9% NaCl nel PB 50 mM, pH 7,4) in acqua bidistillata. Conservare il PBS e 1L di PB a 4 ° C. Questi saranno utilizzati per la perfusione e pre-embedding immunocitochimica.
- 1L del 4,0% paraformaldeide (PFA, pH 7,4) la soluzione fissativa, che consentirà la perfusione di 6 topi. A tal fine, riscaldare 1 litro di PB sotto una cappa aspirante. Pesare 40 g di granulare paraformaldeide (PFA) e versare la soluzione PB quando raggiunge i 60 ° C. Quando la soluzione è chiara, con la PFA completamente sciolto, raffreddare a temperatura ambiente (RT) e conservare a 4 ° C. - Il giorno della perfusione, preparare 500 ml di soluzione acroleina 3,5% in PB sotto una cappa aspirante. Poi, filtrare il 3,5% e 4,0% acroleina soluzioni PFA utilizzando carta da filtro.
- Per l'anestesia del mouse, iniettare sodio pentobarbital (80 mg / kg) nel peritoneo con un calibro 27 ½ "ago.
- Durante la perfusione, 50 ml di PBS, 75 ml di acroleina, e 150 mL di PFA in sequenza passare nella circolazione del mouse. Per impostare la pompa peristaltica, riempire il tubo con PBS e fissare un 23 gauge ¾ "ago a farfalla ad una estremità. Immergere l'altra estremità del tubo nella soluzione di perfusione (PBS, acroleina o PFA). Impostare la velocità del peristaltica Pompa a 20-25 ml / min per topi giovani e adulti. Durante la perfusione, accuratamente evitare qualsiasi formazione di bolle d'aria nelle tubazioni.
- Attendere fino a quando il mouse non risponde più anestetizzati agli stimoli dolorosi, come un pizzico di coda, prima di procedere. Giaceva l'animale in un vassoio dissezione e fissare le zampe con del nastro. Con le pinzette e forbici, aprire la pelle e la cavità toracica per esporre il cuore. Per ridurre al minimo l'ischemia cerebrale, la perfusione deve essere avviato rapidamente. Taglio aperto l'atrio destro con piccole forbici e avviare la pompa peristaltica. Tenendo il cuore con le pinzette, inserire l'ago a farfalla in all'apice del ventricolo sinistro.
- Quando si cambia la soluzione, fermare la pompa peristaltica, trasferire il tubo da una soluzione all'altra, e riavviare la pompa immediatamente.
- Quando 150 ml di PFA è passato, fermare la pompa peristaltica. Utilizzando piccole forbici, tagliare la testa, aprire la pelle, e rompere il cranio in mezzo agli occhi. Utilizzando una pinzetta piccola, con attenzione chip di fuori piccoli pezzi di cranio, fino a quando il cervello può essere facilmente rimosso. Post-fix il cervello per 2 ore a 4 ° C in PFA. Lavare 3 volte 10 minuti in PBS.
- Immediatamente tagliato il cervello in trasversale (50 sezioni micron di spessore) in ghiaccio raffreddato PBS usando una vibratome. Con un pennello fine, il trasferimento di sezioni selezionate per immunocitochimica in un flaconcino di vetro contenente PBS. Conservare le restanti sezioni a -20 ° C in crioprotettore (30% glicole etilenico e il 30% glicerolo in PBS) fino a diversi anni.
2. Pre-embedding immunocitochimica
- Per immunocitochimica, le sezioni sono trattati liberamente fluttuanti in flaconcini di vetro. Nel corso della procedura, si ha la necessità di evitare con cura lasciando sezioni asciugarsi.
- In primo luogo, rimuovere la PBS usando una pipetta trasferire e sostituire immediatamente con una soluzione fresca di boroidruro di sodio 0,1% in PBS per 30 minuti a temperatura ambiente.
- Sciacquare le sezioni con PBS 3 volte 10 minuti, eliminando tutte le bolle, e incubare per 2 ore a temperatura ambiente in una soluzione bloccante di PBS contenente 0,5% di gelatina e il 5% di siero normale dell'animale in cui l'anticorpo secondario è stata generata (siero di capra normale l'esempio attuale di Iba1-immunostaining).
- Incubare per 48 ore con l'anticorpo primario nel bloccare soluzione. Per Iba1-immunostaining, l'uso di coniglio anti-Iba1 anticorpi (1:1000).
- Sciacquare le sezioni con PBS 3 volte 10 minuti e incubare anticorpo secondario coniugato con biotina (1:1000) nel bloccare la soluzione per 2 ore a temperatura ambiente.
Per Iba1-immunostaining, l'uso di capra anti-IgG di coniglio. - Sciacquare le sezioni con PBS 3 volte 10 minuti e incubare streptavidina-perossidasi di rafano (1:1000) nel bloccare la soluzione per 1 ora a temperatura ambiente.
- Sciacquare le sezioni con PBS 10 minuti e con Tris / HCl soluzione salina tamponata (TBS, 50 mM, pH 7.4) 2 volte 10 minuti. Per rivelare l'etichettatura, incubare sezioni con 0,05% DAB e perossido di idrogeno 0,01% in TBS (soluzione appena preparata). Quando la colorazione è marrone scuro (vedi esempio in Figura 1), arrestare la reazione da lavaggio in TBS. In ogni caso, terminare la reazione dopo un massimo di 5 minuti. Sciacquare le sezioni con TBS 10 minuti e con PB 2 volte 10 minuti.
3. Elaborazione per la microscopia elettronica
- Trasferimento sezioni in PB in una piastra di coltura pozzetti con un pennello sottile. Preparare una soluzione 1% tetrossido di osmio in PB sotto un cappuccio fumante. Rimuovere PB dai pozzetti della piastra e la cultura diffondere i tratti pianeggianti, con un pennello fine. Sezioni immediatamente immersi in osmio 1% per 30 minuti a temperatura ambiente.
- Trasferire le sezioni in flaconi di vetro, sciacquare con PB 3 volte 10 minuti, e disidratare con 2 immersioni minuti di ascendente concentrazioni di etanolo: 2 volte 35%, 1 volta ogni 50%, 70%, 80%, 90%, e 95 %, 3 volte al 100%, seguita da 3 propilene ossido di volte.
- Per preparare la resina Durcupan, unire 20 g di componente A, 20 g di componente B, 0,6 g di componente C, e 0,4 g di componente D in un bicchiere usa e getta, mescolare bene fino a quando il colore diventa uniforme, e versare in alluminio pesano piatto. Se necessario, blocchi di resina può essere preparato versando embedding stampi in resina e curare in un forno ° 55 C per 48-72 ore.
- Utilizzando un pennello fine sciacquati con ossido di propilene, rimuovere le sezioni da ossido di propilene e immergere nella resina Durcupan per impregnazione durante la notte a temperatura ambiente.
- Il giorno seguente, mettere il piatto in alluminio pesano in un forno ° 55 C per 10 minuti per ammorbidire la resina. Con un pennello sciacquati con ossido di propilene, cappotto un film embedding ACLAR con un sottile strato di resina, stabiliscono le sezioni, coprire con un altro film embedding, e distribuire uniformemente pesi leggeri (circa 2 g, per esempio i tappi di plastica di flaconi di vetro) sulla parte superiore per aiutare la diffusione di resina. Per la polimerizzazione della resina, incubare in forno per 48-72 ore (a 55 ° C).
- Dopo la polimerizzazione, rimuovere i pesi leggeri e film incorporare sulla parte superiore delle sezioni. Sotto un microscopio binoculare, selezionare le aree di interesse quadrato (circa 2x2 millimetri) e attentamente accise del film utilizzando una lama di rasoio.
- Incollare i settori di interesse sulla punta dei blocchi di resina utilizzando supercolla e la cura nel forno ° 55 C per 1 ora.
- In preparazione di sezionamento, tagliare il blocco di resina a forma di trapezio isoscele con una lametta.
- Utilizzando un ultramicrotomo e un coltello di vetro, rimuovere la colla e resina sulla superficie del tessuto. Riempire la barca del coltello di vetro con acqua bidistillata e tagliare un paio di semi-sottili sezioni (0.5-1 micron di spessore).
- Trasferire le sezioni di una diapositiva SuperFrost con un ciclo perfetto. A secco le sezioni mettendo il vetrino su una piastra di riscaldamento a 80 ° C per 1 minuto. Coprire con qualche goccia di toluidina 0,1% macchia blu (2 g di borato di sodio e 0,2 g di blu di toluidina in 200 ml di acqua bidistillata) per 1 minuto. Sciacquare l'eccesso macchia con acqua bidistillata. L'esame delle sezioni con un microscopio ottico permetterà di distinguere il tessuto macchiato dalla resina (Figura 2).
- Riprendi il taglio fino al confine tra il tessuto e resina raggiunge la metà delle sezioni. Si noti che la seguente procedura richiede una formazione. Sostituire il coltello di vetro con un coltello di diamante e riempire la barca con acqua bidistillata. Taglio argento per argento-oro sezioni ultrasottili (60-80 nm di spessore) e con cura la raccolta sulle reti mesh di rame utilizzando bene le pinzette invertita. Asciugare le griglie in una carta da filtro.
- Per aumentare il contrasto, le sezioni ultrasottili possono essere colorate con citrato di piombo (0,03 g di citrato di piombo e 0,1 ml di idrossido di sodio 10N in 10 ml di acqua bidistillata 1). Usando bene le pinzette invertita, trasferire una griglia per una goccia di citrato di piombo per 2 minuti. Togliere la griglia e delicatamente lavare in 3 bagni successivi di acqua bidistillata. Infine, asciugare le reti su una carta da filtro e conservare in una scatola griglia fino a quando l'esame al microscopio elettronico (Figure 3-6).
4. Rappresentante Risultati
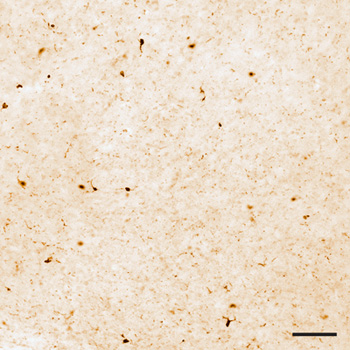
Figura 1. Iba1 macchiato di sezione a livello microscopico luce. La distribuzione cellulare di Iba1 è limitato a microglia, che mostra la specificità del immunocolorazione. Barra di scala = 100 micron.
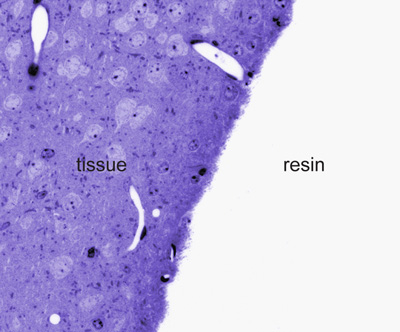
Figura 2. Toluidine azzurro macchiato di semi-sottile sezione a livello microscopico luce. Nota al confine tra il tessuto e resina dove l'immunocolorazione apparirà più intensi al microscopio elettronico.
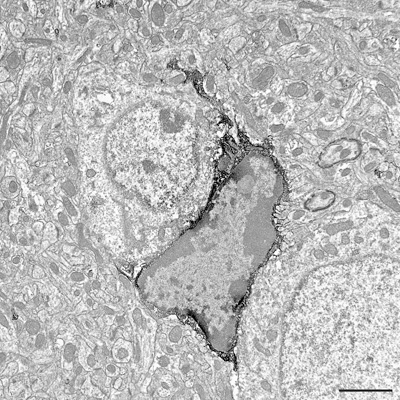
Figura 3. Ultrasottile sezione che mostra Iba1-immunopositive pericarion microglia e dei processi a livello al microscopio elettronico. Elementi strutturali Iba1-positivi sono riconosciuti dai loro immunoperossidasi-DAB elettrone-denso precipitato. Barra di scala = 2 micron.

Figura 4. Ultrasottile sezione di visualizzazione di processi microglia Iba1-immunopositive di diverse dimensioni e forme a livello al microscopio elettronico. Barra di scala = 2 micron.
e 5 "/>
Figura 5. Sezione ultrasottile mostrando a più alto ingrandimento uno Iba1-positivo processo di microglia dalla Figura 4, che consente l'identificazione dei suoi organelli intracellulari. Barra di scala = 1 micron.
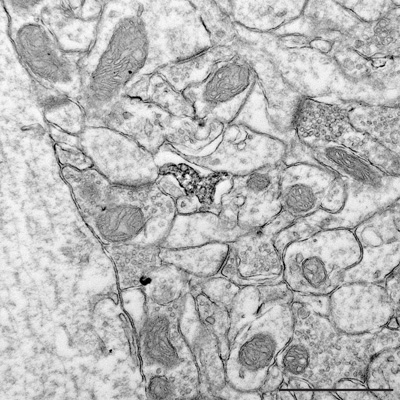
Figura 6. Ultrasottile sezione rivelando a maggiore ingrandimento le relazioni ultrastrutturali tra un Iba1-positivo processo di microglia e gli elementi vicini di neuropilo tra sinapsi. Barra di scala = 1μm.
Discussione
Qui abbiamo descritto un protocollo per la preparazione del tessuto cerebrale di topo microscopia immunoelectron che offre un ottimo compromesso tra ottimale conservazione ultrastrutturali e rilevamento immunocitochimica, quando le procedure sono rigorosamente eseguiti.
In combinazione con TEM, questo metodo consente di distinguere elementi cellulari con pochi tratti distintivi e dei criteri di identificazione. In particolare, il immunoperossidasi-DAB colorazione dei Iba1 consente di identif...
Divulgazioni
Riconoscimenti
Ringraziamo Shao-Ming Lu e Harris A. Gelbard per l'uso di una pompa peristaltica e vibratome, così come Karen L. Bentley e Gayle Schneider al Fondo Electron Microscope Nucleo di Ricerca dell'Università di Rochester Medical Center di assistenza tecnica. Questo lavoro è stato finanziato da finanziamenti del NIH (EY019277), Whitehall Fondazione, Burroughs Wellcome Fondo, e l'Alfred P. Sloan Foundation per AKM. M.-È.T. è finanziato da un Fonds de la Recherche en Santé du Québec (FRSQ) premio di formazione post-dottorato.
Materiali
* Si deve sempre lavorare sotto una cappa aspirante e indossare guanti di nitrile quando si maneggiano acroleina, paraformaldeide e osmio e deve anche smaltire i propri rifiuti in modo corretto.
Riferimenti
- Venable, J. H., Coggeshall, R. A simplified lead citrate stain for use in electron microscopy. J Cell Biol. 25, 407-407 (1965).
- Riad, M. Somatodendritic localization of 5-HT1A and preterminal axonal localization of 5-HT1B serotonin receptors in adult rat brain. J Comp Neurol. 417 (2), 181-181 (2000).
- Tremblay, M. E. Localization of EphA4 in axon terminals and dendritic spines of adult rat hippocampus. J Comp Neurol. 501 (5), 691-691 (2007).
- Tremblay, M. E. Developmental course of EphA4 cellular and subcellular localization in the postnatal rat hippocampus. J Comp Neurol. 512 (6), 798-798 (2009).
- Bouvier, D. Pre-synaptic and post-synaptic localization of EphA4 and EphB2 in adult mouse forebrain. J Neurochem. 106 (2), 682-682 (2008).
- Bouvier, D. EphA4 is localized in clathrin-coated and synaptic vesicles in adult mouse brain. J Neurochem. , (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon