Method Article
Imágenes in vivo de larvas de Drosophila intactos a nivel sub-celular Resolución
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un método fiable para la anestesia y la imagen intacta de Drosophila melanogaster Larvas. Hemos utilizado los anestésicos volátiles desflurano para permitir la formación de imágenes repetitivas a nivel sub-celular resolución y volver a la identificación de las estructuras de hasta unos pocos días 1.
Resumen
Las recientes mejoras en las imágenes ópticas, fluoróforos genéticamente codificados y herramientas genéticas que permite el establecimiento eficaz de las líneas deseadas de animales transgénicos han permitido que los procesos biológicos que se estudiará en el contexto de la vida, y en algunos casos incluso comportarse, organismo. En este protocolo se describirá cómo para anestesiar intactas las larvas de Drosophila, con el anestésico volátil desflurano, para seguir el desarrollo y la plasticidad sináptica de las poblaciones con una resolución de 1.3 subcelular. Mientras que otros métodos útiles para anestesiar a las larvas de Drosophila melanogaster han sido descritas previamente 4,5,6,7,8, el protocolo presentado en este documento demuestra mejoras significativas debido a las siguientes características clave combinado: (1) Un alto grado de anestesia, incluso el latido del corazón es detenido teniendo en cuenta la resolución lateral de hasta 150 nm 1, (2) una alta tasa de supervivencia de> 90% por ciclo de anestesia, que permitan la grabación de más de cinco puntos de tiempo durante un período de horas o días 2 y ( 3) una alta sensibilidad que nos permite en dos ocasiones para estudiar la dinámica de las proteínas expresadas en niveles fisiológicos. En concreto, hemos sido capaces de visualizar la subunidad del receptor glutamato postsinápticos GluR-IIA expresada a través del promotor endógeno 1 en líneas transgénicas estables y la línea de trampas exón FasII-GFP 1. (4) A diferencia de otros métodos de 4,7 a las larvas se pueden obtener imágenes no sólo vivos, sino también intacta (es decir, no disecados) que permite la observación que se produzca durante varios días 1. Los detalles del vídeo que acompaña a la función de las partes individuales de la cámara de imágenes in vivo 2,3, el correcto montaje de las larvas, el procedimiento de anestesia, cómo volver a definir las posiciones específicas dentro de la larva y la eliminación segura de las larvas de la imagen cámara.
Protocolo
A) Asamblea de la cámara de imágenes
- Seleccione una larva de la etapa elegida (por ejemplo, principios de 3 º estadio las larvas dejando un intervalo de la observación de unas 24 horas a 25 ° C hasta vagando etapa).
- Enjuague la larva con agua para limpiar el medio de cultivo y el lenguado que se seque.
- Cubrir el centro del elemento de fondo de la cámara, de la región para hacer frente a la larva, con una fina película de aceite de halocarbonos.
- Ponga la larva con la parte ventral hacia el objetivo del microscopio en la cámara (que permite la unión neuromuscular (UNM) 26 y 27 a ser reflejados) (Figura 1 AE).
- Coloque el separador de plástico en la capa de aceite, con las ranuras de ventilación de la parrilla hacia arriba la cara (Figura 1 A). Por favor, verifique en este paso: La altura del espaciador es aproximadamente la mitad del diámetro de las larvas, el ancho de la ranura debe ser aproximadamente el doble del diámetro de la larva.
- Coloque la cámara de imágenes en el microscopio
B) estetización de la larva
- Conecte las dos entradas de la cámara con una anestesia adecuada de dispositivos / vaporizador.
Por favor, verifique por adelantado:
La concentración efectiva de desflurano en el aire ambiente no debe exceder de lo especificado por las normas de seguridad! Sólo un volumen total muy pequeño de desflurano es necesaria para anestesiar a las larvas. La aplicación del 15% (v / v) de desflurano 1 ha demostrado ser un buen punto de partida para determinar la concentración ideal para ser utilizado en un experimento. Por razones de seguridad sugieren que el vaporizador no debe contener más de lo necesario desflurano durante 2-4 horas de imágenes in vivo. - Sumerja el otro extremo del tubo que va conectado a la salida de la cámara en un vaso de agua a continuación, abra las válvulas que controlan el flujo de la anestesia en la cámara durante unos cinco segundos.
Por favor, verifique en este paso:
Hacer las burbujas de aire ascienden en el agua? Si no es la cámara de fugas. - Cerrar las válvulas durante unos tres segundos.
- Vigilar los movimientos residual de larvas en el microscopio. Comprobar tanto los latidos del corazón y los movimientos musculares. Si es necesario abrir y cerrar válvulas como se describe en el paso 8 y 9 hasta anestesia de la larva se ha completado, a continuación, cierre todas las válvulas y empezar de imágenes.
Por favor, verifique en este paso:
El movimiento muscular residual o latidos del corazón indica que la larva no está bien anestesiado. Anestesia completa es vital para las imágenes de alta resolución. La larva no deberá ser anestesiado durante más de 15-20 minutos en un momento dado.
C) Imagen
- Identificar la posición correcta y la imagen de la estructura de interés (Figura 4.2).
D) La recuperación de la anestesia
- Después de la filmación se completó permitir que el aire en la cámara.
Por favor, verifique en este paso:
Comprobar las contracciones del músculo cardíaco y de la larva con luz halógena de transmisión. Como los músculos comienzan contratación es seguro para eliminar la larva de la cámara de imágenes. - Desconecte la cámara del dispositivo de anestesia y sacarlo de un microscopio. Desmonte la cámara con cuidado y coloque la larva en el medio de cultivo de puré de volar.
- Guarde el plato en una incubadora a la temperatura adecuada.
E) de series de tiempo
- Repita los pasos hasta que el 14.2 puntos suficientes de tiempo se han obtenido.
Alternativa protocolo:
Si la larva es formar una imagen más de una vez dentro de un intervalo de 30 minutos podría ser práctico para dejarlo en la cámara de imagen hasta el punto de anestesia la próxima vez. Repita los pasos hasta que el 14.7 puntos suficientes de tiempo se han obtenido.
Por favor, verifique en este paso:
La larva no se almacenará en la cámara de imágenes por más de dos horas a la vez, ni es para ser anestesiados por más de 15-20 minutos a la vez.

Figura 1 de la Asamblea de la cámara de imágenes. (A) Colocar la larva y el separador de plástico en la capa de aceite. (B) Colocar un 22 x 22 mm cubreobjetos en el separador y se inserta el anillo guía de plexiglas en la cámara, al lado de (C) fijar la posición de la larva con el anillo de metal y (D) cerca de la cámara. (E) Ahora la cámara está lista para ser montada en el microscopio.
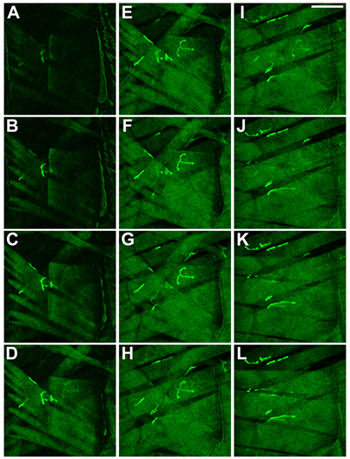
Figura 2 de la pared del cuerpo-los músculos de las larvas de Drosophila. Músculos y NMJs se visualizaron mediante la expresión de una proteína de fusión CD8-GFP-Sh 8. Los músculos se muestran tal como se observa cuando se enfoca en la parte ventral a través de la cutícula en la larva. En (AC) el músculo más superficial, de 27 años, se muestra en (KL) la mayoría de los músculos interiores, 6 y 7, se muestran. Barra de escala: 100 micras, ΔZ entre cortes es de 2 micras.

Figura 3 Identificación de los músculos de la pared del cuerpo en larvas de Drosophila. La identidad de los músculos en L3 larvas de Drosophila, A3 segmento, se muestra. Músculos y NMJs se visualizaron mediante la expresión de una proteína de fusión CD8-GFP-Sh 8. Los músculos se muestran tal como se observa cuando se enfoca en la parte ventral a través de la cutícula en las larvas. En AC el músculo más superficial, de 27 años, se muestra, en Kuala Lumpur los músculos más interior, 6 y 7, se muestran. Barra de escala: 100 m, ΔZ entre cortes es de 2 micras.
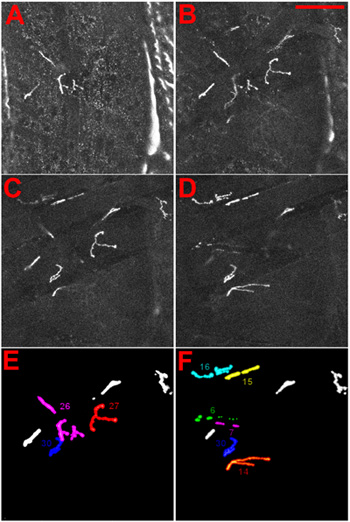
Figura 4 La identidad de la unión neuromuscular de larvas de Drosophila. (AD) NMJs se visualizaron mediante la expresión de una proteína de fusión mRFP DGluRIIA-1. El NMJs se muestran tal como se observa cuando se enfoca en la parte ventral a través de la cutícula en la larva. En (AB), el más superficial MNJ, de 27 años, se muestra, en el CD NMJs más interior, 6 y 7, se muestran. Barra de escala: 100 m, ΔZ entre cortes es de 5 micras. (E) y (F) la identidad de la superficial (E) y el interior más (F) NMJs se da como referencia.
Discusión
El método presentado fue desarrollado inicialmente para estudiar las sinapsis glutamatérgicas en los músculos de la pared del cuerpo de la Drosophila melanogaster larvas. La Drosophila unión neuromuscular (UNM) se caracteriza por un estereotipo de cito-arquitectura de los músculos y las neuronas y por lo tanto ideal para imágenes en vivo. Sin embargo, el protocolo de anestesia descrita no se limita a imágenes de la UNM, la transparencia de las larvas de Drosophila facilita la adaptación del protocolo descrito para estudiar el desarrollo de órganos, la migración de las células, transporte de carga axonal y la reorganización sub-celular en las células.
Divulgaciones
Agradecimientos
Damos las gracias a Andreas Schönle, Max-Plank-Institut de Química Biofísica, Alemania y David J. Sandstrom, Instituto Nacional de Salud Mental, los Institutos Nacionales de Salud, Bethesda, MD, EE.UU., para el asesoramiento técnico. Damos las gracias a Frank Kötting, Europea Instituto de Neurociencia de Göttingen para la construcción de la cámara de imágenes y el dispositivo de anestesia. Este trabajo fue apoyado por becas de la Iniciativa de Alzheimer Forschung a TMRYZ fue financiado por una beca del Consejo de Becas de China, SBH por una beca de la Escuela de Postgrado de Neurociencia Celular y Molecular de la Universidad de Tübingen.
Materiales
Reactivos:
- Desflurano (Suprane, Baxter, Unterschleißheim, Alemania)
- Halocarbonos de aceite (por ejemplo, aceite de Voltalef H10S / Atofina, Puteaux, Francia)
- Volar medio de cultivo
Equipos:
- Microscopio confocal invertido
- Microscopio binocular (por ejemplo Stemi 2000, Carl Zeiss, Jena, Alemania)
- Pequeño pincel que se utiliza para ordenar las moscas
- Incubadora
- Hecha a imagen de la cámara (para dibujos mecánicos ver Ref. 3.)
- Vaporizador / anestesia dispositivo (Para más detalles ver Ref. 3.)
Referencias
- Rasse, T. M. Glutamate receptor dynamics organizing synapse formation in vivo. Nat Neurosci. 8, 898-905 (2005).
- Rasse, T. M. . In vivo imaging of long-term changes in the Drosophila neuromuscular system [dissertation]. , (1988).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat Protoc. 2, 3285-3298 (2007).
- Wang, X., Schwarz, T. L. Imaging axonal transport of mitochondria. Methods in enzymology. 457, 319-333 (2009).
- Vinegoni, C. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. J Vis Exp. , (2009).
- Lin, C. Y. Label-free imaging of Drosophila larva by multiphoton autofluorescence and second harmonic generation microscopy. Journal of biomedical optics. 13, 050502-050502 (2008).
- Levitan, E. S., Lanni, F., Shakiryanova, D. In vivo imaging of vesicle motion and release at the Drosophila neuromuscular junction. Nat Protoc. 2, 1117-1125 (2007).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y. &. a. m. p. ;. a. m. p., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados