Method Article
In-vivo-Imaging von Intact Drosophila-Larven auf subzellulärer Auflösung
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine zuverlässige Methode zur Betäubung und Bildgebung von intakten Drosophila melanogaster Larven. Wir nutzten die volatilen Anästhetika Desfluran, um für sich wiederholende Bildgebung bei sub-zellulärer Auflösung und Re-Identifizierung von Strukturen für bis zu ein paar Tagen ermöglichen 1.
Zusammenfassung
Die jüngsten Verbesserungen in der optischen Bildgebung, genetisch kodierte Fluorophore und genetische Werkzeuge, die eine effiziente Einrichtung von gewünschten transgenen Tier Linien aktiviert haben biologischer Prozesse im Rahmen eines lebenden studiert werden, und in einigen Fällen sogar zu verhalten, Organismus. In diesem Protokoll werden wir beschreiben, wie intakt Drosophila-Larven, mit dem volatilen Anästhetika Desfluran, um die Entwicklung und Plastizität der synaptischen Populationen subzellulärer Auflösung 1-3 folgen zu betäuben. Während andere nützliche Methoden, um Drosophila melanogaster Larven betäuben wurden bisher 4,5,6,7,8 beschrieben, zeigt das Protokoll hier vorgestellte signifikante Verbesserungen aufgrund der folgenden kombiniert die wichtigsten Funktionen: (1) Ein sehr hohes Maß an Betäubung, auch die Herzschlag wird verhaftet Berücksichtigung lateralen Auflösung von bis zu 150 nm 1, (2) eine hohe Überlebensrate von> 90% pro Zyklus Betäubung, erlaubt die Aufnahme von mehr als fünf Zeitpunkten über einen Zeitraum von Stunden bis Tagen 2 und ( 3) eine hohe Empfindlichkeit ermöglicht uns in 2 Fällen zur Untersuchung der Dynamik von Proteinen in physiologischen Konzentrationen ausgedrückt. Im Einzelnen konnten wir die postsynaptische Glutamat-Rezeptor-Untereinheit GluR-IIA über den endogenen Promotor 1 in stabilen transgenen Linien und der Exon-trap line FasII-GFP 1 ausgedrückt zu visualisieren. (4) Im Gegensatz zu anderen Methoden 4,7 können die Larven nicht nur lebendig abgebildet werden, sondern auch intakte (dh nicht seziert) ermöglicht Beobachtung über mehrere Tage 1 auftreten. Das dazugehörige Video Details der Funktion der einzelnen Teile der in-vivo-Bildgebung Kammer 2,3, die korrekte Montage der Larven, die Betäubung Verfahren, wie re-identifizieren bestimmte Positionen innerhalb einer Larve und die sichere Entfernung der Larven aus der Bildgebung Kammer.
Protokoll
A) Montage der Bildgebung Kammer
- Wählen Sie eine Larve der gewählten Stufe (zB frühe 3 rd Larvenstadium verlassen eine Beobachtung im Abstand von ca. 24 Stunden bei 25 ° C bis wandernde Stufe).
- Spülen Sie die Larve mit Wasser, um es von dem Kulturmedium und tupfen sie trocken zu reinigen.
- Bestreichen Sie die Mitte der unteren Element der Kammer, die Region um die Larve Gesicht, mit einem dünnen Film von Halocarbonöl.
- Legen Sie die Larve mit der Bauchseite mit Blick auf den Mikroskop-Objektiv in der Kammer (ermöglicht neuromuskulären Synapse (NMJ) 26 und 27 werden abgebildet) (Abbildung 1 AE).
- Legen Sie die Kunststoffscheibe auf die Ölschicht mit den Luftschlitzen des Netzes nach oben zeigen (Abbildung 1 A). Bitte überprüfen Sie bei diesem Schritt: Die Höhe der Spacer ist etwa die Hälfte der Larven Durchmesser sollte die Breite des Schlitzes etwa das Doppelte des Durchmessers der Larve werden.
- Legen Sie die Imaging-Kammer unter dem Mikroskop
B) Betäubung der Larve
- Verbinden Sie die beiden Eingänge der Kammer mit einem geeigneten Gerät Betäubung / Verdampfer.
Bitte überprüfen Sie up-front:
Die effektive Konzentration von Desfluran in den Raum-Luft sollte nie mehr als die von Sicherheitsvorschriften angegeben! Nur ein sehr kleiner Gesamtvolumen von Desfluran ist notwendig, um Larven zu betäuben. Die Anwendung von 15% (v / v) von Desfluran 1 hat sich als guter Ausgangspunkt für die Bestimmung der idealen Konzentration, die in einem Experiment verwendet werden. Aus Sicherheitsgründen empfehlen wir, dass der Verdampfer sollte nie enthalten mehr Desfluran als für 2-4 Stunden in-vivo-Bildgebung erforderlich. - Tauchen Sie das andere Ende des Schlauches an der Kammerauslass in einem Glas Wasser, dann öffnen die Ventile steuern den Fluss des Anästhetikums in die Kammer für etwa fünf Sekunden.
Bitte überprüfen Sie bei diesem Schritt:
Sie Luftblasen aufsteigen in das Wasser? Wenn nicht die Kammer undicht. - Schließen Sie die Ventile für etwa drei Sekunden.
- Monitor verbleibende Larven Bewegungen in das Mikroskop. Überprüfen Sie beide den Herzschlag und Muskelbewegungen. Bei Bedarf öffnen und Schließen von Ventilen, wie in Schritt 8 und 9 beschrieben, bis die Betäubung der Larve abgeschlossen ist, schließen Sie alle Ventile und starten Bildgebung.
Bitte überprüfen Sie bei diesem Schritt:
Residual Muskelbewegungen oder Herzschlag zeigt an, dass die Larve nicht richtig betäubt. Komplette Betäubung ist für Bilder mit hoher Auflösung. Die Larve ist in der Regel nicht länger als 15-20 Minuten narkotisiert zu einem bestimmten Zeitpunkt.
C) Imaging
- Identifizieren Sie die richtige Position und das Image der interessierenden Struktur (Abb. 2-4).
D) Erholung von Betäubung
- Nach der Bebilderung abgeschlossen ist lassen Sie Luft in die Kammer.
Bitte überprüfen Sie bei diesem Schritt:
Überprüfen Sie Herzschlag und Muskelkontraktionen der Larve durch übertragen Halogenlicht. Da Muskeln Auftraggeber Start ist es sicher, die Larve aus dem Imaging-Kammer zu entfernen. - Lösen Sie die Kammer von der Betäubung Gerät und entfernen Sie sie aus dem Mikroskop. Demontieren Sie die Kammer vorsichtig und platzieren Sie die Larve in püriert fliegen Kultivierungsmedium.
- Bewahren Sie die Schüssel in einem Brutschrank bei der entsprechenden Temperatur.
E) Zeitreihe
- Wiederholen Sie die Schritte 2-14, bis genügend Zeit Punkte erhalten worden sind.
Alternative-Protokoll:
Wenn die Larve ist es, mehr als einmal innerhalb von 30 Minuten-Intervall abgebildet werden es sinnvoll ist, um es in der Imaging-Kammer zu verlassen, bis der nächste Betäubung Zeitpunkt. Wiederholen Sie die Schritte 7-14, bis genügend Zeit Punkte erhalten worden sind.
Bitte überprüfen Sie bei diesem Schritt:
Die Larve ist nicht in der Imaging-Kammer für mehr als zwei Stunden zu einer Zeit gehalten werden, noch ist es zu betäubende länger als 15-20 Minuten zu einer Zeit.

Abbildung 1 Versammlung der Bildgebung Kammer. (A) Setzen Sie die Larve und die Kunststoff-Abstandhalter auf der Ölschicht. (B) Legen Sie eine 22 x 22 mm Deckglas auf dem Abstandshalter und setzen Sie das Plexiglas Führungsring in die Kammer, in der Nähe (C) fixieren die Lage der Larve mit dem Metallring und (D) nahe der Kammer. (E) Nun wird die Kammer bereit, auf das Mikroskop angebracht werden.
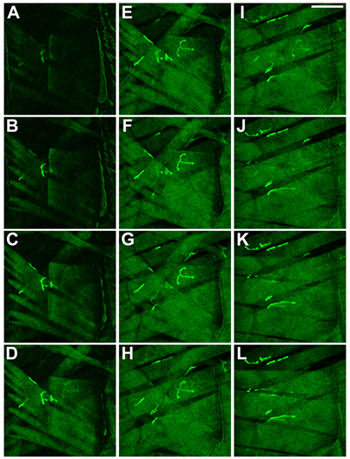
Abbildung 2 Body-Wand Muskeln in Drosophila-Larven. Muskeln und NMJs wurden durch Ausdruck einer CD8-GFP-Sh Fusionsprotein 8. Die Muskeln sind dargestellt als beobachtet werden, wenn der Schwerpunkt auf der Bauchseite durch die Kutikula in die Larve. In (AC) der oberflächlichen Muskulatur, 27, wird gezeigt, in (KL) den Innenraum Muskeln, 6 und 7 dargestellt. Scale-Bar: 100 pm, ist DELTA Z zwischen den Schichten 2 um.

Abbildung 3 Identität von Körper-Wand Muskeln in Drosophila-Larven. Die Identität der Muskeln in L3 Drosophila-Larven-, Segment-A3, wird angezeigt. Muskeln und NMJs wurden durch Ausdruck einer CD8-GFP-Sh Fusionsprotein 8. Die Muskeln werden angezeigt, wie beobachtet werden, wenn der Schwerpunkt auf der Bauchseite durch die Kutikula in die Larven. In AC die oberflächlichen Muskeln, 27, wird gezeigt, in KL den Innenraum Muskeln, 6 und 7 dargestellt. Maßstab: 100 um, DELTA Z zwischen den Schichten ist 2 um.
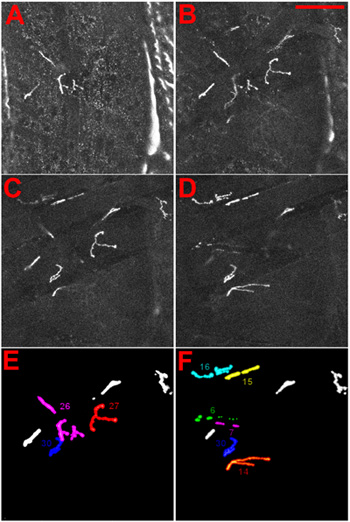
Abbildung 4 Identität des neuromuskulären Synapsen von Drosophila-Larven. (AD) NMJs wurden durch die Expression eines DGluRIIA-mRFP fusion protein 1. Die NMJs gezeigt, wie beobachtet werden, wenn der Schwerpunkt auf der Bauchseite durch die Kutikula in die Larve. In (AB) die oberflächliche NMJ, 27, wird gezeigt, in CD den Innenraum NMJs, 6 und 7, gezeigt. Maßstab: 100 um, DELTA Z zwischen den Schichten ist 5 um. (E) und (F) die Identität des oberflächlichen (E) und Innenraum (F) NMJs ist nur zur Information angegeben.
Diskussion
Die vorgestellte Methode wurde ursprünglich entwickelt, um glutamatergen Synapsen auf den Körper Wand Muskeln Drosophila melanogaster Larven zu studieren. Die Drosophila neuromuskulären Synapse (NMJ) wird durch eine stereotype Zyto-Architektur der Muskeln und Neuronen aus und ist damit ideal für den in-vivo-Bildgebung geeignet. Allerdings ist die beschriebene Betäubung Protokoll nicht zu bildgebenden die NMJ begrenzt; die Transparenz der Drosophila-Larven erleichtert die Anpassung der beschriebenen Protokoll, um die Entwicklung von Organen Studie, die Migration von Zellen, den Transport von Fracht-und axonalen sub-zellulären Reorganisation innerhalb der Zellen.
Offenlegungen
Danksagungen
Wir danken Andreas Schönle, Max-Plank-Institut für biophysikalische Chemie, Deutschland und David J. Sandström, National Institute of Mental Health, National Institutes of Health, Bethesda, MD, USA für die technische Beratung. Wir bedanken uns bei Frank Kötting, European Neuroscience Institute, Göttingen für den Bau der Bildgebung Kammer und die Betäubung Gerät. Diese Arbeit wurde durch Zuschüsse der Alzheimer Forschung Initiative zu TMRYZ unterstützt durch ein Stipendium des China Scholarship Council, SBH durch ein Stipendium der Graduate School for Cellular and Molecular Neuroscience, University of Tübingen unterstützt.
Materialien
Reagenzien:
- Desfluran (Suprane, Baxter, Unterschleißheim, Deutschland)
- Halocarbonöl (zB Voltalef H10S Öl / Atofina, Puteaux, Frankreich)
- Fly Kulturmedium
Ausstattung:
- Inverted konfokalen Mikroskop
- Binokulares Mikroskop (zB Stemi 2000, Carl Zeiss, Jena, Deutschland)
- Kleine Pinsel als zur Art fliegt
- Inkubator
- Maßarbeit Bildgebung Kammer (Für mechanische Zeichnungen sehen Ref. 3)
- Vaporizer / Betäubung Gerät (für Details siehe Lit.. 3)
Referenzen
- Rasse, T. M. Glutamate receptor dynamics organizing synapse formation in vivo. Nat Neurosci. 8, 898-905 (2005).
- Rasse, T. M. . In vivo imaging of long-term changes in the Drosophila neuromuscular system [dissertation]. , (1988).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat Protoc. 2, 3285-3298 (2007).
- Wang, X., Schwarz, T. L. Imaging axonal transport of mitochondria. Methods in enzymology. 457, 319-333 (2009).
- Vinegoni, C. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. J Vis Exp. , (2009).
- Lin, C. Y. Label-free imaging of Drosophila larva by multiphoton autofluorescence and second harmonic generation microscopy. Journal of biomedical optics. 13, 050502-050502 (2008).
- Levitan, E. S., Lanni, F., Shakiryanova, D. In vivo imaging of vesicle motion and release at the Drosophila neuromuscular junction. Nat Protoc. 2, 1117-1125 (2007).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y. &. a. m. p. ;. a. m. p., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten