Method Article
サブセルラー解像度で手つかずのショウジョウバエの幼虫の in vivoイメージングで
* これらの著者は同等に貢献しました
要約
このプロトコルは、無傷の麻酔とイメージングのための信頼性の高い方法を説明しますキイロショウジョウバエ幼虫。我々は数日までのサブセルラー分解能と構造の再認識で反復的なイメージングを可能にするためにデスフルラン揮発性麻酔薬を利用してきた 1。
要約
光学イメージングの最近の改善は、希望するトランスジェニック動物のラインの効率的な設置を可能にする遺伝的に符号化された蛍光体と遺伝学的ツールは、生活の文脈で検討する生物学的プロセスを有効にしている、といくつかのインスタンスでも、生物を行動する。このプロトコルでは我々は1-3のサブ携帯の解像度でシナプス集団の発達と可塑性に従うことをデスフルラン揮発性麻酔薬を、使用して、無傷のショウジョウバエの幼虫を麻酔する方法について説明します。 キイロショウジョウバエの幼虫を麻酔するために他の有用なメソッドが以前に4,5,6,7,8を説明してきたが、本明細書に提示プロトコルは、以下の複合キーの機能に起因する大幅な改善を示しています:麻酔の(1)非常に高い学位を、さらにハートビートが2日目および(する時間の期間にわたって個以上の時間ポイントの記録を可能にして、麻酔のサイクルごとに> 90%の(2)高い生存率、最大150 nmの1の横方向の解像度を可能に逮捕される3)2つのインスタンスで私たちを可能にする高感度は、生理学的レベルでの発現タンパク質のダイナミクスを研究する。具体的には、我々は、GluR - IIAは安定したトランスジェニック系統における内因性プロモーター1とエキソントラップラインFasII - GFP 1を介して発現するシナプスのグルタミン酸受容体サブユニットを可視化することができた。 (4)他の方法とは対照的に4,7幼虫がないだけ生きてイメージを作成するだけでなく、そのまますることができます(すなわち、非解剖)の観察は1日目の数以上発生することができます。付属のビデオの詳細vivoイメージング室2,3 での個々の部品の機能、幼虫、麻酔の手順、方法幼虫内の特定の位置を再認識すると幼虫の安全な取り外しの取付正しい画像からチャンバー。
プロトコル
イメージングチャンバーのA)組立
- 選択された段階(25℃で約24時間の観測間隔をあけ° Cの段階を徘徊するまで、例えば初期の第3齢幼虫)の幼虫を選択します。
- 培養液し、乾燥DABのそれをきれいに水で幼虫をすすぎます。
- コートチャンバの底部の要素の中心、ハロカーボンオイルの薄膜で、幼虫に直面する地域。
- チャンバー内の顕微鏡対物(神経筋接合部(NMJ)26および27は、イメージを作成することができます)(図1 AE)に面した腹側に幼虫を置く。
- グリッド面の上方(図1)の空気のスロットで、油の層の上にプラスチック製のスペーサを置きます。このステップで確認してください:スペーサの高さは約半分の幼虫の直径であり、スリットの幅は、幼虫の約2倍の直径にする必要があります。
- 顕微鏡でイメージング室を配置
幼虫のB)麻酔
- 適切な麻酔装置/気化器とチャンバーの二つのインレットを接続します。
アップフロントを確認してください。
室内空気中のデスフルランの有効濃度は、安全規則によって指定されたものを超えないようにしてください!デスフルランのごくわずかな総容量は、幼虫を麻酔するために必要です。デスフルラン1の15%のアプリケーション(v / v)の実験で使用する理想的な濃度を決定するための良い出発点であることが証明されている。安全上の理由から、我々は、気化器は、in vivoイメージングの2-4時間のために必要以上のデスフルランが含まれてはならないことを示唆している。 - 水のガラスでチャンバーの出口に接続されたチューブのもう一方の端を浸してから約5秒間チャンバーへの麻酔の流れを制御するバルブを開きます。
このステップで確認してください。
気泡が水に登るのですか?そうでない場合チャンバーは漏れやすいです。 - 約3秒間のバルブを閉じます。
- 顕微鏡で残留幼虫の動きを監視します。ハートビートと筋肉の動きの両方を確認してください。幼虫の麻酔が完了するまでに必要なオープンとクローズのバルブは、ステップ8および9で説明されている場合は、すべてのバルブを閉じて、イメージングを起動します。
このステップで確認してください。
残留筋肉の動きやハートビートは、幼虫が適切に麻酔ではないことを示します。完全な麻酔は、高解像度の画像が不可欠です。幼虫は通常、特定の時点よりも長い15〜20分のための麻酔であってはならない。
C)イメージング
- 正しい位置と画像の興味の構造(図2-4)を識別する。
D)麻酔からの回復は
- イメージングは、チャンバー内に空気を聞かせ完了後。
このステップで確認してください。
送信されるハロゲンの光によって幼虫のハートビートと筋肉の収縮を確認してください。筋肉が収縮を始めると、それは、イメージング室から幼虫を削除しても安全です。 - 麻酔装置からチャンバーを外し、顕微鏡から取り外します。慎重にチャンバーを分解しますとマッシュポテトフライ培養培地に幼虫を置く。
- 適切な温度でインキュベーター内で料理を保管してください。
E)時系列
- 十分な時間のポイントが得られるまで手順2-14を繰り返します。
代替プロトコル:
幼虫は30分間隔内で複数回撮像する場合には、次の麻酔の時点まで、イメージングチャンバー内にそれを残すために実用的かもしれません。十分な時間のポイントが得られるまで手順7-14を繰り返します。
このステップで確認してください。
幼虫は一度に2時間以上の撮像室内に保持されるものではない、またその時点でより長い15〜20分のための麻酔になることです。

イメージングチャンバーの1アセンブリを示します 。 (A)幼虫と油の層の上にプラスチック製のスペーサを置きます。 (B)、次のスペーサーで22 × 22 mmのカバースリップを置き、チャンバー内にプレキシグラスのガイドリングを挿入する(C)金属リングと幼虫の位置を修正し、(D)チャンバーを閉じます。 (E)今すぐチャンバーは顕微鏡にマウントする準備が整いました。
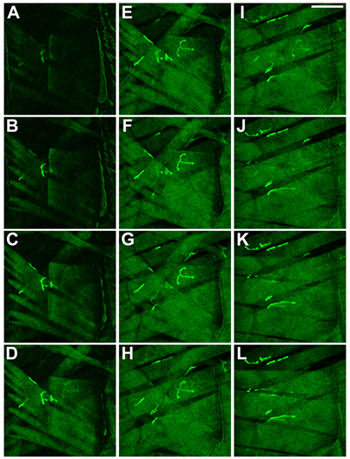
ショウジョウバエの幼虫の2ボディー壁の筋肉を図 。筋肉やNMJsはCD8 - GFP - SH融合蛋白質8の発現によって可視化した。幼虫にクチクラを通して腹側に焦点を当てたときに観察されるように筋肉が表示されます。 (AC)で最も表面的な筋肉、27は、最も内側の筋肉、6と7は、表示されている(KL)で、示されています。スケールバー:100μmの、スライス間のΔZは2μmである。

ショウジョウバエの幼虫の体壁筋の3アイデンティティを示しています 。 L3 ショウジョウバエの幼虫の筋肉のアイデンティティ、セグメントのA3は、示されている。筋肉やNMJsはCD8 - GFP - SH融合蛋白質8の発現によって可視化した。幼虫にクチクラを通して腹側に焦点を当てたときに観察されるように筋肉が表示されます。 ACで最も表面的な筋肉、27は、表示され、KLで最も内側の筋肉、6と7で、示されています。スケールバー:100μm以下、スライス間のΔZは2μmである。
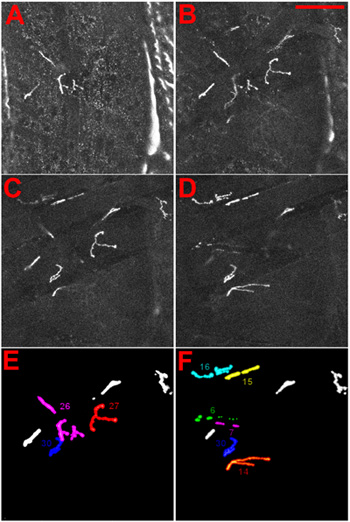
図ショウジョウバエの幼虫の神経筋接合部の4アイデンティティ 。 (AD)NMJsはDGluRIIA - MRFP融合タンパク質1の発現によって可視化した。幼虫にクチクラを通して腹側に焦点を当てたときに観察されるようにNMJsが表示されます。 (AB)の最も浅NMJ、27日に示されている、CDの中で最もインテリアNMJs、6と7は、表示されます。スケールバー:100μm以下、スライス間のΔZは5μmである。 (E)と(F)表層(E)とより多くのインテリア(F)NMJsのアイデンティティは参照のために与えられます。
ディスカッション
提示方法は、最初にキイロショウジョウバエの幼虫の体壁筋上のグルタミン酸作動性シナプスを研究するために開発されました。 ショウジョウバエ神経筋接合部(NMJ)は、筋肉や神経細胞のステレオタイプCYTO -アーキテクチャによって特徴付けられるため、理想的にin vivoイメージングに適しています。しかし、説明した麻酔のプロトコルは、イメージングNMJに限定されるものではなく、 ショウジョウバエの幼虫の透明性は、器官の発達を研究するために記述されたプロトコルの適応、細胞の遊走、細胞内の軸索の貨物とサブセルラー再編の輸送を容易にします。
開示事項
謝辞
我々は、技術的なアドバイスのために生物物理化学、ドイツとDavid J.サンドストローム、国立精神衛生研究所、国立衛生研究所、ベセスダ、MD、米国のためにアンドレアスSchönle、マックスプランク研究所に感謝する。我々は、イメージング室と麻酔のデバイスを構築するためのフランクKötting、ヨーロッパの神経科学研究所、ゲッティンゲンに感謝。この作品は、アルツハイマー病ForschungイニシアティブからTMRYZへの補助金によって支えられている細胞分子神経科学、テュービンゲン大学の大学院の交わりによってSBH、中国奨学金委員会の交わりによってサポートされていました。
資料
試薬:
- デスフルラン(Suprane、バクスター、ウンターシュライスハイム、ドイツ)
- ハロカーボンのオイル(例えばVoltalef H10S油/アトフィナ、Puteaux、フランス)
- 培地を飛ぶ
設備:
- 倒立型共焦点顕微鏡
- 双眼顕微鏡(例えばSTEMI 2000、カールツァイス、イエナ、ドイツ)
- 並べ替えに使用される小さな絵筆が飛ぶ
- インキュベーター
- カスタム構築されたイメージング室(機械図面のrefを参照してください。3)
- 気化器/麻酔装置(詳細は文献3参照)
参考文献
- Rasse, T. M. Glutamate receptor dynamics organizing synapse formation in vivo. Nat Neurosci. 8, 898-905 (2005).
- Rasse, T. M. . In vivo imaging of long-term changes in the Drosophila neuromuscular system [dissertation]. , (1988).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat Protoc. 2, 3285-3298 (2007).
- Wang, X., Schwarz, T. L. Imaging axonal transport of mitochondria. Methods in enzymology. 457, 319-333 (2009).
- Vinegoni, C. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. J Vis Exp. , (2009).
- Lin, C. Y. Label-free imaging of Drosophila larva by multiphoton autofluorescence and second harmonic generation microscopy. Journal of biomedical optics. 13, 050502-050502 (2008).
- Levitan, E. S., Lanni, F., Shakiryanova, D. In vivo imaging of vesicle motion and release at the Drosophila neuromuscular junction. Nat Protoc. 2, 1117-1125 (2007).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y. &. a. m. p. ;. a. m. p., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved