Method Article
Alt hücresel Çözünürlük bozulmamış Drosophila Larva in vivo Görüntüleme
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, bozulmamış anesthetization ve görüntüleme için güvenilir bir yöntem açıklanır Drosophila melanogaster Larvaları. Biz bir kaç gün öncesine kadar volatil anestetik desfluran yapıların alt hücresel çözünürlük ve yeniden tanımlama tekrarlayan görüntüleme için izin kullanmış olması 1.
Özet
Istenen transgenik hayvan hatlarının verimli kurulması sağlayan optik görüntüleme, genetik olarak kodlanmış fluorophores ve genetik araçları son gelişmeler bir yaşam bağlamında incelenecek biyolojik süreçlerin etkin ve hatta bazı durumlarda organizma davranıyor. Bu protokolde, alt hücresel çözünürlük 1-3 sinaptik popülasyonlarının geliştirme ve plastisite takip desfluran uçucu anestezik kullanarak sağlam Drosophila larvaları, uyutmak nasıl anlatacağız . Drosophila melanogaster larvaları uyutmak için diğer yararlı yöntemler, daha önce açıklanan 4,5,6,7,8 alınmış olsa da, burada sunulan protokol kombine aşağıdaki temel özellikleri nedeniyle önemli gelişmeler göstermektedir: (1) anesthetization çok yüksek derecede, hatta kalp atışı gün 2 (beşten fazla zaman puan saatlik bir süre içinde kayıt izin> anesthetization siklus başına% 90 (2), yüksek hayatta kalma oranı, 150 nm ye kadar 1 lateral çözünürlük izin tutuklandı 3) 2 durumlarda bize sağlayan, yüksek hassasiyetli fizyolojik düzeyde ifade edilen proteinlerin dinamiklerini incelemek için. Ayrıntılı olarak GluR-IIA istikrarlı transgenik hatları endojen organizatörü 1 ve ekzon tuzak hattı FasII-GFP 1 ile ifade postsinaptik glutamat reseptör altbirim görselleştirmek için başardık. (4) 4,7 larvaları diğer yöntemlerin aksine sadece hayatta değil görüntülü, aynı zamanda sağlam olabilir (yani olmayan disseke) gözlem gün 1 bir dizi üzerinden gerçekleşmesini sağlar. Ekteki video, in vivo görüntüleme odasının 2,3 bireysel parçaların fonksiyonu, larvaları, anesthetization prosedürü nasıl bir larva içinde belirli konumlarda yeniden tanımlamak için ve larvalarının güvenli kaldırma doğru montaj görüntüleme odası.
Protokol
A) Meclis görüntüleme odası
- Larva seçilmiş evre (yaklaşık 24 saatlik bir gözlem aralığı bırakarak 25 ° C örneğin sahne dolaşıp kadar erken 3. instar larva) seçin.
- Larva, kültür ortamı ve dab kuru temiz su ile durulayın.
- Halokarbon yağı ince bir film tabakası ile odasının alt elemanı, larva yüz bölgenin merkezinde, Coat.
- Larva odasında mikroskop objektif bakan ventral yüzü koyun (nöromüsküler bileşke (NMJ) 26 ve 27 görüntülü sağlar) (Şekil 1 AE).
- Grid bakmalıdır (Şekil 1 A) hava deliklerini, yağ tabakası üzerine plastik ara yerleştirin. Bu aşamada kontrol edin: spacer yüksekliği kabaca yarısı larva çapı, yarık genişliği larva çapının yaklaşık iki katı olmalıdır.
- Mikroskop görüntüleme odasının yerleştirin
B) Anesthetization larva
- Uygun bir anesthetization cihaz / buharlaştırıcı odasının iki girişler bağlayın.
Up-front kontrol edin:
Oda hava desfluran konsantrasyonu etkin güvenlik yönetmeliklerine belirtilen asla aşmamalıdır! Desfluran, sadece çok küçük bir toplam hacmi larvaları uyutmak için gerekli. 1 desfluran% 15 uygulaması (v / v) bir deneyde kullanılmak üzere ideal konsantrasyonu belirlemek için iyi bir başlangıç noktası olarak kanıtlamıştır. Güvenlik nedenleri için buharlaştırıcı in vivo görüntüleme 2-4 saat için gerekli daha asla desfluran içermesi gerektiğini öneriyoruz. - Diğer ucunda bir bardak su odasının prizine takılı tüp daldırın sonra yaklaşık beş saniye süreyle odasına anestezi akışını kontrol vanalarının açık.
Bu aşamada kontrol edin:
Hava kabarcıkları su yükselirken musunuz? Değilse odasına sızdıran. - Yaklaşık üç saniye vanalarını kapatın.
- Mikroskop kalıntı larva hareketleri izleyin. Kalp atışı ve kas hareketleri de kontrol edin. Larva anesthetization tamamlanana kadar gerekli açık ve yakın vanalar adım 8 ve 9 olarak açıklanan, daha sonra tüm vanaları kapatın ve görüntüleme başlayın.
Bu aşamada kontrol edin:
Artık kas hareketi ya da kalp atışı, larva düzgün anestezi olmadığını gösterir. Komple anesthetization yüksek çözünürlüklü görüntüler için hayati önem taşımaktadır. Larva normalde belirli bir zamanda daha uzun bir süre 15-20 dakika narkoz olmamalıdır.
C) Görüntüleme
- Doğru pozisyonu ve görüntü faiz yapısı (Şekil 2-4) belirleyin.
Den D) Kurtarma anesthetization
- Görüntüleme odasına hava izin tamamlandıktan sonra.
Bu aşamada kontrol edin:
Iletilen halojen ışık ile larva kalp atışı ve kas kasılmaları kontrol edin. Kasları sözleşme başlangıç olarak görüntüleme odasından larva kaldırmak için güvenlidir. - Anesthetization cihazdan oda ayırın ve mikroskop çıkarın. Odanın dikkatlice sökün ve püresi sinek ekimi orta larva.
- Bir kuluçka çanak uygun sıcaklıkta saklayın.
E) Zaman serileri
- Yeterli zaman noktalarında elde edilmiştir kadar 2-14 adımları tekrarlayın.
Alternatif protokolü:
Larva, 30 dakikalık zaman aralığı içinde bir kereden fazla yansıması ise, bir sonraki anesthetization noktaya kadar görüntüleme odasında bırakmak için pratik olabilir. Yeterli zaman noktalarında elde edilmiştir kadar 7-14 adımları tekrarlayın.
Bu aşamada kontrol edin:
Larva, bir defada iki saatten fazla görüntüleme odasında tutulması, ne de bir seferde 15-20 dakika daha uzun süre narkoz için değildir.

Görüntüleme odasının Şekil 1 Meclisi. (A) larva ve plastik ayırıcı yağ tabakası üzerine yerleştirin. (B) yerleştirin ve ayırıcı bir 22 x 22 mm kapak kayma (C) metal halka ile larva pozisyonunu düzeltmek ve (D) odasına yakın odasına pleksiglas kılavuz yüzük takmak. (E) Şimdi odanın mikroskop üzerine monte edilmek üzere hazırdır.
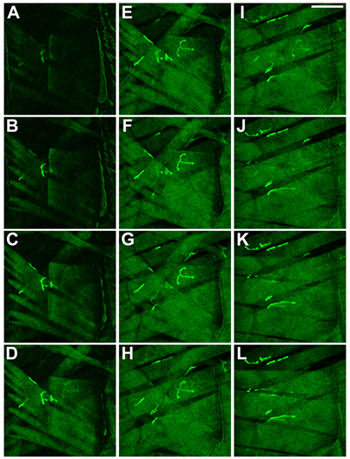
Şekil 2 Drosophila larvaları Vücut duvarı kasları. Kaslar ve NMJs CD8-GFP-Sh füzyon proteini 8 ifade görüntülendi. Larva haline manikür ventral tarafında odaklanarak zaman görüldüğü gibi, kaslar gösterilmektedir. (AC) en yüzeysel kas, 27, gösterilir, (KL) en iç kasları, 6 ve 7 gösterilir. Ölçek Bar: 100 mikron, dilimler arasında ΔZ 2 mikron.

Şekil 3 Drosophila larvaların vücut duvarı kasları Kimlik. L3 Drosophila larvaları, segment A3 kasları kimliği gösterilir. Kaslar ve NMJs CD8-GFP-Sh füzyon proteini 8 ifade görüntülendi. Larvaları manikür ventral tarafında odaklanarak zaman görüldüğü gibi, kaslar görüntülenir. En yüzeysel kas, 27, AC gösterilir KL en iç kasları, 6 ve 7 gösterilir. Ölçek Bar: 100 mikron, ΔZ dilimleri arasında 2 mikron.
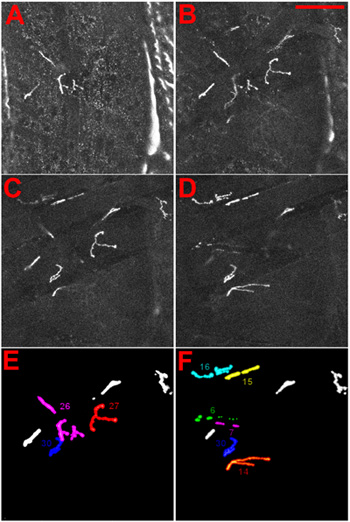
Şekil 4 Kimlik Drosophila larvaların nöromüsküler kavşak. (AD) NMJs DGluRIIA-MRFP füzyon proteini 1 ifadesi ile görüntülendi. NMJs larva haline manikür ventral tarafında odaklanarak zaman gözlemlediği gibi gösterilmiştir. (AB) en yüzeysel NMJ, 27, gösterilen, en iç NMJs, 6 ve 7, CD gösterilmiştir. Ölçek Bar: 100 mikron, ΔZ dilimleri arasında 5 mikron. (E) ve (F) yüzeysel (E) ve (F) daha iç NMJs kimliği referans verilir.
Tartışmalar
Sunulan yöntem başlangıçta Drosophila melanogaster larvaların vücut duvarı kasları glutamaterjik sinapsların çalışma için geliştirilmiştir. Drosophila nöromüsküler bileşke (NMJ), kas ve nöronlar basmakalıp bir sito-mimarisi ile karakterizedir ve bu nedenle in vivo görüntüleme için ideal uygundur . Ancak, açıklanan anesthetization protokol görüntüleme NMJ sınırlı değil; Drosophila larvaların şeffaflık, organların gelişimini incelemek için açıklanan protokol adaptasyon, hücre göçü, hücre içinde aksonal kargo ve alt-hücresel yeniden yapılanma taşınması kolaylaştırır .
Açıklamalar
Teşekkürler
Biz Andreas Schönle, Biyofiziksel Kimya, Almanya ve David J. Sandström, Ulusal Ruh Sağlığı Enstitüsü, Sağlık, Bethesda, MD, ABD Ulusal Sağlık Enstitüleri teknik danışmanlık için Max-Plank Enstitüsü teşekkür ederim. Biz Kötting Frank, Avrupa Nörobilim Enstitüsü, Göttingen görüntüleme odasının inşa için ve anesthetization cihazı teşekkür ederiz. Bu çalışma, Alzheimer Forschung TMRYZ Girişimi hibeleri tarafından desteklenen, Çin Burs Kurulu, SBH Hücresel ve Moleküler Nörobilim, Tübingen Üniversitesi Graduate School of bir burs ile bir dostluk tarafından desteklenen oldu.
Malzemeler
Reaktifler:
- Desfluran (Suprane, Baxter, Unterschleißheim, Almanya)
- Halokarbon yağı (örneğin Voltalef H10S yağ / Atofina, Puteaux, Fransa)
- Fly kültür ortamı
Ekipman:
- Ters konfokal mikroskop
- Binoküler mikroskop (örneğin STEMI 2000, Carl Zeiss Jena, Almanya)
- Sıralamak olarak kullanılan küçük bir fırça uçar
- Kuvöz
- Özel inşa görüntüleme odası (mekanik çizimler için bakiniz Ref 3)
- Buharlaştırıcı / anesthetization cihazı (Ayrıntılı bilgi için Referans 3)
Referanslar
- Rasse, T. M. Glutamate receptor dynamics organizing synapse formation in vivo. Nat Neurosci. 8, 898-905 (2005).
- Rasse, T. M. . In vivo imaging of long-term changes in the Drosophila neuromuscular system [dissertation]. , (1988).
- Fuger, P., Behrends, L. B., Mertel, S., Sigrist, S. J., Rasse, T. M. Live imaging of synapse development and measuring protein dynamics using two-color fluorescence recovery after photo-bleaching at Drosophila synapses. Nat Protoc. 2, 3285-3298 (2007).
- Wang, X., Schwarz, T. L. Imaging axonal transport of mitochondria. Methods in enzymology. 457, 319-333 (2009).
- Vinegoni, C. Mesoscopic fluorescence tomography for in-vivo imaging of developing Drosophila. J Vis Exp. , (2009).
- Lin, C. Y. Label-free imaging of Drosophila larva by multiphoton autofluorescence and second harmonic generation microscopy. Journal of biomedical optics. 13, 050502-050502 (2008).
- Levitan, E. S., Lanni, F., Shakiryanova, D. In vivo imaging of vesicle motion and release at the Drosophila neuromuscular junction. Nat Protoc. 2, 1117-1125 (2007).
- Zito, K., Parnas, D., Fetter, R. D., Isacoff, E. Y. &. a. m. p. ;. a. m. p., Goodman, C. S. Watching a synapse grow: noninvasive confocal imaging of synaptic growth in Drosophila. Neuron. 22, 719-729 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır