Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Determinación de la metilación del ADN de los genes impresos en Arabidopsis Endospermo
En este artículo
Resumen
La impresión es un fenómeno en la planta y reproducción de los mamíferos. Metilación del ADN juega un papel importante en los mecanismos de impresión. Aislar endospermo y determinar el estado de metilación de los genes impresos en Arabidopsis Puede ser difícil. En este protocolo, se describe cómo aislar endospermo y determinar la metilación de la secuenciación de bisulfito.
Resumen
Arabidopsis thaliana es un organismo modelo excelente para estudiar los mecanismos epigenéticos. Una de las razones es el mutante nulo de pérdida de función de ADN metiltransferasa es viable, proporcionando así un sistema para estudiar cómo la pérdida de metilación del ADN en el genoma afecta el crecimiento y desarrollo. La impronta se refiere a la expresión diferencial de los alelos maternos y paternos, y juega un papel importante en el desarrollo de la reproducción, tanto en mamíferos y plantas. Metilación del ADN es fundamental para determinar si los alelos maternos y paternos de un gen impreso se expresa o se silencian. En las plantas con flores, hay un evento de doble fertilización en la reproducción: un espermatozoide fertiliza el óvulo para formar un embrión y el espermatozoide se fusiona con la célula de segundo central para dar lugar a endospermo. Endospermo es el tejido donde se produce en las plantas de impresión. MEDEA, un dominio establecido Polycomb gen del grupo, y la FWA, un factor de transcripción que regulan la floración, son los dos primeros genes demostrado ser impreso en el endospermo y su expresión está controlada por la metilación del ADN y desmetilación en las plantas. Con el fin de determinar el estado de impresión de un gen y el patrón de metilación en el endospermo, tenemos que ser capaces de aislar primero endospermo. Desde la semilla es muy pequeña en Arabidopsis, que sigue siendo un reto para aislar endospermo Arabidopsis y examinar su metilación. En este protocolo de vídeo, se presenta la manera de realizar un cruce genético, para aislar el tejido del endospermo de las semillas, y para determinar el estado de metilación de la secuenciación de bisulfito.
Protocolo
I. genética Cruce
1. Castrando el progenitor femenino
Con el fin de distinguir los alelos maternos y paternos mediante el uso de polimorfismo de secuencia de ADN, dos ecotipos diferentes, por ejemplo, Columbia-0 (Col-0) y Ler, será elegido como padres de familia femenino y masculino. Las plantas deben ser joven y saludable. Se puede castrar el progenitor femenino mediante el uso de un microscopio de disección, de aumento visor, o el ojo desnudo. Localizar 12 etapa flores (Smyth et al., 1990) y quitar cualquier flor o silicuas por encima y por debajo de ellos por el recorte de la base del pedúnculo con las tijeras. Esterilizar pinzas por inmersión de la base de la punta suavemente en un vaso de etanol al 95%, lo que eliminará los granos de polen en las pinzas y matar al polen también. Haciendo palanca con cuidado, aparte las yemas florales con unas pinzas y retire con cuidado 4 sépalos, pétalos 4, y 6 estambres, los pistilos dejando al descubierto e intacta. Trate de evitar el daño a los carpelos durante este proceso.
2. La elección del donante de polen y llevar a cabo la polinización
Los donantes de polen son más anthesed flores se abren en la etapa 14, con los pétalos que se extiende en un ángulo de 90 ° para el pistilo (Smyth et al., 1990), en el que una gran cantidad de polen está derramando. Coge la flor en la base y justo por encima del pedúnculo, lo que hará que la flor de difusión abierta. Polvo el estigma del pistilo preparado con la antera. Después de la polinización, el estigma que serán cubiertos con el polen amarillo, que puede ser fácilmente observado bajo un microscopio.
3. Etiquetado de la cruz
Después de la polinización todos los pistilos castrado en una planta, que marca la cruz con una etiqueta de la joyería y la información de los padres de ambos sexos y la fecha. Coloque una estaca en el suelo cerca de la planta, utilice una cadena para atar el tallo de la inflorescencia de la hoguera, y cubren los pistilos de polinización con una bolsa de plástico.
II. El aislamiento de los tejidos del endospermo en Arabidopsis
1. Preparación de materiales
Por lo general, obtener el material necesario listo antes de la cosecha del endospermo y los tejidos del embrión: un tanque de nitrógeno líquido, nitrógeno líquido, un microscopio de disección, dos nuevos pares de pinzas de punta fina (5 INOX FST por Dumont biología, Suiza.), Portaobjetos de vidrio ( 3 "x 1" x 1.0 mm), un pH de 5,7 solución de 0,3 M sorbitol y 5 mM MES.
2. Silicuas recolección
A las 7 - y 8 días después de la polinización (DAP), las semillas están listas para ser cosechadas a mediados de la última etapa de torpedo de la embriogénesis y la disección de endospermo y el embrión. A veces, puede tardar 9-10 DAP si las flores están desvirtuadas demasiado joven.
3. Endospermo y el embrión de aislamiento
Ya que las semillas de Arabidopsis son pequeños, se utiliza un microscopio de disección para aislar el endospermo y el embrión. Ponga una silicua 8-DAP con un microscopio, use un par de pinzas para sostener el pedicelo silicua y el uso de la punta del otro par de pinzas para abra la silicua en el margen donde se fusionan dos carpelos. Use un par de pinzas para recoger una semilla en soluciones de pH 5,7 de 0,3 M sorbitol y 5 mM MES, hacer un pequeño corte en el extremo micrópilo se deslice fuera del embrión, apriete el extremo sin cortar para expulsar el endospermo y el endosperma separado de cubierta de la semilla (Kinoshita et al., 2004). Puesto que el embrión y el endospermo en microtubos separado en nitrógeno líquido. Continúe hasta que se acumulan embrión o endospermo 10 a 15 silicuas y luego guarde el tubo en un congelador de -80 º C. En algunos casos, el endospermo no tiene que ser separado de cubierta de la semilla, es decir, se puede aislar el ARN total a partir del endospermo y la mezcla de cáscara de la semilla para el análisis de los genes la impronta.
III. La secuenciación de bisulfito
1. Reactivos necesarios
Bromuro de amonio cetiltrimetil (CTAB) para la preparación de ADN genómico, las enzimas de restricción, 3 M NaOH (recién hecho), 6,42 M de urea / 4 bisulfito de sodio M (2 metabisulfito de sodio M, Sigma-Aldrich, S9000, Na2S2O5, peso molecular: 190), 10 mM hidroquinona, un kit de purificación de ADN (Promega ADN Asistente de limpieza del sistema, cat. # A7280), tampón TE, 6,3 M NaOH (recién hecha), 10 M NH 4 OAc, 20 mg / l tRNA, y el 100% de etanol .
2. Los detalles del protocolo de tratamiento de bisulfito
- Aislar ADN genómico o del endospermo del embrión mediante un procedimiento de CTAB (Rogers y Bendich, 1988).
- Recopilación de 100 ng - 2 mg de ADN genómico en 20 l de volumen de 100 l total con enzimas de restricción que cortan fuera de la región para ser analizados. Para el promotor de MEA, usamos XhoI, NdeI y PstI o HindIII.
- Desnaturalizar las enzimas de restricción mediante la ebullición del ADN de cinco minutos y luego apagar el hielo.
- Añadir un volumen 1 / 9 (2,2 l de 20 l de ADN digerido), de 3 M de NaOH y se incuba a 37 ° C durante 15 minutos.
- Transferir la solución a un tubo de 250 l de PCR.
- Disolver 7,5 g de urea en 10 ml de agua destilada estéril; Poco a poco añadir 7,6 g de metabisulfito de sodio durante 1-2 horas y la calefacción por lo general ayuda a la disolución, ajustar el pH a 5 con NaOH recién hecho 10 M, añadir agua destilada estéril a una final volumen de 20 ml. Se trata de 6,24 M de urea / 4 solución de sodio bisulfito M.
- Añadir 6,24 M de urea / 4 M solución de bisulfito de sodio a una concentración final de 5,36 M y M 3,44, respectivamente (Paulin et al., 1998). Por ejemplo, añadir 208 l de 6,42 M de urea / 4 M solución de bisulfito de sodio a los anteriores 22,2 l de ADN genómico desnaturalizado (Xiao et al., 2003).
- Añadir 10 mM hidroquinona al ADN a una concentración final de 0,5 mM (12 l para la digestión 20 l).
- Realizar el tratamiento de bisulfito en una máquina de PCR: 30 ciclos de 55 ° C durante 15 minutos y los segundos 95 ° C durante 30.
- Desalar el ADN bisulfito tratados con el ADN Asistente de Limpieza del sistema de Promega y el seguimiento del protocolo (Jacobsen et al., 2000).
- Medir el volumen exacto de TE se recuperó de la columna después de la desalación y añadir 6,3 M de NaOH a una concentración final de 0,3 M. Se incuba a 37 ° C durante 15 minutos.
- Añadir 10 M NH 4 OAc (pH 7,0) a una concentración final de 3 M, 2 l de 20 ug / l tRNA, y 3 volúmenes de etanol al 100% y luego mezclar. Centrifugar durante 15 minutos a 14.000 rpm.
- Lavar el sedimento una vez con etanol al 70%, hacer un centrifugado corto, y retirar el etanol extra.
- Seco en pelets en un speedvac durante 5-10 minutos y resuspender en 25 hasta 100 l de buffer TE en función de la cantidad de ADN de partida. El bisulfito sódico tratados con ADN está listo para el análisis de PCR.
3. Amplificación por PCR
- Desde citosinas no metiladas se convierten en uracilo, es difícil para amplificar un fragmento de gran tamaño utilizando el ADN tratado con bisulfito como una plantilla. Por lo tanto, suelen diseñar primers para amplificar un producto de no más de 500 pb. Para la secuencia del promotor de 4 kb MEA, hemos diseñado varios conjuntos de cebadores y la superposición de fragmentos amplificados 14 para cubrir toda la región (Xiao et al., 2003).
- A la secuencia de la parte superior de hebra, en el diseño de una cartilla con interés, I) elegir una G (guanina)-rica región con el fin de tener una temperatura más alta de recocido sin nucleótidos de largo adicionales en las cartillas, II) el cambio C (citosina) a Y ( pirimidina) en el CG y los contextos de GNC y cambiar el resto de C a T (timina). En el diseño de un cebador inverso, I) elija una región rica en C, II) el cambio de G R (purina) en CG y los contextos de GNC y cambiar el resto de G a A (adenina).
- A la secuencia de la parte inferior-cadena, en el diseño de una cartilla con interés, I) elija una región rica en C, II) el cambio G a R en CG y los contextos de GNC y el cambio del G restantes a A. En el diseño de un cebador inverso, I) elegir una región rica en G; II) El cambio C a Y (pirimidina) en el CG y los contextos de GNC y cambiar el resto de C para T.
- Por lo general, el uso 1.2 l de sodio bisulfito tratados con ADN como una plantilla para cada amplificación por PCR (Xiao et al., 2003). El producto de PCR debe ser analizado por electroforesis en gel para confirmar el tamaño correcto del fragmento, luego de ser gel purificado y clonado en el vector TOPO TA clonación pCR2.1 (Invitrogen) como una inserción. Una sola colonia se recoge y se cultivan; ADN plásmido extraído y enviado para su secuenciación.
4. Análisis de secuencias
El principio de la secuenciación de bisulfito es que la citosina no metilados se convertirá en uracilo debido a la desaminación hidrolítica por la alta concentración de bisulfito de sodio a pH 5,0, que se amplifica a medida que la timina en el producto de PCR, mientras que el 5-metil citosina no será modificado por bisulfito de sodio y aún no se han citosina después de la amplificación por PCR (Clark et al, 1994;. Frommer et al, 1992).. Después de obtener el resultado de la secuencia, se la compara con la plantilla capítulo específico que se utiliza para la amplificación por PCR. Si un residuo de citosina en la plantilla se lee como una timina en el resultado de la secuencia, indica que la citosina no está metilado. Si un residuo de citosina en la plantilla sigue siendo una citosina en la secuencia, significa que la citosina está metilado.
IV. Resultados representante
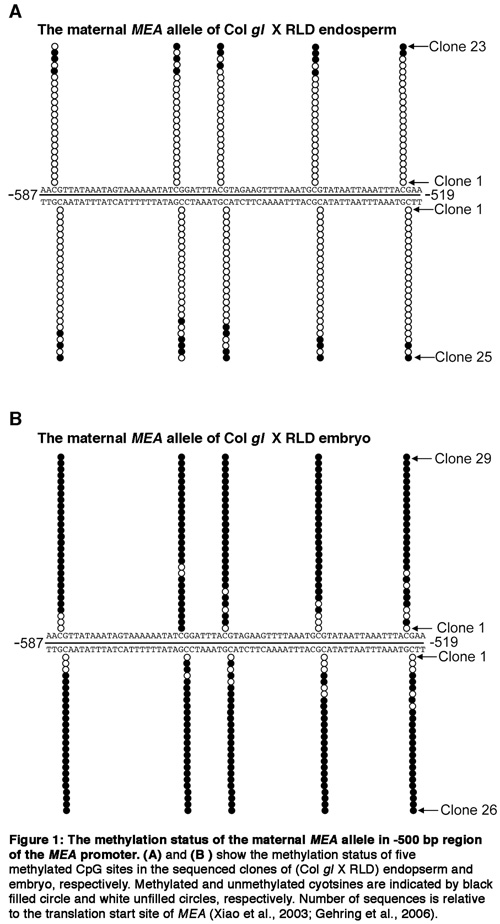 Figura 1.
Figura 1.
Discusión
Es relativamente fácil de separar del embrión y endospermo cubierta de la semilla, pero es tedioso para separar el endospermo de la cáscara de la semilla, especialmente para las semillas en la etapa de principios o mediados de torpedo de la embriogénesis. Desde cubierta de la semilla sólo aporta una pequeña cantidad de tejido, para algunos genes, por ejemplo, MEA y FWA, no hay que separar el endospermo de la cáscara de la semilla. Esto significa que podemos aislar ARN a partir de una mezcla de e...
Divulgaciones
Agradecimientos
Los autores agradecen a la Sra. Jennifer M. Lommel y Tara N. Rognan para el mantenimiento de plantas de Arabidopsis. Este trabajo fue apoyado por la puesta en marcha de fondos de la Universidad de Saint Louis y los Institutos Nacionales de Salud subvenciones 1R15GM086846-01 y 3R15GM086846-01S1 a W. Xiao.
Materiales
Suministros
- Microscopio de disección
- Tijeras
- Pinzas de punta fina
- Joyas de la etiqueta
- Las estacas de plantas
- Cuerdas o cintas de cierre
- 4 "X 2" X 8 "Bolsas de Polietileno
- 3 "x 1" x 1.0 mm Micropreparados
- El nitrógeno líquido
- Los contenedores de nitrógeno líquido
- Bloquear el calor
- Tubos para PCR
- Termociclador
- Tubos de microcentrífuga
- Microcentrífuga
- Gel de electroforesis de instalación
- Arabidopsis thaliana Columbia-0 plantas
- Arabidopsis thaliana Landsberg erecta plantas
Reactivos
- 70% de etanol
- Etanol al 95%
- 100% de etanol
- 0,3 M sorbitol y 5 mM MES, pH 5,7
- Bromuro de amonio cetiltrimetil (CTAB)
- 100% de etanol
- Cholorform
- Las enzimas de restricción
- 3 M NaOH
- 6,3 M NaOH
- 6,24 M de urea / 4 bisulfito de sodio M
- Destilada estéril H 2 O
- 10 mM hidroquinona
- Asistente de ADN Clean-Up System (Promega)
- 10 M NH 4 OAc
- 20 mg / l tRNA
- Tampón TE
- El kit de clonación TOPO TA (Invitrogen)
Referencias
- Clark, S. J., Harrison, J., Paul, C. L., Frommer, M. High sensitivity mapping of methylated cytosines. Nucleic Acids Res. 22, 2990-2997 (1994).
- Cokus, S. J., Feng, S., Zhang, X., Chen, Z., Merriman, B., Haudenschild, C. D., Sriharsa Pradhan, S., Nelson, S. F., Pellegrini, M., Jacobsen, S. E. Shotgun bisulphite sequencing of the Arabidopsis genome reveals DNA methylation patterning. Nature. 452, 215-219 (2008).
- Frommer, M., McDonald, L. E., Millar, D. S., Collis, C. M., Watt, F., Grigg, G. W. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proc Natl Acad Sci USA. 89, 1827-1831 (1992).
- Gehring, M., Huh, J. H., Hsieh, T. F., Penterman, J., Choi, Y., Harada, J. J., Goldberg, R. B., Fischer, R. L. D. E. M. E. T. E. R. DNA glycosylase establishes MEDEA polycomb gene self-imprinting by allele-specific demethylation. Cell. 124, 495-506 (2006).
- Henderson, I. R., Chan, S. R., Cao, X., Johnson, L., Jacobsen, S. E. Accurate sodium bisulfite sequencing in plants. Epigenetics. 5, 47-49 (2010).
- Hsieh, T. F., Ibarra, C. A., Silva, P., Zemach, A., Eshed-Williams, L., Fischer, R. L., Zilberman, D. Genome-wide demethylation of Arabidopsis endosperm. Science. 324, 1451-1454 (2009).
- Jacobsen, S. E., Sakai, H., Finnegan, E. J., Cao, X., Meyerowitz, E. M. Ectopic hypermethylation of flower-specific genes in Arabidopsis. Curr. Biol. 10, 179-186 (2000).
- Kinoshita, T., Miura, A., Choi, Y., Kinoshita, Y., Cao, X., Jacobsen, S. E., Fischer, R. L., Kakutani, T. One-way control of FWA imprinting in Arabidopsis endosperm by DNA methylation. Science. 303, 521-523 (2004).
- Lister, R., O'Malley, R. C., Tonti-Filippini, J., Gregory, B. D., Berry, C. C., Millar, A. H., Ecker, J. R. Highly integrated single-base resolution maps of the epigenome in Arabidopsis. Cell. 133, 523-536 (2008).
- Lister, R., Pelizzola, M., Dowen, R. H., Hawkins, R. D., Hon, G., Tonti-Filippini, J., Nery, J. R., Lee, L., Ye, Z., Ngo, Q. -. M. Human DNA methylomes at base resolution show widespread epigenomic differences. Nature. 462, 315-322 (2009).
- Paulin, R., Grigg, G. W., Davey, M. W., Piper, A. A. Urea improves efficiency of bisulfite-mediated sequencing of 5'- methylcytosine in genomic DNA. Nucl. Acids Res. 26, 5009-5010 (1998).
- Rogers, S. O., &, B. e. n. d. i. c. h., J, A. Extraction of DNA from plant tissues. Plant Molecular Biology Manual. A6, 1-10 (1988).
- Smyth, D. R., Bowman, J. L., Elliot, M., Meyerowitz, E. M. Early Flower Development in Arabídopsis. Plant Cell. 2, 755-767 (1990).
- Xiao, W., Gehring, M., Choi, Y., Margossian, L., Pu, H., Harada, J. J., Goldberg, R. B., Pennell, R. I., Fischer, R. L. Imprinting of the MEA Polycomb gene is controlled by antagonism between MET1 methyltransferase and DME glycosylase. Dev. Cell. 5, 891-901 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados