Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Détermination de méthylation de l'ADN des gènes soumis à empreinte dans les Arabidopsis Endosperme
Dans cet article
Résumé
L'imprinting est un phénomène dans l'usine et la reproduction des mammifères. Méthylation de l'ADN joue un rôle important dans les mécanismes de l'empreinte. Isoler l'endosperme et la détermination du statut de méthylation de gènes soumis à empreinte dans les Arabidopsis Il peut être difficile. Dans ce protocole, nous décrivons comment isoler l'albumen et de déterminer la méthylation par séquençage au bisulfite.
Résumé
Arabidopsis thaliana est un organisme excellent modèle pour étudier les mécanismes épigénétiques. Une des raisons est le mutant nul de perte de fonction de l'ADN méthyltransférases est viable, offrant ainsi un système à étudier comment la perte de méthylation de l'ADN dans un génome influe sur la croissance et le développement. Impression se réfère à l'expression différentielle des allèles maternels et paternels et joue un rôle important dans le développement de la reproduction dans les deux mammifères et les plantes. Méthylation de l'ADN est essentielle pour déterminer si les allèles maternels ou paternels d'un gène est exprimé ou imprimé au silence. Dans les plantes à fleurs, il ya un événement double fécondation de la reproduction: un spermatozoïde fertilise l'ovule pour former l'embryon et un spermatozoïde fusionne avec la seconde cellule centrale pour donner naissance à l'albumen. Endosperme est le tissu où se produit l'empreinte dans les plantes. MEDEA, un domaine SET gènes du groupe Polycomb et FWA, un facteur de transcription régulant la floraison, sont les deux premiers gènes soumis à empreinte montré dans l'endosperme et de leur expression est contrôlée par méthylation de l'ADN et la déméthylation de plantes. Afin de déterminer le statut de l'empreinte d'un gène et le modèle de méthylation dans l'albumen, nous devons être en mesure d'isoler l'albumen premier. Depuis semence est petite chez Arabidopsis, il reste difficile d'isoler l'albumen Arabidopsis et examiner sa méthylation. Dans ce protocole vidéo, nous présentons la façon de mener un croisement génétique, afin d'isoler albumen de graines, et de déterminer le statut de méthylation par séquençage au bisulfite.
Protocole
I. croisement génétique
1. Amputer le parent femelle
Afin de distinguer les allèles maternels et paternels en utilisant le polymorphisme de séquence d'ADN, deux écotypes différents, par exemple-Britannique-0 (Col-0) et Ler, seront choisis en tant que parents féminin et masculin. Les plantes doivent être jeune et saine. On peut affaiblir le parent femelle en utilisant un microscope à dissection, grossissant visière, ou de l'œil nu. Localisez étape-12 fleurs (Smyth et al., 1990) et enlever les fleurs ou siliques ci-dessus et en dessous d'eux par clipsage de la base du pédoncule avec les ciseaux. Stériliser une pince en trempant la base de la pointe doucement dans un bécher d'éthanol à 95%, ce qui supprime tout les grains de pollen sur la pince et de tuer le pollen ainsi. Soulever doucement dehors les bourgeons floraux à l'aide des pinces, et retirez délicatement 4 sépales, 4 pétales, étamines et 6, en laissant le pistil nu et intact. Essayez d'éviter d'endommager le carpelles pendant ce processus.
2. Choisir le donneur de pollen et de réaliser la pollinisation
Les donateurs meilleurs pollen sont anthesed fleurs ouvertes au stade 14 avec les pétales s'étendant à angle de 90 ° au pistil (Smyth et al., 1990), dans lequel beaucoup de pollen est mue. Prenez la fleur à la base et juste au-dessus du pédoncule, qui va provoquer la fleur de répandre ouvert. La poussière du stigmate du pistil préparé avec l'anthère. Après la pollinisation, la stigmatisation sera couvert avec le pollen jaune, qui peut être facilement observés sous un microscope.
3. Étiquetage de la croix
Après la pollinisation tous les pistils émasculée sur une plante, nous marquons la croix avec une étiquette de bijoux et d'information des parents masculins et féminins et la date. Placez une participation dans le sol près de l'usine, utilisez une chaîne pour attacher la tige de l'inflorescence au bûcher, et couvrir les pistils pollinisées avec un sac en plastique.
II. Isolement des tissus endosperme chez Arabidopsis
1. Préparation des matériaux
Nous obtenons habituellement des matériaux nécessaires avant la récolte de l'endosperme et les tissus d'embryon: un réservoir d'azote liquide, azote liquide, un microscope à dissection, deux nouvelles paires de pointe fine pince (5 INOX TSF par Dumont biologie, Suisse.), Des lames de verre de microscope ( 3 "x 1" x 1.0 mm), une solution de pH 5,7 à 0,3 M de sorbitol et 5 mM de MES.
2. Collecte des siliques
A 7 - ou 8-jour-après-pollinisation (DAP), les graines sont prêtes à être récoltées à la mi-à fin stade torpille de l'embryogenèse et disséquées pour l'endosperme et l'embryon. Parfois, cela peut prendre 90 à 10 DAP si les fleurs sont trop jeunes émasculés.
3. Isoler l'endosperme et l'embryon
Comme les graines d'Arabidopsis sont minuscules, on utilise un microscope à dissection pour isoler l'albumen et l'embryon. Mettez une silique 8-DAP sous un microscope, utilisez une pince pour tenir le pédoncule silique et utilisez la pointe d'une autre paire de pinces pour ouvrir le slide silique dans la marge, où fusionnent deux carpelles. Utilisez une paire de pinces pour ramasser une graine sur des solutions pH 5,7 de 0,3 M de sorbitol et 5 mM MES, faire une petite coupure à l'extrémité micropyle à glisser l'embryon, presser la fin uncut pour faire sortir l'endosperme et l'endosperme séparer de tégument (Kinoshita et al., 2004). Mettez l'embryon et l'endosperme dans des microtubes séparés dans l'azote liquide. Continuer ainsi jusqu'à ce que nous accumulons embryon ou l'albumen de 10 à 15 siliques et stocker ensuite le tube dans un congélateur à -80 ° C. Dans certains cas, l'albumen ne doit pas être séparé de tégument, c'est à dire, on peut isoler l'ARN total de l'endosperme et le mélange de tégument pour l'analyse des empreintes génétiques.
III. Séquençage bisulfite
1. Réactifs nécessaires
Bromure de cétyltriméthylammonium (CTAB) pour la préparation de l'ADN génomique, des enzymes de restriction, 3 M NaOH (fraîchement faite), 6,42 M d'urée / 4 de bisulfite de sodium M (2 métabisulfite de sodium M, Sigma-Aldrich, S9000, Na2S2O5 Poids Moléculaire: 190), 10 mM d'hydroquinone, un kit de purification d'ADN (DNA Promega Wizard système de nettoyage, Cat. # A7280), un tampon TE, 6,3 M de NaOH (fraîchement préparé), 10 M NH 4 OAc, 20 ug / uL ARNt, et de l'éthanol à 100% .
2. Détails sur le protocole de traitement au bisulfite
- Isoler l'endosperme ou l'ADN génomique en utilisant une procédure d'embryon CTAB (Rogers et Bendich, 1988).
- Recueil de 100 ng - 2 pg d'ADN génomique dans 20 uL à 100 uL volume total des enzymes de restriction qui coupent l'extérieur de la région pour être analysés. Pour le promoteur MEA, nous utilisons Xhol, Ndel et PstI ou HindIII.
- Dénaturer les enzymes de restriction par l'ébullition de l'ADN pour cinq minutes, puis étancher sur la glace.
- Ajouter le volume 1 / 9 (2,2 pour 20 uL d'ADN digérés uL) de 3 M NaOH et incuber à 37 ° C pendant 15 minutes.
- Transférer la solution à un tube de PCR 250 uL.
- Dissoudre 7,5 g d'urée dans 10 ml d'eau distillée stérile; Ajouter lentement 7,6 g de métabisulfite de sodium pendant 1-2 heures et de chauffage permet habituellement dissoudre; Ajuster le pH à 5 avec NaOH fraîchement préparé 10 M; Ajouter l'eau distillée stérile à une finale volume à 20 ml. C'est 6,24 M d'urée / solution 4 M de bisulfite de sodium.
- Ajouter 6,24 M d'urée / solution 4 M de bisulfite de sodium à une concentration finale de 5,36 M et 3,44 M, respectivement (Paulin et al., 1998). Par exemple, ajouter 208 ul de 6,42 M d'urée / solution 4 M de bisulfite de sodium à ce qui précède 22,2 uL d'ADN génomique dénaturé (Xiao et al., 2003).
- Ajouter 10 mM d'hydroquinone à l'ADN à une concentration finale de 0,5 mM (12 uL de 20 uL de digestion).
- Conduite traitement au bisulfite dans une machine à PCR: 30 cycles de 55 ° C pendant 15 minutes et 95 ° C pendant 30 secondes.
- Dessaler l'ADN au bisulfite traitées en utilisant l'ADN Assistant Nettoyage du système de Promega et le suivi du protocole (Jacobsen et al., 2000).
- Mesurez le volume exact de TE récupéré de la colonne après dessalage et ajouter 6,3 M NaOH à une concentration finale de 0,3 M. Incuber à 37 ° C pendant 15 minutes.
- Ajouter 10 M NH 4 OAc (pH 7,0) à une concentration finale de 3 M, 2 pl de 20 ug / uL ARNt, et 3 volumes d'éthanol 100%, puis mélanger. Centrifuger pendant 15 minutes à 14000 rpm.
- Laver le culot une fois avec 70% d'éthanol, une centrifugeuse ne court, et éliminer l'éthanol supplémentaire.
- Culot sec dans une speedvac pendant 5-10 minutes et remettre en suspension dans 25 à 100 pi de tampon TE selon le montant de départ de l'ADN. Le bisulfite de sodium-traitée ADN est maintenant prêt pour l'analyse PCR.
3. L'amplification par PCR
- Depuis cytosines non méthylées sont converties en uracile, il est difficile pour amplifier un fragment volumineux à l'aide de l'ADN au bisulfite traitée comme un modèle. Ainsi, nous avons l'habitude concevoir des amorces pour amplifier un produit pas plus de 500 pb. Pour la séquence du promoteur de 4 kb MEA, nous avons conçu de nombreux ensembles d'amorces et amplifié 14 fragments qui se chevauchent pour couvrir toute la région (Xiao et al., 2003).
- Pour la séquence du haut-brin, dans la conception d'une amorce de l'avant, I) choisir un G (guanine) région riche afin d'avoir une température plus élevée de recuit sans supplément nucléotides de long dans les amorces; II) le changement C (cytosine) à Y ( pyrimidine) à CG et contextes GNC et changer le C restant à T (thymine). Dans la conception d'une amorce antisens, I) choisissez une région C-riche; II) le changement G à R (purines) au CG et contextes GNC et le changement du G restant à A (adénine).
- Pour séquencer le bas-brin, à concevoir une amorce sens, I) choisissez une région C-riche; II) le changement G à R à CG et contextes GNC et le changement du G restant à A. Dans la conception d'une amorce antisens, I) choisissent une région riche en G; II) le changement C à Y (pyrimidine) à CG et contextes GNC et changer le C restant à T.
- Nous utilisons habituellement 1-2 uL de la bisulfite de sodium-traitée ADN comme un modèle pour chaque amplification par PCR (Xiao et al., 2003). Le produit de PCR doit être analysé par électrophorèse sur gel pour confirmer la bonne taille du fragment, puis d'être purifiés sur gel et cloné dans le clonage TOPO TA pCR2.1 vecteur (Invitrogen) comme un insert. Une seule colonie est ramassé et mis en culture; ADN plasmidique extrait et envoyé pour le séquençage.
4. L'analyse des séquences
Le principe du séquençage au bisulfite est que la cytosine non méthylé sera convertie en uracile due à la désamination hydrolytique par une forte concentration de bisulfite de sodium à pH 5,0, qui sera amplifié comme la thymine dans le produit PCR, tandis que la 5-méthyl cytosine ne sera pas modifié par le bisulfite de sodium et restent à la cytosine après amplification par PCR (Clark et al, 1994;. Frommer et al, 1992).. Après l'obtention du résultat de séquençage, on le compare avec le modèle brin spécifique qui est utilisé pour l'amplification par PCR. Si un résidu cytosine dans le modèle se lit comme une thymine dans le résultat de séquençage, il indique que la cytosine n'est pas méthylé. Si un résidu cytosine dans le modèle reste une cytosine dans le séquençage, cela signifie que la cytosine est méthylée.
IV. Les résultats représentatifs
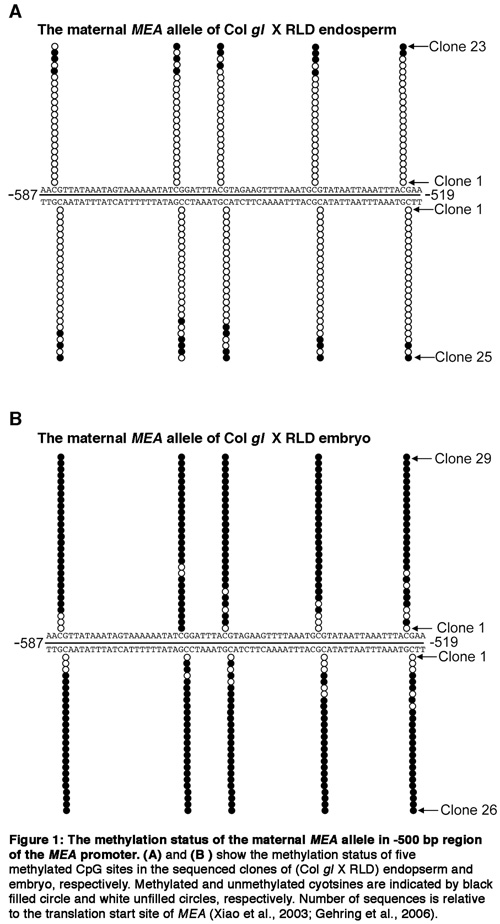 Figure 1.
Figure 1.
Discussion
Il est relativement facile de séparer embryon à partir de l'endosperme et tégument, mais il est fastidieux de séparer l'endosperme du tégument, en particulier pour les semences à un stade précoce ou à mi-torpilles de l'embryogenèse. Depuis tégument ne contribue qu'à une très petite quantité de tissu, pour certains gènes, par exemple, la MEA et FWA, nous n'avons pas de séparer l'endosperme du tégument. Cela signifie que nous pouvons isoler les ARN à partir d'...
Déclarations de divulgation
Remerciements
Les auteurs remercient Mme Jennifer M. Lommel et Tara N. Rognan pour l'entretien des plantes d'Arabidopsis. Ce travail a été soutenu par des fonds de démarrage de Saint Louis University et National Institutes of Health subventions 1R15GM086846-01 et 3R15GM086846-01S1 à W. Xiao.
matériels
Fournitures
- Microscope à dissection
- Ciseaux
- Pince pointe fine
- Tag bijoux
- Enjeux des végétaux
- String ou les attaches
- 4 "X 2" X 8 sacs en polyéthylène "
- 3 "X 1" X 1,0 mm Lames de microscope
- Azote liquide
- Conteneurs d'azote liquide
- Bloc de chaleur
- Tubes PCR
- Thermocycleur
- Microtubes à centrifuger
- Microcentrifugeuse
- Installation électrophorèse sur gel
- Arabidopsis thaliana-0-Britannique Plantes
- Arabidopsis thaliana Landsberg erecta Plantes
Réactifs
- L'éthanol à 70%
- L'éthanol à 95%
- L'éthanol à 100%
- 0,3 M de sorbitol et 5 mM MES pH 5,7
- Bromure de cétyltriméthylammonium (CTAB)
- L'éthanol à 100%
- Cholorform
- Les enzymes de restriction
- 3 M NaOH
- 6,3 M de NaOH
- 6,24 M d'urée / 4 de bisulfite de sodium M
- Distillée stérile H 2 O
- 10 mM d'hydroquinone
- Assistant DNA Clean-Up System (Promega)
- 10 M NH 4 OAc
- 20 pg / uL ARNt
- Tampon TE
- Le kit de clonage TOPO TA (Invitrogen)
Références
- Clark, S. J., Harrison, J., Paul, C. L., Frommer, M. High sensitivity mapping of methylated cytosines. Nucleic Acids Res. 22, 2990-2997 (1994).
- Cokus, S. J., Feng, S., Zhang, X., Chen, Z., Merriman, B., Haudenschild, C. D., Sriharsa Pradhan, S., Nelson, S. F., Pellegrini, M., Jacobsen, S. E. Shotgun bisulphite sequencing of the Arabidopsis genome reveals DNA methylation patterning. Nature. 452, 215-219 (2008).
- Frommer, M., McDonald, L. E., Millar, D. S., Collis, C. M., Watt, F., Grigg, G. W. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proc Natl Acad Sci USA. 89, 1827-1831 (1992).
- Gehring, M., Huh, J. H., Hsieh, T. F., Penterman, J., Choi, Y., Harada, J. J., Goldberg, R. B., Fischer, R. L. D. E. M. E. T. E. R. DNA glycosylase establishes MEDEA polycomb gene self-imprinting by allele-specific demethylation. Cell. 124, 495-506 (2006).
- Henderson, I. R., Chan, S. R., Cao, X., Johnson, L., Jacobsen, S. E. Accurate sodium bisulfite sequencing in plants. Epigenetics. 5, 47-49 (2010).
- Hsieh, T. F., Ibarra, C. A., Silva, P., Zemach, A., Eshed-Williams, L., Fischer, R. L., Zilberman, D. Genome-wide demethylation of Arabidopsis endosperm. Science. 324, 1451-1454 (2009).
- Jacobsen, S. E., Sakai, H., Finnegan, E. J., Cao, X., Meyerowitz, E. M. Ectopic hypermethylation of flower-specific genes in Arabidopsis. Curr. Biol. 10, 179-186 (2000).
- Kinoshita, T., Miura, A., Choi, Y., Kinoshita, Y., Cao, X., Jacobsen, S. E., Fischer, R. L., Kakutani, T. One-way control of FWA imprinting in Arabidopsis endosperm by DNA methylation. Science. 303, 521-523 (2004).
- Lister, R., O'Malley, R. C., Tonti-Filippini, J., Gregory, B. D., Berry, C. C., Millar, A. H., Ecker, J. R. Highly integrated single-base resolution maps of the epigenome in Arabidopsis. Cell. 133, 523-536 (2008).
- Lister, R., Pelizzola, M., Dowen, R. H., Hawkins, R. D., Hon, G., Tonti-Filippini, J., Nery, J. R., Lee, L., Ye, Z., Ngo, Q. -. M. Human DNA methylomes at base resolution show widespread epigenomic differences. Nature. 462, 315-322 (2009).
- Paulin, R., Grigg, G. W., Davey, M. W., Piper, A. A. Urea improves efficiency of bisulfite-mediated sequencing of 5'- methylcytosine in genomic DNA. Nucl. Acids Res. 26, 5009-5010 (1998).
- Rogers, S. O., &, B. e. n. d. i. c. h., J, A. Extraction of DNA from plant tissues. Plant Molecular Biology Manual. A6, 1-10 (1988).
- Smyth, D. R., Bowman, J. L., Elliot, M., Meyerowitz, E. M. Early Flower Development in Arabídopsis. Plant Cell. 2, 755-767 (1990).
- Xiao, W., Gehring, M., Choi, Y., Margossian, L., Pu, H., Harada, J. J., Goldberg, R. B., Pennell, R. I., Fischer, R. L. Imprinting of the MEA Polycomb gene is controlled by antagonism between MET1 methyltransferase and DME glycosylase. Dev. Cell. 5, 891-901 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon