Method Article
La cristalización de proteínas de membrana en mesofases lipídico
En este artículo
Resumen
Los protocolos describen los pasos esenciales para la obtención de cristales de difracción de la calidad de una proteína de membrana a partir de la reconstitución de la proteína en una fase lipídica cúbicos (LCP), la búsqueda de las condiciones iniciales con LCP-FRAP antes de la cristalización de los ensayos, el establecimiento de ensayos LCP cristalización y los cristales de la cosecha .
Resumen
Las proteínas de membrana a cabo funciones críticas en las células vivas relacionadas con la transducción de señales, transporte y transformación de energía, y, como tal, están implicados en una multitud de disfunciones y enfermedades. Sin embargo, una comprensión estructural y funcional de proteínas de la membrana está muy a la zaga de sus socios soluble, principalmente, debido a dificultades relacionadas con su solubilización y la generación de los cristales de la calidad de difracción. La cristalización en mesofases lipídica (también conocida como la cristalización meso o LCP) es una técnica prometedora que se ha aplicado con éxito para obtener estructuras de alta resolución de rodopsinas microbianos, proteínas fotosintéticas, exterior barriles beta y los receptores de membrana acoplados a proteínas G. En meso cristalización se aprovecha de un ambiente de membrana como nativo y, normalmente, produce cristales con menor contenido en disolventes y ordenar mejor en comparación con los tradicionales de cristalización de soluciones detergentes. El método no es difícil, pero requiere una comprensión del comportamiento de los lípidos y la fase de prácticas en el manejo de materiales viscosos mesofase. Aquí se demuestra de una manera sencilla y eficaz de hacer LCP y la reconstitución de una proteína de membrana en la bicapa lipídica de la LCP utilizando un mezclador de jeringa, seguido por dispensar porciones nanolitros de LCP en un ensayo o una placa de cristalización, la realización de ensayos de pre-cristalización y la recolección de los cristales la matriz de LCP. Estos protocolos proporcionan una guía básica para abordar en los ensayos de cristalización meso, sin embargo, como con cualquier experimento de cristalización, la selección y optimización de extensas son necesarias, y el éxito no está garantizado necesariamente.
Protocolo
Un esquema típico de un experimento de cristalización meso se muestra en la Fig. 1 1,2. Cristalización pre-FRAP LCP-ensayos son opcionales, sin embargo, que puede acelerar significativamente el proceso de búsqueda de condiciones de cristalización inicial, especialmente en el caso de las proteínas de la membrana difícil 3.
1. La reconstitución de proteínas en la LCP
- Purificar una proteína de membrana de interés en una solución de detergente y se concentran los complejos de proteínas / detergente a ~ 10 - 20 mg / ml, teniendo cuidado de no sobre-concentrar el 1,4 detergente.
- Transferencia de ~ 25 mg de lípidos LCP anfitrión (por lo general monoolein) o una mezcla de lípidos en un tubo de plástico de 1,5 ml y se incuba a 40 ° C durante unos minutos hasta que los lípidos se derrita.
- Conecte un acoplador de la jeringa para un 100 L hermético jeringa.
- Cargue la jeringa con el lípido fundido utilizando una pipeta de volumen variable. Registrar el volumen de los lípidos en la jeringa.
- Carga otra jeringa 100 L con la solución de proteína en una solución de proteínas a los lípidos proporción 2 / 3 v / v.
- Conecte los dos jeringas juntos a través del acoplador de la jeringa.
- Empuje el émbolo alternativamente jeringa para mover los lípidos y proteínas a través del interior de la aguja del acoplador, de ida y vuelta, hasta que la mesofase lípidos se vuelve homogéneo. LCP se forma espontáneamente en la mezcla mecánica, y la proteína se reconstituye en la bicapa lipídica de la LCP. Formación de LCP puede ser verificado por su consistencia gelatinosa y transparente, y por la ausencia de birrefringencia cuando se observan bajo un microscopio equipado con polarizadores cruzados, o, si es posible, mediante el uso de un pequeño ángulo de difracción de rayos X-1.
2. LCP-FRAP cristalización pre-ensayos
LCP-FRAP ensayos están diseñados para medir las propiedades de difusión de las proteínas de la membrana se reconstituye en LCP en una variedad de condiciones de selección 3. La difusión de largo alcance de las proteínas de membrana de LCP es esencial para la cristalización de éxito, sin embargo, la microestructura de la LCP limita la difusión de proteínas de gran tamaño o de agregados de proteínas oligoméricas. Una razón común para el fracaso de un experimento de cristalización meso es una agregación de proteínas rápida que conduce a una pérdida de difusión. Se ha demostrado que el comportamiento de agregación de una proteína depende de la construcción de proteína en particular, los lípidos de acogida y la composición de la solución de detección 3.
- Etiqueta de la proteína con un tinte fluorescente (Cy3 o similar) en una proporción de proteína / tinte de ~ 100 / 1, quitar el tinte sin reaccionar y concentrar la proteína de ~ 1 mg / ml. Etiqueta, ya sea libre o aminas tioles libres. Cuando el etiquetado aminas libres, use pH entre 7 y 7,5 para la etiqueta predominantemente libres N-terminal. Tenga en cuenta que el etiquetado de amino también pueden etiquetar los lípidos co-purifica con la proteína de 2,3.
- La reconstitución de la proteína marcada en LCP como se describe en la sección 1).
- Configurar placas de ensayo como se describe en la sección 3) utilizando LCP-FRAP soluciones de control en lugar de dos pantallas de la cristalización.
- Las placas se incuban a 20 ° C en la oscuridad durante al menos 12 horas para lograr un estado de equilibrio.
- Coloque uno de los platos en la estación de LCP-FRAP y se centran en el primer pozo con un objetivo de 10x.
- Adquirir 5 imágenes fluorescentes para capturar la primera pre-blanqueado estado.
- Activar el láser. La potencia del láser y el número de impulsos se debe ajustar a la lejía ~ 30 - 70% de la proteína marcada en el centro de la mancha blanqueada.
- Inmediatamente después de la activación del láser, iniciar la grabación de un ayuno posterior a la secuencia de blanqueo ~ 200 imágenes a la mayor velocidad posible.
- Seguir con la grabación de una lenta después de la secuencia de blanqueo ~ 50 imágenes, seleccionar el tiempo entre las imágenes como 1.20 s, en función de la tasa de difusión de la proteína.
- Integrar la intensidad en el interior del lugar de blanqueador en todos los marcos y corregirla para el blanqueo y la luz fluctuaciones de intensidad durante la adquisición de dividir la intensidad en el interior del lugar blanqueado por la intensidad promedio de un punto de referencia fuera del área de láser blanqueada.
- Normalizar la intensidad corregida para que la intensidad de la pre-blanqueado igual a 1 y de la intensidad inicial blanqueada igual a 0.
- Ajustar la curva de la intensidad normalizada en función del tiempo, F (t), utilizando la siguiente ecuación 5:
F (t) = M x exp (-2T / t) x (I 0 (2T / t) + I 1 (2T / t)), (Eq.1)
donde M es la fracción de moléculas que se difunden móvil, T es el tiempo de difusión característico, t es el tiempo real de cada fotograma grabado, I 0 y 1 son los 0 º y 1 º orden modificado las funciones de Bessel. - Calcular el coeficiente de difusión, D, como:
D = R 2 / 4T, (ecuación 2)
donde R es el radio de la mancha blanqueada. - No se muevao bien la siguiente y repita los pasos 2,5) - 2,13).
- Compara las fracciones celulares y los coeficientes de difusión obtenidos para las condiciones de selección diferentes. Cristalización nuevo diseño basado en las pantallas de los componentes que facilitan la difusión de las proteínas y las condiciones de exclusión para que la difusión de las proteínas no se observó. Si la proteína no se difundieron en cualquiera de las condiciones de detección, estudiar la ampliación del espacio de proyección o está tratando de construir una nueva proteína.
3. Configuración de los ensayos de cristalización LCP
- La reconstitución de la proteína en la LCP como se describe en la sección 1).
- La transferencia de la LCP proteína cargada en un 10 l impermeable a los gases jeringa conectada a un dispensador repetitivo jeringa.
- Coloque una aguja corta extraíble (de calibre 26, 10 mm de longitud) a la jeringa l 10.
- Prescindir de 200 bolos nL de LCP en la superficie de cuatro pozos adyacentes que forman un cuadrado de 2x2.
- Superposición de cada uno de los bolos de LCP con una L de solución correspondiente pantalla de cristalización.
- Cap cuatro pozos cargados con un cubreobjetos de 18 mm cuadrados. Aplique una presión suave sobre el cubreobjetos para sellar los pozos.
- Repita los pasos 3,4) -3,6) con el siguiente grupo de 4 pozos hasta que el plato está lleno.
- Incubar la placa a una temperatura constante, la comprobación periódica de la formación y crecimiento de cristales.
4. La cosecha de cristales LCP
- Coloque un plato con cristales de proteínas en un microscopio estéreo con zoom variable, equipado con un polarizador lineal de rotación y el analizador.
- Centrarse en el bien de interés con un zoom de baja potencia para que el bien general se coloca en el campo de visión.
- Puntuación del vidrio cubreobjetos en cuatro golpes haciendo un cuadrado dentro de los límites y con una esquina de una piedra de corte capilar de cerámica.
- De prensa en todo el perímetro anotó con un fuerte fuerte unas pinzas de punta para propagar las rayas a través del espesor del vidrio cubreobjetos.
- Perfore dos agujeros pequeños en las esquinas opuestas de la plaza, anotó.
- L inyectar unos pocos de la solución de precipitación a través de uno de los agujeros para reducir la deshidratación durante las etapas posteriores.
- Utilizando una sonda en ángulo aguja romper el vidrio a lo largo de uno o dos lados para liberar la plaza de desconexión.
- Levante cuidadosamente la observación de cuadrados de vidrio para el bolo de fase cúbica. Si el bolo está atascada en el cubreobjetos, luego voltear el cuadrado de cristal y colóquelo en el fondo del pozo.
- Añadir un extra l de la solución precipitante, complementado con un crio-protector, si es necesario, en la parte superior de la fase de bolo expuestos cúbicos en el pozo.
- Aumentar la ampliación del microscopio y se centran en un cristal.
- Ajustar el ángulo entre el polarizador y el analizador para aumentar el contraste entre el cristal birrefringente y el fondo, mientras se mantiene la luz suficiente para ver el circuito de la cosecha.
- Seleccione un micromontajes MiTeGen con un diámetro que corresponde al tamaño de cristal y el cristal de la cosecha directamente de la LCP por el sacarla a la micromontajes.
- Flash congelar la micromontajes con el cristal cosechado en nitrógeno líquido, y se lo enviaremos a una línea de luz sincrotrón para la fuente de rayos X de recogida de datos 6.
5. Los resultados representativos:
Una ingeniería humana beta 2 adrenérgicos acoplados a proteínas G del receptor (β 2 AR-T4L) se expresó en baculovirus Sf9 infectadas con células de insectos y se purifica en dodecylmaltoside (DDM) / colesterol hemisuccinato (CHS) una solución de detergente unido a un agonista parcial inverso carazolol 7. La proteína fue marcado con Cy3 éster de NHS y utiliza LCP-FRAP cristalización pre-ensayos (Figura 2). Pantallas grueso de cuadrícula basado en varias condiciones seleccionadas de los resultados de la LCP-FRAP ensayos producidos inicial cristal-como golpes (Figura 3). Una mayor optimización de las condiciones de precipitación de cristales de difracción producido de la calidad (Figura 4).
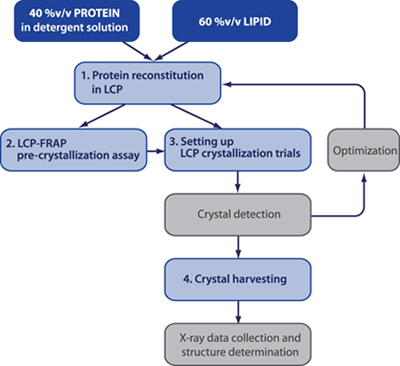
Figura 1. Diagrama de flujo de un experimento de cristalización LCP típico. Medidas en los cuadros de color gris no están descritas en los protocolos actuales.
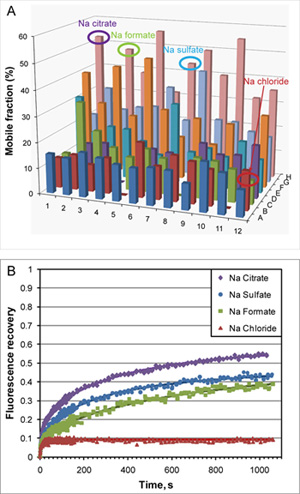
Figura 2. LCP-FRAP ensayo con β 2 AR-T4L/carazolol en LCP monoolein base. A) Los resultados de un ensayo de LCP-FRAP realiza en un sistema automático de alto rendimiento el modo en el que cada muestra de una placa de 96 pocillos se blanquea de forma secuencial y la recuperación de la fluorescencia se mide después de una incubación de 30 minutos. Las recuperaciones obtenidas de fluorescencia, que representan la fracción de móviles en cada muestra, se trazan para todos 96 muestras. Las soluciones de detección contienen 0,1 M Tris pH 8, 30% v / v de PEG 400 en combinación con 48 diferentes sales en dos concentraciones diferentes. B) los perfiles de fluorescencia de recuperación de representante de variostante condiciones. Curvas sólidas representan la línea se ajusta a la ecuación. 1.El fracciones celulares y los coeficientes de difusión se determinan mediante las ecuaciones. 1 y 2. Rápida recuperación de menos del 10% de la muestra que contiene cloruro de sodio se debe a los lípidos marcados con fluorescencia co-purifica con la proteína.
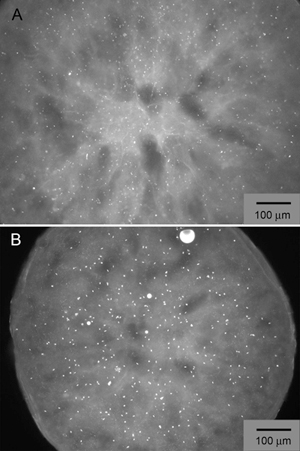
Figura 3. Éxitos iniciales de cristal de β 2 AR-T4L/carazolol obtenidos por un examen de la malla gruesa alrededor de las condiciones más prometedoras identificadas por LCP-FRAP, que contiene sulfato de sodio (panel A) y Na formiato (panel B). La proteína está marcado con Cy3 éster de NHS y las imágenes fluorescentes son tomadas con excitación a 543 nm y emisión a 605 nm.
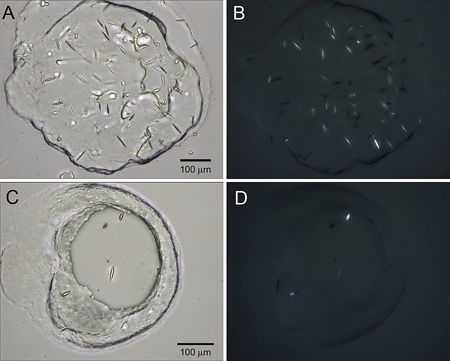
Figura 4. Optimizado cristales de β 2 AR-T4L/carazolol. Las imágenes de los cristales cultivados en presencia de sulfato de sodio (grupos A y B) y K-formato (paneles C y D) se toman en el modo de campo claro (grupos A y C) y el uso de polarizadores cruzados (los grupos B y D).
Discusión
Los protocolos proporcionan una guía visual básica de los pasos principales involucrados en la realización de experimentos de cristalización meso. Más en profundidad los detalles relacionados con estos protocolos, con énfasis en las posibles dificultades, las deficiencias o las rutas alternativas están disponibles en otros lugares 1,2. Opcional FRAP LCP-ensayos pueden ayudar en las primeras etapas para seleccionar la construcción de las proteínas más prometedores, lípidos LCP de acogida y los aditivos de lípidos, así como limitar el rango de posibles factores desencadenantes y las condiciones de tampón 3. Una vez que un golpe de cristalización inicial se encuentra, debe ser optimizado para obtener una mejor calidad de los cristales. Optimización de las condiciones de cristalización meso es esencialmente similar a la optimización de las condiciones de las proteínas solubles con la adición de parámetros adicionales asociados con la composición de la LCP 1. Cristales de proteína de la membrana lipídica crecido en mesofase suelen ser de menor tamaño que los cristales obtenidos en solución de detergente, pero más ordenado, por lo tanto, se benefician fuertemente el uso de líneas de luz disponible en microfocus modernas fuentes de radiación sincrotrón 6.
Muchos de los procedimientos relacionados con la cristalización meso, incluyendo la creación de placas de cristalización o ensayo, la realización de ensayos de LCP-FRAP y la detección de cristales, han sido semi-o completamente automático 1,2,8,9, lo que permite la proyección de un amplio rango de condiciones mientras que el consumo de pequeñas cantidades de proteínas y lípidos. Por otro lado, reconstituciones de proteínas en LCP y la cosecha de cristal permanecen las operaciones manuales y más tedioso y, por tanto, tienen una necesidad de mejora.
Divulgaciones
Agradecimientos
Este trabajo fue financiado en parte por las subvenciones del NIH GM073197 y RR025336.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 μL gas-tight syringe | Hamilton Co | 7656-01 | 2 syringes are required |
| 10 μL gas-tight syringe | Hamilton Co | 7653-01 | |
| Syringe coupler | Hamilton Co | 7770-02 30902 | The coupler can be made using available parts as described in refs. 10 |
| Repetitive syringe dispenser | Hamilton Co | 83700 | The repetitive syringe dispenser can be modified to reduce dispensing volume by ~3 times11 |
| Short (0.375”) flat-tipped removable needle (point style 3, gauge 26) | Hamilton Co | 7804-03 | |
| 96-well glass sandwich plate | Marienfeld | 08 900 03 | For manual operations it is more convenient to assemble the glass sandwich plate using a standard microscope glass slides and a double sticky tape with punched holes1,2,12. |
| Glass cover slip | Electron Microscopy Sciences | 63787-01 | |
| monoolein | Sigma-Aldrich | M7765 | |
| Crystallization screens | Hampton Research, Molecular Dimensions, Emerald Biosystems, Jena Bioscience | Most of available commercial screens can be used for initial screening. Conditions that consistently disrupt LCP can be diluted 2x for better compatibility13. | |
| Capillary cutting stone | Hampton Research | HR4-334 | |
| Fine point tweezers | Ted Pella, Inc. | 510 | |
| Angled sharp probe | Ted Pella, Inc. | 13650 | |
| MicroMounts | MiTeGen | M1-Lxx-xx | Select MicroMount diameter to match the crystal size |
Referencias
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat. Protoc. 4, 706-731 (2009).
- Cherezov, V., Abola, E., Stevens, R. C. Recent progress in the structure determination of GPCRs, a membrane protein family with high potential as pharmaceutical targets. Methods Mol. Biol. 654, 141-170 (2010).
- Cherezov, V., Liu, J., Hanson, M. A., Griffith, M. T., Stevens, R. C. LCP-FRAP assay for pre-screening membrane proteins for in meso crystallization. J. Cryst. Growth Design. 8, 4307-4315 (2008).
- Misquitta, Y., Caffrey, M. Detergents destabilize the cubic phase of monoolein: implications for membrane protein crystallization. Biophys. J. 79, 394-405 (2003).
- Soumpasis, D. M. Theoretical analysis of fluorescence photobleaching recovery experiments. Biophys. J. 41, 95-97 (1983).
- Cherezov, V., Hanson, M. A., Griffith, M. T., Hilgart, M. C., Sanishvili, R., Nagarajan, V., Stepanov, S., Fischetti, R. F., Kuhn, P., Stevens, R. C. Rastering strategy for screening and centering of microcrystal samples of human membrane proteins with a sub-10 micrometer size X-ray synchrotron beam. J. R. Soc. Interface. 6, S587-S597 (2009).
- Cherezov, V., Rosenbaum, D. M., Hanson, M. A., Rasmussen, S. G., Thian, F. S., Kobilka, T. S., Choi, H. J., Kuhn, P., Weis, W. I., Kobilka, B. K., Stevens, R. C. High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science. 318, 1258-1265 (2007).
- Cherezov, V., Peddi, A., Muthusubramaniam, L., Zheng, Y. F., Caffrey, M. A robotic system for crystallizing membrane and soluble proteins in lipidic mesophases. Acta Crystallogr. D. 60, 1795-1807 (2004).
- Kissick, D. J., Gualtieri, E. J., Simpson, G. J., Cherezov, V. Nonlinear optical imaging of integral membrane protein crystals in lipidic mesophases. Anal. Chem. 82, 491-497 (2010).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Cherezov, V., Caffrey, M. A simple and inexpensive nanoliter-volume dispenser for highly viscous materials used in membrane protein crystallization. J. Appl. Cryst. 38, 398-400 (2005).
- Cherezov, V., Caffrey, M. Nano-volume plates with excellent optical properties for fast, inexpensive crystallization screening of membrane proteins. J. Appl. Cryst. 36, 1372-1377 (2003).
- Cherezov, V., Fersi, H., Caffrey, M. Crystallization screens: compatibility with the lipidic cubic phase for in meso crystallization of membrane proteins. Biophys J. 81, 225-242 (2001).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados