Method Article
Cristallizzazione delle proteine di membrana lipidica in Mesophases
In questo articolo
Riepilogo
I protocolli di descrivere le fasi essenziali per ottenere cristalli di diffrazione qualità di una proteina di membrana a partire dalla ricostituzione della proteina in una fase lipidica cubi (LCP), trovando condizioni iniziali con LCP-FRAP pre-cristallizzazione analisi, la creazione di processi di cristallizzazione LCP e cristalli di raccolta .
Abstract
Proteine di membrana svolgono funzioni fondamentali nelle cellule viventi relativi alla trasduzione del segnale, il trasporto e trasformazioni di energia, e, come tali, sono coinvolti in una moltitudine di disfunzioni e malattie. Tuttavia, una comprensione strutturale e funzionale delle proteine di membrana è fortemente arretrato rispetto a quello dei loro partner solubile, soprattutto, a causa delle difficoltà legate alla loro solubilizzazione e la generazione di cristalli di qualità diffrazione. Cristallizzazione in mesophases lipidico (noto anche come cristallizzazione meso o LCP) è una tecnica promettente che è stato applicato con successo per ottenere strutture ad alta risoluzione di rhodopsins microbica, proteine fotosintetiche, botti beta della membrana esterna e G recettori accoppiati alla proteina. In meso cristallizzazione si avvale di un nativo ambiente simile a membrana e produce tipicamente cristalli con basso contenuto di solventi e meglio ordinare rispetto ai tradizionali cristallizzazione da soluzioni detergenti. Il metodo non è difficile, ma richiede una comprensione del comportamento dei lipidi fase e pratiche nel trattamento dei materiali mesofase viscosi. Qui mostriamo un modo semplice ed efficiente di fare LCP e la ricostituzione di una proteina di membrana nel doppio strato lipidico di LCP utilizzando un mixer siringa, seguita dalla distribuzione di porzioni nanoliter LCP in un saggio o un piatto di cristallizzazione, conducendo i test pre-cristallizzazione e la raccolta di cristalli l'LCP matrice. Questi protocolli di fornire una guida di base per accostarsi a prove di cristallizzazione meso, tuttavia, come per qualsiasi esperimento di cristallizzazione, lo screening esteso e ottimizzazione sono necessarie, e un risultato positivo non è necessariamente garantita.
Protocollo
Un profilo tipico di un esperimento di cristallizzazione meso è mostrato in Fig.1 1,2. Pre-cristallizzazione LCP-FRAP saggi sono opzionali, tuttavia, possono notevolmente accelerare il processo di ricerca di condizioni di cristallizzazione iniziali, soprattutto nel caso delle proteine di membrana difficile 3.
1. La ricostituzione delle proteine in LCP
- Purificare una proteina di membrana di interesse in una soluzione detergente e concentrare la proteina / detergente complessi di ~ 10 - 20 mg / mL, facendo attenzione a non concentrare troppo il 1,4 detergente.
- Trasferimento ~ 25 mg di lipidi ospitare LCP (tipicamente monoolein) o una miscela dei lipidi in un tubo di 1,5 ml di plastica e incubare a 40 ° C per qualche minuto fino a quando la lipidica si scioglie.
- Collegare un accoppiatore siringa ad un 100 microlitri a tenuta di gas siringa.
- Caricare la siringa con la lipidico fuso con una pipetta del volume regolabile. Registrare il volume del lipidi nella siringa.
- Carico di altri 100 microlitri siringa con la soluzione proteica in un rapporto proteina soluzione-to-lipidico 2 / 3 v / v.
- Collegare i due siringhe insieme attraverso l'accoppiatore siringa.
- Spingere la siringa tuffatori alternativamente per spostare il lipidi e proteine attraverso l'ago interna del giunto, avanti e indietro, fino a quando la mesofase lipidi diventa omogenea. LCP si forma spontaneamente sulla miscelazione meccanica, e la proteina viene ricostituita nel doppio strato lipidico del LCP. Formazione di LCP può essere verificata dalla sua coerenza trasparente e gelatinosa e per l'assenza di birefringency se visto sotto un microscopio dotato di cross-polarizzatori, o, se possibile, utilizzando piccole angolo diffrazione di raggi X 1.
2. LCP-FRAP pre-cristallizzazione saggi
LCP-FRAP test sono progettati per misurare le proprietà di diffusione delle proteine di membrana ricostituite in LCP a una varietà di condizioni di screening 3. Il lungo raggio diffusione delle proteine di membrana in LCP è essenziale per la cristallizzazione di successo, tuttavia, la microstruttura di LCP vincola la diffusione delle proteine di grandi dimensioni o aggregati di proteine oligomeriche. Un motivo comune per il fallimento di un esperimento di cristallizzazione meso è una aggregazione proteica veloce che porta ad una perdita di diffusione. E 'stato dimostrato che il comportamento di aggregazione di una proteina dipende dalla costruzione particolare proteina, i lipidi di accoglienza e la composizione della soluzione di screening 3.
- Etichetta la proteina con un colorante fluorescente (Cy3 o simili) con un rapporto proteine / colorante di circa 100 / 1, rimuovere il colorante che non ha reagito e concentrare la proteina a ~ 1 mg / mL. Etichetta sia ammine libero o tioli liberi. Quando l'etichettatura ammine libero, l'uso pH tra 7 e 7,5 per etichettare prevalentemente la libera N-terminale. Essere consapevoli del fatto che l'etichettatura aminoacidi possono anche etichetta lipidi co-purificato con la proteina 2,3.
- Ricostituire la proteina etichettato in LCP, come descritto nella sezione 1).
- Istituito piatti test come descritto nella sezione 3) utilizzando LCP-FRAP soluzioni di screening, invece di schermi cristallizzazione 2.
- Incubare le piastre a 20 ° C al buio per almeno 12 ore per raggiungere uno stato di equilibrio.
- Mettere una delle piastre sul LCP-FRAP stazione e concentrarsi sul primo pozzo utilizzando un obiettivo 10x.
- Acquisire 5 immagini a fluorescenza per catturare l'iniziale stato di pre-sbiancato.
- Innescare il laser. La potenza del laser e il numero di impulsi deve essere regolato a candeggina ~ 30 - 70% delle proteine etichettate nel mezzo della macchia sbiancato.
- Immediatamente dopo l'attivazione del laser, iniziare a registrare un rapido post-candeggio sequenza di circa 200 immagini al tasso più veloce possibile.
- Seguite con la registrazione di un lento post-candeggina sequenza di ~ 50 immagini, scegliendo il ritardo tra le immagini di 1-20 s, a seconda della velocità di diffusione della proteina.
- Integrare l'intensità all'interno della macchia di candeggina in tutti i fotogrammi e correggere per il candeggio e fluttuazioni di intensità della luce durante l'acquisizione dividendo l'intensità all'interno della macchia sbiancato con l'intensità media di un punto di riferimento al di fuori della zona di laser sbiancato.
- Normalizzare l'intensità corretta per effettuare la pre-sbiancato intensità uguale a 1 e l'intensità iniziale sbiancato uguale a 0.
- Montare la curva della intensità normalizzata in funzione del tempo, F (t), utilizzando la seguente equazione 5:
F (t) = M x exp (-2T / t) x (I 0 (2T / t) + I 1 (2T / t)), (Eq.1)
dove M è la frazione mobile di molecole che diffondono, T è il tempo di diffusione caratteristica, t è il tempo reale di ogni fotogramma registrato, I 0 e I 1 sono lo 0 ° e 1 ° ordine modificate funzioni di Bessel. - Calcolare il coefficiente di diffusione, D, come:
D = R 2 / 4T, (Eq.2)
dove R è il raggio dello spot sbiancato. - Spostare to il pozzo successivo e ripetere i punti 2,5) - 2.13).
- Confrontare le frazioni cellulari e coefficienti di diffusione ottenuti per le diverse condizioni di screening. Cristallizzazione nuovo design schermi in base ai componenti che hanno facilitato la diffusione delle proteine e le condizioni di esclusione per i quali la diffusione delle proteine non è stata osservata. Se la proteina non ha diffuso in alcuna delle condizioni di screening, cercare di estendere lo spazio di screening o cercare una nuova proteina costrutto.
3. Impostazione Prove di cristallizzazione LCP
- Ricostituire la proteina in LCP, come descritto nella sezione 1).
- Trasferire il carico di proteine LCP in un 10 microlitri a tenuta di gas siringa collegata ad un erogatore siringa ripetitivo.
- Inserire un ago corto rimovibile (calibro 26, 10 mm di lunghezza) alla siringa 10 L.
- Dispensare 200 boli nL del LCP sulla superficie di quattro pozzi adiacenti che formano un quadrato 2x2.
- Sovrapposizione ciascuno dei boli LCP con 1 ml di soluzione corrispondente schermo cristallizzazione.
- Cap quattro pozzi caricato con un coprioggetto 18 mm di vetro quadrati. Applicare una leggera pressione sul vetrino per sigillare i pozzi.
- Ripetere i passaggi 3.4) -3,6), con la prossima serie di 4 pozzi fino a quando il piatto è pieno.
- Incubare la piastra a temperatura costante, controllando periodicamente per la formazione di cristalli e di crescita.
4. La raccolta Cristalli da LCP
- Posizionare un piatto con cristalli proteici al microscopio stereo con zoom variabile, dotato di un polarizzatore lineare di rotazione e analizzatore.
- Concentrarsi sul pozzo di interesse utilizzando uno zoom a bassa potenza in modo che il tutto è ben posizionato all'interno del campo visivo.
- Punteggio ottenuto il vetro coprioggetto in quattro colpi facendo un quadrato all'interno dei confini bene con un angolo acuto di una pietra da taglio in ceramica capillare.
- Stampa in tutto il perimetro segnato con una forte forte punto di pinzette per propagare i graffi attraverso lo spessore del vetro coprioggetto.
- Punch due piccoli fori agli angoli opposti della piazza segnato.
- Iniettare pochi microlitri di soluzione precipitante attraverso uno dei fori per ridurre la disidratazione durante le fasi successive.
- Utilizzando una sonda angolata ago appuntito rompere il vetro lungo uno o due lati per liberare il cut-out quadrati.
- Sollevare delicatamente il quadrato di vetro per guardare il bolo fase cubi. Se il bolo è bloccato al coprioggetti, poi capovolgere il quadrato di vetro sopra e posto sul fondo del pozzo.
- Aggiungi un ulteriore pochi microlitri di soluzione precipitante, integrato con un crio-protettore, se necessario, sulla parte superiore del bolo esposti fase cubi nel pozzo.
- Aumentare l'ingrandimento del microscopio e concentrarsi su un cristallo.
- Regolare l'angolo tra il polarizzatore e l'analizzatore per aumentare il contrasto tra il cristallo birifrangente e lo sfondo, mantenendo abbastanza luce per vedere il ciclo di raccolta.
- Selezionare un micromount MiTeGen con un diametro corrispondente al formato di cristallo e poi raccogliere il cristallo direttamente dal LCP scavando in la micromount.
- Flash congelare il micromount con i cristalli raccolti in azoto liquido, e la nave ad una linea di luce di sincrotrone per la fonte di raggi X raccolta di dati 6.
5. Rappresentante dei risultati:
Un progettato umano beta 2 adrenergici G protein-coupled receptor (β 2 AR-T4L) è stato espresso in baculovirus infette SF9 cellule di insetto e purificata in dodecylmaltoside (DDM) / colesterolo emisuccinato (CHS) una soluzione detergente associato a un agonista parziale inversa carazololo 7. La proteina è stato marcato con Cy3 estere NHS e utilizzato in LCP-FRAP pre-cristallizzazione test (Figura 2). Schermi griglia grossolana sulla base di diverse condizioni selezionate dai risultati di LCP-FRAP saggi prodotto iniziale di cristallo come colpi (Figura 3). Ulteriore ottimizzazione delle condizioni precipitanti ceduto cristalli di qualità diffrazione (Figura 4).
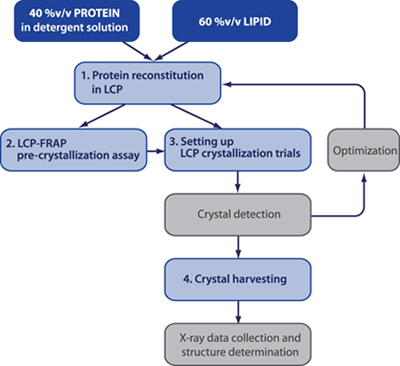
Figura 1. Flow-chart di un tipico esperimento di cristallizzazione LCP. Passi nel box grigio non sono descritte nella attuali protocolli.
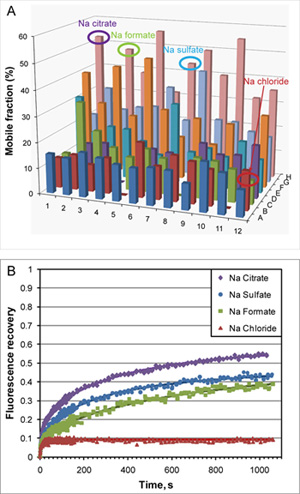
Figura 2. LCP-FRAP test con β 2 AR-T4L/carazolol in LCP monoolein base. A) i risultati di un LCP-FRAP test eseguiti in automatico la modalità high-throughput, in cui ogni campione di una piastra a 96 pozzetti è sbiancato in sequenza e il recupero fluorescenza viene misurata dopo una incubazione di 30 min. I recuperi ottenuti fluorescenza, che rappresentano la frazione mobile in ogni campione, sono tracciati per tutti i 96 campioni. Le soluzioni di screening contengono 0,1 M Tris pH 8, 30% v / v PEG 400 in combinazione con 48 diversi sali a due differenti concentrazioni. B) profili di fluorescenza di recupero per alcuni repcondizioni rappresentativi. Curve linea continua rappresenta adatta da Eq. 1.L frazioni mobile e coefficienti di diffusione sono determinati utilizzando equazioni. 1 e 2. Recupero veloce di meno del 10% del campione contenente cloruro di sodio è dovuto al lipidi fluorescente co-purificato con la proteina.
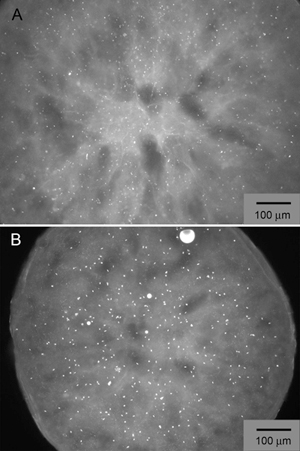
Figura 3. Colpi di cristallo iniziale di β 2 AR-T4L/carazolol ottenuto dalla proiezione griglia grossolana attorno condizioni più promettenti identificati da LCP-FRAP, contenenti Na solfato (pannello A) e Na formiato (pannello B). La proteina è marcato con Cy3 estere NHS e le immagini fluorescenti sono scattate con eccitazione a 543 nm ed emissione a 605 nm.
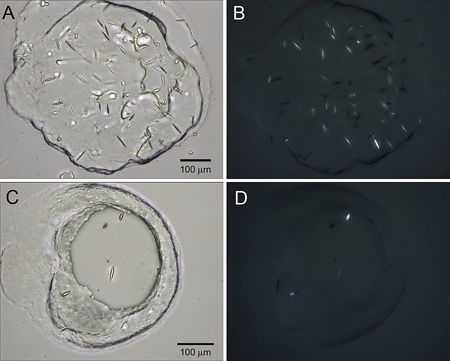
Figura 4. Cristalli ottimizzata di β 2 AR-T4L/carazolol. Le immagini dei cristalli cresciuti in presenza di solfato di Na (pannelli A e B) e K formiato (pannelli C e D) sono presi in modalità campo chiaro (pannelli A e C) e l'utilizzo di polarizzatori incrociati (pannelli B e D).
Discussione
I protocolli di fornire una guida di base visivo per le tappe principali coinvolti nello svolgimento di esperimenti di cristallizzazione meso. Più approfondito i dettagli relativi a questi protocolli, sottolineando possibili insidie, carenze o percorsi alternativi sono disponibili altrove 1,2. Opzionale LCP-FRAP test può aiutare nelle fasi precedenti per selezionare il costrutto proteina più promettenti, lipidi ospitare LCP e additivi lipidico, così come limitare la gamma di possibili fattori precipitanti e le condizioni di buffer 3. Una volta che un colpo di cristallizzazione iniziale si trova, dovrebbe essere ottimizzato per ottenere cristalli di migliore qualità. Ottimizzazione delle condizioni di cristallizzazione in meso è essenzialmente simile a ottimizzare le condizioni per le proteine solubili con l'aggiunta di parametri aggiuntivi associati con la composizione del LCP 1. Cristalli di proteina di membrana coltivate in mesofase lipidico sono generalmente di dimensioni inferiori rispetto cristalli ottenuti in soluzione detergente, ma più ordinato, quindi, beneficiando fortemente usare i microfocus linee di luce disponibile al moderne sorgenti di sincrotrone 6.
Molte delle procedure relative alla cristallizzazione in meso, compresa la creazione di piatti cristallizzazione o saggio, conducendo LCP-FRAP test e rilevazione cristalli, sono state parzialmente o completamente automatizzati 1,2,8,9, che consente lo screening di una vasta gamma di condizioni consumando piccole quantità di proteine e lipidi. D'altra parte, ricostruzioni proteina in LCP e la raccolta di cristallo rimangono le operazioni manuali e più noioso e, quindi, hanno bisogno di miglioramento.
Divulgazioni
Riconoscimenti
Questo lavoro è stato finanziato in parte dal NIH GM073197 e RR025336.
Materiali
| Name | Company | Catalog Number | Comments |
| 100 μL gas-tight syringe | Hamilton Co | 7656-01 | 2 syringes are required |
| 10 μL gas-tight syringe | Hamilton Co | 7653-01 | |
| Syringe coupler | Hamilton Co | 7770-02 30902 | The coupler can be made using available parts as described in refs. 10 |
| Repetitive syringe dispenser | Hamilton Co | 83700 | The repetitive syringe dispenser can be modified to reduce dispensing volume by ~3 times11 |
| Short (0.375”) flat-tipped removable needle (point style 3, gauge 26) | Hamilton Co | 7804-03 | |
| 96-well glass sandwich plate | Marienfeld | 08 900 03 | For manual operations it is more convenient to assemble the glass sandwich plate using a standard microscope glass slides and a double sticky tape with punched holes1,2,12. |
| Glass cover slip | Electron Microscopy Sciences | 63787-01 | |
| monoolein | Sigma-Aldrich | M7765 | |
| Crystallization screens | Hampton Research, Molecular Dimensions, Emerald Biosystems, Jena Bioscience | Most of available commercial screens can be used for initial screening. Conditions that consistently disrupt LCP can be diluted 2x for better compatibility13. | |
| Capillary cutting stone | Hampton Research | HR4-334 | |
| Fine point tweezers | Ted Pella, Inc. | 510 | |
| Angled sharp probe | Ted Pella, Inc. | 13650 | |
| MicroMounts | MiTeGen | M1-Lxx-xx | Select MicroMount diameter to match the crystal size |
Riferimenti
- Caffrey, M., Cherezov, V. Crystallizing membrane proteins using lipidic mesophases. Nat. Protoc. 4, 706-731 (2009).
- Cherezov, V., Abola, E., Stevens, R. C. Recent progress in the structure determination of GPCRs, a membrane protein family with high potential as pharmaceutical targets. Methods Mol. Biol. 654, 141-170 (2010).
- Cherezov, V., Liu, J., Hanson, M. A., Griffith, M. T., Stevens, R. C. LCP-FRAP assay for pre-screening membrane proteins for in meso crystallization. J. Cryst. Growth Design. 8, 4307-4315 (2008).
- Misquitta, Y., Caffrey, M. Detergents destabilize the cubic phase of monoolein: implications for membrane protein crystallization. Biophys. J. 79, 394-405 (2003).
- Soumpasis, D. M. Theoretical analysis of fluorescence photobleaching recovery experiments. Biophys. J. 41, 95-97 (1983).
- Cherezov, V., Hanson, M. A., Griffith, M. T., Hilgart, M. C., Sanishvili, R., Nagarajan, V., Stepanov, S., Fischetti, R. F., Kuhn, P., Stevens, R. C. Rastering strategy for screening and centering of microcrystal samples of human membrane proteins with a sub-10 micrometer size X-ray synchrotron beam. J. R. Soc. Interface. 6, S587-S597 (2009).
- Cherezov, V., Rosenbaum, D. M., Hanson, M. A., Rasmussen, S. G., Thian, F. S., Kobilka, T. S., Choi, H. J., Kuhn, P., Weis, W. I., Kobilka, B. K., Stevens, R. C. High-resolution crystal structure of an engineered human beta2-adrenergic G protein-coupled receptor. Science. 318, 1258-1265 (2007).
- Cherezov, V., Peddi, A., Muthusubramaniam, L., Zheng, Y. F., Caffrey, M. A robotic system for crystallizing membrane and soluble proteins in lipidic mesophases. Acta Crystallogr. D. 60, 1795-1807 (2004).
- Kissick, D. J., Gualtieri, E. J., Simpson, G. J., Cherezov, V. Nonlinear optical imaging of integral membrane protein crystals in lipidic mesophases. Anal. Chem. 82, 491-497 (2010).
- Cheng, A., Hummel, B., Qiu, H., Caffrey, M. A simple mechanical mixer for small viscous lipid-containing samples. Chem. Phys. Lipids. 95, 11-21 (1998).
- Cherezov, V., Caffrey, M. A simple and inexpensive nanoliter-volume dispenser for highly viscous materials used in membrane protein crystallization. J. Appl. Cryst. 38, 398-400 (2005).
- Cherezov, V., Caffrey, M. Nano-volume plates with excellent optical properties for fast, inexpensive crystallization screening of membrane proteins. J. Appl. Cryst. 36, 1372-1377 (2003).
- Cherezov, V., Fersi, H., Caffrey, M. Crystallization screens: compatibility with the lipidic cubic phase for in meso crystallization of membrane proteins. Biophys J. 81, 225-242 (2001).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon