Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La disección y la tinción de Drosophila Larvas Ovarios
En este artículo
Resumen
¿Cómo los nichos y las células madre se forman durante el desarrollo es una cuestión importante con implicaciones prácticas. En el Drosophila, el germen de las células madre de línea y sus nichos somáticos se forman durante el desarrollo larvario. Este video muestra la forma de analizar, las manchas y montaje de las gónadas femeninas a partir de finales del tercer estadio (LL3) Drosophila Larvas.
Resumen
Muchos órganos dependen de las células madre para su desarrollo durante la embriogénesis y para el mantenimiento o la reparación durante la vida adulta. La comprensión de cómo las células madre forman, y cómo interactúan con su medio ambiente es crucial para comprender el desarrollo, la homeostasis y las enfermedades. El ovario de la mosca de la fruta Drosophila melanogaster, ha servido como un influyente modelo para la interacción de las células germinales madre de línea (GSCS) con sus células de apoyo somáticas (nicho) 1, 2. La ubicación conocida del lugar y la GSCS, junto a la capacidad de manipularlos genéticamente, ha permitido a los investigadores para esclarecer una serie de interacciones entre las células madre y sus nichos 3-12.
A pesar de la gran cantidad de información sobre los mecanismos de control de mantenimiento de la SGC y la diferenciación, se sabe relativamente poco sobre cómo GSCS y sus nichos de forma somática durante el desarrollo. Alrededor de 18 nichos somáticas, cuyos componentes celulares son filamentos de terminales y las células de la tapa (Figura 1), se forman durante el tercer estadio larval 13-17. GSCS originan de las células germinales primordiales (PGC). PGCs proliferan en las primeras etapas larvales, pero tras la formación del nicho de un subgrupo de PGCs se GSCS 7, 16, 18, 19. En conjunto, las células somáticas de nicho y la GSCS hacer una unidad funcional que produce óvulos durante la vida del organismo.
Muchas preguntas sobre la formación de la unidad de GSC permanecen sin respuesta. Procesos tales como la coordinación entre las células precursoras de los nichos y los precursores de células madre, o la generación de la asimetría en PGCs a medida que se GSCS, mejor se pueden estudiar en la larva. Sin embargo, un estudio metódico de desarrollo del ovario larval es un reto físico. En primer lugar, los ovarios de las larvas son pequeñas. Incluso a finales de estadios larvarios son sólo 100μm de diámetro. Además, los ovarios son transparentes y están integrados en un cuerpo de grasa blanca. Aquí se describe un protocolo de paso a paso para el aislamiento de los ovarios de finales del tercer estadio (LL3) larvas de Drosophila, seguido de tinción con anticuerpos fluorescentes. Ofrecemos algunas soluciones técnicas a problemas como la localización de los ovarios, las manchas y el lavado de tejidos que no se hunden, y asegurarse de que los anticuerpos de penetrar en el tejido. Este protocolo se puede aplicar a las primeras etapas de larvas y larvas en los testículos también.
Protocolo
1. La puesta de huevos
- Cinco días antes de la disección: permitir que las hembras apareadas para poner sus huevos durante 2-4 horas en los alimentos frescos complementado con la levadura. Para obtener larvas sincronizados y bien desarrollado, es importante no tener hacinamiento de cultivo (alrededor de 30 huevos / frasco de 25 mm). Por lo general, las mujeres se utilizan 7.16 por frasco, dependiendo de lo bien que estaba.
2. Selección de las larvas
- Prepare un plato de cristal de 9 y disección llena con un medio de Ringer (NaCl 128 mm, 2 mm KCl, CaCl2 1,8 mm, 4 mm de MgCl 2, 35.5mm de sacarosa, pH 5 mM Hepes 6,9).
- Preparar filtros de células en una placa de seis pozos que contenían medio de Ringer y colocarlo sobre hielo. Por otra parte, se utilizan moldes hechos especialmente equipado con una malla de nylon.
- Recoger las larvas de tiempo de las paredes del vial utilizando unas pinzas finas biológica (fórceps) y colóquelos en un plato que contiene la disección de la solución de Ringer.
- Transferencia de una larva femenina a un pozo limpio. Se distinguen las hembras de los machos por las gónadas. Testículos masculinos son fácilmente identificables como grandes óvalos claros integrados en el tercio posterior de la grasa corporal. Ovarios femeninos, que se encuentra en la misma parte de la grasa corporal, se puede identificar como una mucho más pequeña, esferas claro, todo el año.
3. La disección de las larvas
- Mantenga la larva hasta justo por detrás del cerebro con las pinzas y retire la cabeza con un segundo par de pinzas.
- Coloque la parte posterior restante en la parte dorsal, con la tráquea hacia abajo.
- Mantenga la larva de los espiráculos posteriores con un par de pinzas y presionar hacia adentro lentamente mientras que el otro se desliza por detrás de la cutícula hasta la mitad de las larvas de grasa corporal emerge.
- Sostenga firmemente el extremo posterior y utilizar el otro par de pinzas para sostener holgadamente la cutícula. Suave y lentamente alejarse del extremo posterior, para que la cutícula y la diapositiva adjunta intestino a través del hueco. Al final de este proceso, la grasa corporal deberá estar completamente separada del intestino y la cutícula. Desconecte el intestino de la parte anterior de la grasa corporal. Para realizar la tinción y el montaje más fácil, es importante que la grasa corporal se mantendrá intacto.
- Moje una pipeta de pastos a fondo con medio de Ringer, preferiblemente de un pozo que contiene larvas disecadas. Esto ayuda a cubrir la pipeta y se evita que la grasa corporal se adhieran a ella. Use la pipeta para transferir los pastos de la grasa corporal en el medio Ringer fría en el filtro de la célula.
4. Fijación y tinción
Todos los pasos se llevan a cabo a temperatura ambiente, a excepción de la incubación con el anticuerpo en primer lugar, a 4 ° C.
- Incubar la grasa corporal en un 5% de formaldehído en medio de Ringer. durante 20 minutos con agitación suave.
- Lavar durante 5 minutos con un 1% PBT (1% Triton X-100 en PBS). Repita este paso durante 10 minutos y una tercera vez durante 45 minutos. 1% de Triton X-100 se requiere para perforar el ovario larval y permitir que los anticuerpos para penetrar en él.
- Bloque con el 0,3% PBTB (0,3% Triton X-100 y el 1% de BSA en PBS) durante 1 hora con agitación suave
- Incubar con el anticuerpo deseado º 1 diluido en el 0,3% PBTB durante la noche a 4 ° C con agitación suave. Este paso se realiza generalmente en tubos de 0,2 ml en un rodillo.
- Transferencia de grasa en el cuerpo de vuelta a los tamices de la célula.
- Lavar 3 veces, 30 minutos cada uno, con un 0,3% PBTB con agitación suave.
- Bloque con el 0,3% PBTB suplementado con 5% de suero normal de burro durante 1 hora con agitación suave.
- Se incuba con un anticuerpo secundario diluido apropiado (de acuerdo a las especificaciones del fabricante) en la solución de bloqueo (0,3% PBTB complementado con suero de burro 5% de lo normal en el 0,3% PBT) durante 2 horas con agitación suave. Si el anticuerpo es fluorescente, se incuban en la oscuridad, a partir de este punto. Este paso se realiza generalmente en tubos de 0,2 ml en un rodillo.
- Lavar 3 veces durante 30 minutos cada uno con 0,3% de PBT con una suave agitación.
5. Montaje
- La transferencia de la grasa corporal a un tubo eppendorf limpio. Con mucho cuidado, eliminar todos los líquidos lejos y cubrir inmediatamente con los medios de comunicación Vectashield montaje. Usamos Vectashield rutinariamente, ya que no se endurece, mientras que los ovarios están siendo separados de la grasa corporal.
Las muestras pueden ser almacenadas en un medio de montaje a 4 ° C durante un máximo de una semana. - Corte el extremo de una punta de la pipeta y utilizarlo para transferir cuidadosamente la grasa corporal con un volumen mínimo de medios de montaje (alrededor de 30 l para un cubreobjetos de 30 mm) en un portaobjetos de microscopio.
- Utilice dos titulares niquelado pin, la celebración de pines 0,1 mm de diámetro para extender la grasa corporal. Los ovarios están ubicados en el tercio posterior de la grasa corporal. La grasa corporal que las rodea es por lo general en forma de "flor". Esto ayuda a identificar la ubicación de los ovarios. Diseccionar las 'flores' del resto de la grasa corporal y deseche el último.
- Retire la grasa corporal Surroinanciamiento de la gónada, cruzando los dos pines con cuidado a su alrededor. Lugar de la gónada aislado en la diapositiva de distancia de los residuos de grasa corporal.
- Cubrir con un cubreobjetos y sellar con esmalte de uñas.
- Visualizar directamente a través de un microscopio confocal. Las muestras pueden ser almacenadas a 4 ° C durante un máximo de tres semanas.
6. Resultados representante
Hemos utilizado el protocolo a seguir sobre el establecimiento de varios linajes de células somáticas en el ovario, incluyendo GSCS y sus nichos somáticas. Para ello se utilizan anticuerpos específicos y marcadores para distinguir entre los diferentes tipos de células en el desarrollo de la gónada. Aquí mostramos un ejemplo de dos ovarios LL3 teñidas con diferentes combinaciones de anticuerpos. Figura 1A destaca filamento terminal y las células de la PAC (verde), que en conjunto forman las células somáticas de los nichos. Figura 1 B, muestra que las células Mezclados (VA, magenta), que en contacto directo con las células germinales (azul).
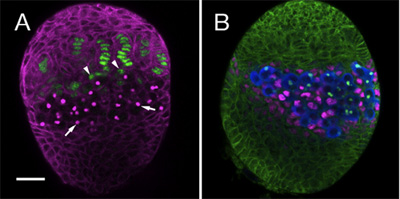
Figura 1. LL3 ovarios. (A) 1B1 anticuerpo monoclonal (magenta) se exponen las células somáticas y las manchas fusome, un orgánulo intracelular en PGCs (flechas). La trampa potenciador hh-lacZ (anti β-galactosidasa, verde) se expresa en los filamentos de la terminal. En la base de las células somáticas de filamentos cap (cabeza de flecha) se puede observar. (B) del anticuerpo 1B1 (verde) se exponen todas las células somáticas en el ovario. Anti-Vasa (azul) etiquetas de todos los PGCs. PGCs en contacto directo con las células Mezclados (VA, anti-atasco de tráfico, magenta). Bar (A y B) es de 20 micras.
Discusión
Este vídeo demuestra un aislamiento y el protocolo de tinción de los ovarios a finales del tercer estadio larval. Para llevar a cabo este protocolo de forma rutinaria y segura, se debe prestar atención a los siguientes puntos:
- Para las larvas sincronizados y bien desarrollado, el hacinamiento se debe evitar.
- Para evitar la pérdida de los ovarios translúcidos pequeños, asegúrese de analizar la grasa en el cuerpo intacto. Esto también le ayudará en la localización de los ovarios en la etap...
Divulgaciones
Agradecimientos
IM es compatible con el Marie Curie reintegración subvención. Este trabajo fue apoyado por el Fondo de Ciencias de Israel no Grant. 1146-1108, por el Helen y Martin Kimmel Instituto para la Investigación de Células Madre en el Instituto Weizmann de la Ciencia y la Fundación Caritativa Leir.
Materiales
| Name | Company | Catalog Number | Comments |
| NaCl | JT Baker | ||
| Kcl | Merck & Co., Inc. | ||
| CaCl2 | Sigma-Aldrich | ||
| MgCl2 | Merck & Co., Inc. | ||
| Sucrose | JT Baker | ||
| Hepes | Sigma-Aldrich | ||
| PBS | Sigma-Aldrich | ||
| Triton X-100 | Sigma-Aldrich | ||
| Albumin Bovine Fraction V | MP Biomedicals | 160069 | |
| Dumont biology tweezers 5 dumstar polished | Fine Science Tools | 11295-10 | |
| Nickel plated pin holder | Fine Science Tools | 26018-17 | |
| s.s minutien pins 0.1mm diam, 10mm long | Fine Science Tools | 26002-10 | |
| 9 well plates 85X100 mm, 22mm o.d.x7mm deep | Corning | 7220-85 | |
| Stereo Microscope MZ 16.5 with a standard transmitted light base TL ST | Leica Microsystems | ||
| 6 well plates | Costar | 3516 | |
| Slides | Menzel-Glaser | 798 | |
| Cover slips | Corning | 2940-223 | |
| Mounting media | Vectashield | H-1200 | |
| Cell strainer | Falcon BD | FAL352350 | |
| 1B1 antibody | Developmental Studies Hybridoma Bank | ||
| Anti-Traffic Jam | Laboratory of Dr. Dorothea Godt | ||
| Anti-Vasa | Laboratory of Dr. Ruth Lehmann | ||
| Anti β-Galactosidase | Cappel | ||
| Secondary Antibodies | Jackson ImmunoResearch |
Referencias
- Fuller, M. T., Spradling, A. C. Male and female Drosophila germline stem cells: two versions of immortality. Science. 316, 402-404 (2007).
- Li, L., Xie, T. Stem cell niche: structure and function. Annual review of cell and developmental biology. 21, 605-631 (2005).
- Chen, D., McKearin, D. Gene circuitry controlling a stem cell niche. Curr Biol. 15, 179-184 (2005).
- Kai, T., Spradling, A. An empty Drosophila stem cell niche reactivates the proliferation of ectopic cells. Proceedings of the National Academy of Sciences of the United States of America. 100, 4633-4638 (2003).
- Kai, T., Spradling, A. Differentiating germ cells can revert into functional stem cells in Drosophila melanogaster ovaries. Nature. 428, 564-569 (2004).
- Lopez-Onieva, L., Fernandez-Minan, A., Gonzalez-Reyes, A. Jak/Stat signalling in niche support cells regulates dpp transcription to control germline stem cell maintenance in the Drosophila ovary. Development. 135, 533-540 (2008).
- Song, X., Zhu, C. H., Doan, C., Xie, T. Germline stem cells anchored by adherens junctions in the Drosophila ovary niches. Science. 296, 1855-1857 (2002).
- Tazuke, S. I. A germline-specific gap junction protein required for survival of differentiating early germ cells. Development. 129, 2529-2539 (2002).
- Xie, T., Spradling, A. C. decapentaplegic is essential for the maintenance and division of germline stem cells in the Drosophila ovary. Cell. 94, 251-260 (1998).
- Xie, T., Spradling, A. C. A niche maintaining germ line stem cells in the Drosophila ovary. Science. , 290-328 (2000).
- Guo, Z., Wang, Z. The glypican Dally is required in the niche for the maintenance of germline stem cells and short-range BMP signaling in the Drosophila ovary. Development. 136, 3627-3635 (2009).
- Wang, X., Harris, R. E., Bayston, L. J., Ashe, H. L. Type IV collagens regulate BMP signalling in Drosophila. Nature. 455, 72-77 (2008).
- Godt, D., Laski, F. A. Mechanisms of cell rearrangement and cell recruitment in Drosophila ovary morphogenesis and the requirement of bric a brac. Development. 121, 173-187 (1995).
- Sahut-Barnola, I., Godt, D., Laski, F. A., Couderc, J. L. Drosophila ovary morphogenesis: analysis of terminal filament formation and identification of a gene required for this process. Developmental biology. 170, 127-135 (1995).
- Song, X., Call, G. B., Kirilly, D., Xie, T. Notch signaling controls germline stem cell niche formation in the Drosophila ovary. 134, 1071-1080 (2007).
- Zhu, C. H., Xie, T. Clonal expansion of ovarian germline stem cells during niche formation in Drosophila. Development. 130, 2579-2588 (2003).
- Ward, E. J. Stem cells signal to the niche through the Notch pathway in the Drosophila ovary. Curr Biol. 16, 2352-2358 (2006).
- Gilboa, L., Lehmann, R. Repression of primordial germ cell differentiation parallels germ line stem cell maintenance. Curr Biol. 14, 981-986 (2004).
- Gilboa, L., Lehmann, R. Soma-germline interactions coordinate homeostasis and growth in the Drosophila gonad. Nature. 443, 97-100 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados