A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Dissection ו מכתים של תסיסנית הזחל השחלות
In This Article
Summary
כמה נישות ותאי גזע צורה במהלך הפיתוח היא שאלה חשובה עם השלכות מעשיות. ב תסיסנית השחלה, קו נבט גזע תאים סומטיים נישות שלהם צורה במהלך התפתחות הזחל. וידאו זה מדגים כיצד לנתח, הכתם הר בלוטות המין הנשי מ instar third מאוחר (LL3) תסיסנית הזחלים.
Abstract
איברים רבים תלויים בתאי גזע לפיתוח שלהם במהלך embryogenesis ו לצורך תחזוקה או תיקון במהלך החיים הבוגרים. ההבנה כיצד בתאי גזע צורה, וכיצד הם מתקשרים עם סביבתם היא קריטית ולכן הבנה, פיתוח הומאוסטזיס ומחלות. השחלה של זבוב הפירות דרוזופילה melanogaster שימש מודל השפעה על האינטראקציה של קו נבט מתאי גזע (GSCs) עם תאים סומטיים התמיכה שלהן (נישה) 1, 2. מיקום ידוע של נישה לבין GSCs, מצמידים את היכולת לתפעל אותם גנטית, אפשרה לחוקרים להבהיר מגוון רחב של אינטראקציות בין בתאי גזע נישות שלהם 3-12.
למרות שפע של מידע על מנגנוני השליטה תחזוקה בידול GSC ו, יחסית מעט מאוד ידוע על איך GSCs נישות סומטיים שלהם צורה במהלך ההתפתחות. כ 18 סומטיים נישות, שמרכיביו כוללים הסלולר נימה מסוף ותאי כובע (איור 1), טופס במהלך השלישי הזחל instar 13-17. GSCs שמקורם בתאי הנבט הראשוני (PGCs). PGCs להתרבות הזחל בשלבים המוקדמים, אך בעקבות היווצרות של הגומחה תת קבוצה של PGCs הופך GSCs 7, 16, 18, 19. יחד, תאים סומטיים נישה ואת GSCs לעשות יחידה תפקודית שמייצר ביצים לאורך כל החיים של האורגניזם.
שאלות רבות בדבר הקמת יחידת GSC נותרו ללא מענה. תהליכים כגון תיאום בין התאים מבשר עבור נישות ו מבשרי תא גזע, או דור אסימטריה בתוך PGCs כאשר הם הופכים GSCs, יכול להיות הכי טוב למד הזחל. עם זאת, מחקר שיטתי של התפתחות השחלה הזחל הוא מאתגר מבחינה פיזית. ראשית, השחלות הזחל הם קטנים. אפילו בשלבי הזחל המאוחרות הן 100μm רק לרוחב. בנוסף, השחלות הם שקופים המוטבעים בגוף שומן לבן. כאן אנו מתארים פרוטוקול צעד אחר צעד לבידוד מן השחלות הזחלים מאוחר third instar תסיסנית (LL3), ואחריו צביעה עם נוגדנים ניאון. אנו מציעים כמה פתרונות טכניים לבעיות כגון איתור השחלות, מכתים ושטיפת רקמות שאינן כיור, ולוודא כי נוגדנים לחדור לתוך הרקמה. פרוטוקול זה יכול להיות מיושם על שלבי הזחל מוקדם כדי האשכים הזחל וכן.
Protocol
1. ההטלה
- חמישה ימים לפני הניתוח: לאפשר הנקבות הזדווגו להטיל ביצים במשך 2-4 שעות על מזון טרי בתוספת שמרים. כדי לקבל זחלים מסונכרן מפותח, חשוב שלא יהיה צפוף תרבותי (כ 30 ביצים / בקבוקון 25mm). בדרך כלל, 7-16 נקבות משמשים לכל בקבוקון, תלוי כמה טוב הם שכבו.
2. בחירת הזחלים
- הכינו צלחת 9-לנתח היטב זכוכית מלא בינוני של רינגר (128mM NaCl, KCl 2mm, 1.8mM CaCl 2, 4 מ"מ MgCl 2, 35.5mM סוכרוז, pH Hepes 5mm 6.9).
- הכן strainers תא צלחת שש היטב המכיל בינוני רינגר ולמקם אותו על הקרח. לחילופין, אנו משתמשים תבניות שנעשו במיוחד מצויד רשת ניילון.
- פיק הזחלים מתוזמן מהקירות בקבוקון באמצעות פינצטה ביולוגי קנס (מלקחיים) ומניחים אותם בצלחת המכיל את הצלצול של מנתחים.
- העברת הזחל הנקבה גם נקי. אנו מבחינים בין זכרים ונקבות על ידי בלוטות המין שלהם. האשכים זכר מזוהים בקלות כמו אליפסות ברור מוטבע גדול בשליש האחורי של הגוף שומן. השחלות נקבה, הממוקם באותו חלק של הגוף את השומן, ניתן לזהות הרבה יותר קטן, עגול תחומים ברורים.
3. Dissection של הזחל
- החזק את הזחל למטה האחורי רק למוח עם מלקחיים ולהסיר את הראש עם זוג השני של מלקחיים.
- מניחים את החלק האחורי שנותר בצד הגב, עם הקנה כלפי מטה.
- החזק את הזחל על ידי spiracles אחורי עם זוג אחד מלקחיים לדחוף אותו פנימה לאט בעוד זוג אחר הוא מחליק את הקוטיקולה בדיעבד עד כמחצית השומן בגוף עולה הזחל.
- להחזיק היטב את הקצה האחורי ולהשתמש זוג אחרים של מלקחיים כדי רופף להחזיק את לציפורן. בעדינות ולאט לאט להתרחק הקצה האחורי כך לציפורן, את השקופית המעי מצורף דרך הפרצה. בסוף התהליך הזה, שומן הגוף צריך להיות מופרד לחלוטין מן המעי ואת לציפורן. נתק את המעי מהחלק הקדמי של הגוף שומן. כדי לעשות מכתים ואת הרכבה קלה יותר, חשוב כי השומן בגוף יישאר ללא שינוי.
- רטוב פיפטה מרעה ביסודיות בינוני רינגר, רצוי הזחלים גזור היטב המכיל. זה עוזר המעיל פיפטה ומונע את שומן הגוף יידבקו אליה. השתמש פיפטה מרעה להעביר את השומן לתוך המדיום Ringer קרח קר מסננת את התא.
4. קיבוע ו מכתים
כל הצעדים מבוצעים בטמפרטורת החדר, למעט הדגרה עם נוגדן ראשון, בשעה 4 ° C.
- דגירה שומן הגוף בפורמלין 5% בינונית של רינגר. במשך 20 דקות עם תסיסה עדינה.
- שטפו במשך 5 דקות עם PBT 1% (1% Triton x-100 ב PBS). חזור על פעולה זו במשך 10 דקות פעם שלישית למשך 45 דקות. 1% Triton X-100 נדרש לחרר את השחלה הזחל ולאפשר לנוגדנים לחדור אותו.
- בלוק עם PBTB 0.3% (0.3% Triton x-100 ו - BSA 1% PBS) במשך שעה 1 עם תסיסה עדינה
- דגירה עם הנוגדן הרצוי 1 st מדולל PBTB 0.3% מעל בלילה 4 מעלות צלזיוס עם תסיסה עדינה. שלב זה מתבצע בדרך כלל על רולר ב 0.2 צינורות מ"ל.
- העברת שומן הגוף בחזרה strainers התא.
- לשטוף 3 פעמים, 30 דקות כל אחד, עם PBTB 0.3% עם תסיסה עדינה.
- בלוק עם PBTB 0.3% בתוספת 5% החמור בסרום נורמלי במשך שעה 1 עם תסיסה עדינה.
- דגירה עם נוגדן משני המתאים בדילול מלא (על פי המפרט של היצרן) בפתרון חסימה (0.3 PBTB% בתוספת 5% נסיוב חמור רגיל PBT 0.3%) למשך 2 שעות עם תסיסה עדינה. אם הנוגדן הוא פלורסנט, דגירה בחושך מנקודה זו ואילך. שלב זה מתבצע בדרך כלל על רולר ב 0.2 צינורות מ"ל.
- לשטוף 3 פעמים במשך 30 דקות כל אחד עם PBT 0.3% עם תסיסה עדינה.
5. הרכבה
- מעבירים את השומן בגוף לצינור Eppendorf נקי. בזהירות רבה להסיר את כל הנוזלים משם מיד לכסות עם התקשורת Vectashield גובר. אנו משתמשים vectashield שגרתי מאז זה לא להתקשות תוך השחלות נעשים מופרדים מהגוף שומן.
דוגמאות ניתן לאחסן מדיה גובר על 4 מעלות צלזיוס עד שבוע. - חותכים את קצה קצה פיפטה ולהשתמש בו בזהירות להעביר את השומן בגוף עם היקף מינימלי של התקשורת הרכבה (כ μl 30 עבור תלוש לכסות-30mm) לשקופית מיקרוסקופ.
- השתמש בשני מצופה ניקל בעלי פין, מחזיק בקוטר 0.1 מ"מ סיכות כדי לפזר את השומן בגוף. השחלות נמצאות בשליש האחורי של הגוף שומן. הגוף שומן המקיפה אותם מעוצב בדרך כלל כמו "פרח". זה עוזר לזהות את המיקום של השחלות. לנתח את 'פרחים' משאר הגוף שומן וזורקים האחרון.
- הסר את surro השומן בגוףunding שחלה על ידי חציית שתי סיכות בזהירות סביבו. מניחים את בלוטת המין מבודד בשקופית הרחק משקעי השומן בגוף.
- מכסים להחליק כיסוי ואיטום עם לק.
- דמיינו ישירות באמצעות מיקרוסקופ confocal. דוגמאות ניתן לאחסן 4 ° C עד שלושה שבועות.
6. נציג תוצאות
השתמשנו בפרוטוקול לעיל לעקוב אחרי הקמתה של כמה שושלות תאים בתוך השחלה גופניות, כולל GSCs נישות סומטיים שלהם. לשם כך אנו משתמשים נוגדנים ספציפיים סמנים להבחין בין סוגי תאים שונים אשך המתפתח. כאן אנו מציגים דוגמא של שתי השחלות LL3 מוכתם שילובים שונים של נוגדנים. איור 1 א מדגיש נימה מסוף ותאי כובע (ירוק), אשר יחד מהווים תאים סומטיים של הגומחה. איור 1B, מראה את התאים התערבבו (שבבים, מגנטה), אשר פנה ישירות לתאי נבט (כחול).
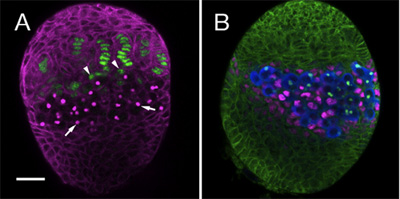
באיור 1. LL3 השחלות. (א) 1B1 נוגדנים חד שבטיים (מג'נטה) מתאר תאים סומטיים וכתמים fusome, אברון תוך תאיים PGCs (חיצים). המלכודת משפר hh-lacZ (אנטי β-galactosidase, ירוק) מתבטא חוטים סופנית. בבסיס של תאים סומטיים נימה כובע (ראשי חץ) ניתן לראות. (ב) נוגדן 1B1 (ירוק) מתאר את כל התאים הסומטיים השחלה. נגד ואסה (כחול) כל התוויות PGCs. PGCs קשר ישירות עם תאים התערבבו (שבבים, אנטי תנועה, מגנטה ריבה). בר (עבור A ו-B) הוא 20 מיקרומטר.
Discussion
וידאו זה מדגים בידוד פרוטוקול מכתים של המנוח השחלות instar third הזחל. כדי לבצע פרוטוקול קבוע ואמין, יש לשים לב לנקודות הבאות:
- עבור הזחלים מסונכרן מפותח, על הצפיפות יש להימנע.
- כדי למנוע אובדן של ה...
Disclosures
Acknowledgements
IM נתמך על ידי מענק קירי מחדש אינטגרציה מארי. עבודה זו נתמכה על ידי שום מדע בישראל מענק הקרן. 1146-1108, על ידי הלן ומרטין קימל המכון למחקר בתאי גזע במכון ויצמן למדע וקרן הצדקה של Leir.
Materials
| Name | Company | Catalog Number | Comments |
| NaCl | JT Baker | ||
| Kcl | Merck & Co., Inc. | ||
| CaCl2 | Sigma-Aldrich | ||
| MgCl2 | Merck & Co., Inc. | ||
| Sucrose | JT Baker | ||
| Hepes | Sigma-Aldrich | ||
| PBS | Sigma-Aldrich | ||
| Triton X-100 | Sigma-Aldrich | ||
| Albumin Bovine Fraction V | MP Biomedicals | 160069 | |
| Dumont biology tweezers 5 dumstar polished | Fine Science Tools | 11295-10 | |
| Nickel plated pin holder | Fine Science Tools | 26018-17 | |
| s.s minutien pins 0.1mm diam, 10mm long | Fine Science Tools | 26002-10 | |
| 9 well plates 85X100 mm, 22mm o.d.x7mm deep | Corning | 7220-85 | |
| Stereo Microscope MZ 16.5 with a standard transmitted light base TL ST | Leica Microsystems | ||
| 6 well plates | Costar | 3516 | |
| Slides | Menzel-Glaser | 798 | |
| Cover slips | Corning | 2940-223 | |
| Mounting media | Vectashield | H-1200 | |
| Cell strainer | Falcon BD | FAL352350 | |
| 1B1 antibody | Developmental Studies Hybridoma Bank | ||
| Anti-Traffic Jam | Laboratory of Dr. Dorothea Godt | ||
| Anti-Vasa | Laboratory of Dr. Ruth Lehmann | ||
| Anti β-Galactosidase | Cappel | ||
| Secondary Antibodies | Jackson ImmunoResearch |
References
- Fuller, M. T., Spradling, A. C. Male and female Drosophila germline stem cells: two versions of immortality. Science. 316, 402-404 (2007).
- Li, L., Xie, T. Stem cell niche: structure and function. Annual review of cell and developmental biology. 21, 605-631 (2005).
- Chen, D., McKearin, D. Gene circuitry controlling a stem cell niche. Curr Biol. 15, 179-184 (2005).
- Kai, T., Spradling, A. An empty Drosophila stem cell niche reactivates the proliferation of ectopic cells. Proceedings of the National Academy of Sciences of the United States of America. 100, 4633-4638 (2003).
- Kai, T., Spradling, A. Differentiating germ cells can revert into functional stem cells in Drosophila melanogaster ovaries. Nature. 428, 564-569 (2004).
- Lopez-Onieva, L., Fernandez-Minan, A., Gonzalez-Reyes, A. Jak/Stat signalling in niche support cells regulates dpp transcription to control germline stem cell maintenance in the Drosophila ovary. Development. 135, 533-540 (2008).
- Song, X., Zhu, C. H., Doan, C., Xie, T. Germline stem cells anchored by adherens junctions in the Drosophila ovary niches. Science. 296, 1855-1857 (2002).
- Tazuke, S. I. A germline-specific gap junction protein required for survival of differentiating early germ cells. Development. 129, 2529-2539 (2002).
- Xie, T., Spradling, A. C. decapentaplegic is essential for the maintenance and division of germline stem cells in the Drosophila ovary. Cell. 94, 251-260 (1998).
- Xie, T., Spradling, A. C. A niche maintaining germ line stem cells in the Drosophila ovary. Science. , 290-328 (2000).
- Guo, Z., Wang, Z. The glypican Dally is required in the niche for the maintenance of germline stem cells and short-range BMP signaling in the Drosophila ovary. Development. 136, 3627-3635 (2009).
- Wang, X., Harris, R. E., Bayston, L. J., Ashe, H. L. Type IV collagens regulate BMP signalling in Drosophila. Nature. 455, 72-77 (2008).
- Godt, D., Laski, F. A. Mechanisms of cell rearrangement and cell recruitment in Drosophila ovary morphogenesis and the requirement of bric a brac. Development. 121, 173-187 (1995).
- Sahut-Barnola, I., Godt, D., Laski, F. A., Couderc, J. L. Drosophila ovary morphogenesis: analysis of terminal filament formation and identification of a gene required for this process. Developmental biology. 170, 127-135 (1995).
- Song, X., Call, G. B., Kirilly, D., Xie, T. Notch signaling controls germline stem cell niche formation in the Drosophila ovary. 134, 1071-1080 (2007).
- Zhu, C. H., Xie, T. Clonal expansion of ovarian germline stem cells during niche formation in Drosophila. Development. 130, 2579-2588 (2003).
- Ward, E. J. Stem cells signal to the niche through the Notch pathway in the Drosophila ovary. Curr Biol. 16, 2352-2358 (2006).
- Gilboa, L., Lehmann, R. Repression of primordial germ cell differentiation parallels germ line stem cell maintenance. Curr Biol. 14, 981-986 (2004).
- Gilboa, L., Lehmann, R. Soma-germline interactions coordinate homeostasis and growth in the Drosophila gonad. Nature. 443, 97-100 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved