Method Article
Establecimiento y propagación de los tumores del retinoblastoma humanos en ratones con deficiencia inmune
* Estos autores han contribuido por igual
En este artículo
Resumen
Se describe un método para propagar los tumores humanos en ratones retinoblastoma. Las células tumorales se inyectan directamente en los ojos de ratones inmunes deficientes. Los tumores secundarios se han establecido con éxito utilizando las células cosechadas directamente de tumores humanos y tumorspheres cultivadas.
Resumen
El cultivo de las células del tumor retinoblastoma en los medios de comunicación definidos de células madre da lugar a tumorspheres primaria que pueden ser cultivadas y se mantiene durante un tiempo limitado. Estos tumorspheres cultivadas pueden presentar fenotipos celulares muy diferentes en comparación con los tumores originales. Demostración de que las células cultivadas tienen la capacidad de formar nuevos tumores es importante asegurarse de que el modelo de las células cultivadas en la biología del tumor original.
Aquí se presenta un protocolo para la propagación de los tumores humanos in vivo con retinoblastoma Rag2 - / - ratones deficientes inmunes. Cultivadas tumorspheres retinoblastoma humanos de paso bajo o de células obtenidas de recién cosechado tumores retinoblastoma humano se inyecta directamente en la cavidad vítrea de los ojos de formar tumores murinos en 2-4 semanas. Estos tumores pueden ser cosechadas y sea más pasajes en los ojos de murino in vivo o que han crecido como tumorspheres in vitro. Propagación se ha realizado con éxito durante al menos tres pasajes, estableciendo así una fuente continua de tejidos humanos para la experimentación retinoblastoma más.
Wesley S. Bond y Wadhwa Lalita son co-autores de primera.
Protocolo
1. Preparación de tumorspheres retinoblastoma
- Obtener una muestra del tumor retinoblastoma en un protocolo aprobado por el IRB.
- Prepare frescos define los medios de comunicación de células madre (Neurobasal-A los medios de comunicación, 1X suplemento de B-27 menos de vitamina A, 1X no esenciales solución de aminoácidos, 1X L-glutamina, 20 ng / mL FEAG, 10 ng / mL bFGF).
- Mecánicamente desglosar el tejido del tumor con un bisturí con una técnica transversal de un tejido estéril, la cultura tratados con 6-así placa. Inmediatamente añadir 100 ml de definir los medios de comunicación de las células madre en el tejido suave y difusión del tejido picado con el bisturí. Añadir 5 ml de definir los medios de comunicación de las células madre para el bienestar.
- Se incuba a 37 ° C, 5% de CO 2 en un incubador humidificado e inspeccionar todos los días. Algunos tumorspheres debe surgir a partir del tejido del tumor interrumpe casi de inmediato, con un número creciente en el transcurso de 2-4 días.
- Semanales, tumorspheres centrifugar a 300xg durante 5 minutos, volver a suspender en recién preparada define los medios de comunicación de las células madre, y la pipeta hacia arriba y abajo 10 veces para interrumpir el más grande, las esferas central necrótica y permitir que nuevos ámbitos, sana a la forma.
2. Preparación de las células tumorales para la inyección
- Si se inyectan tumorspheres cultivadas, con cuidado las esferas de la pipeta en un tubo cónico de 15 ml. Pipeta suavemente hacia arriba y abajo con una pipeta serológica 10-15 veces para interrumpir las esferas.
- Contar las células que se inyecta con una hemocitómetro, y alícuota al menos 50.000 células por inyección en un nuevo tubo. Prepárese para las inyecciones como sea posible en función del número de células disponibles.
- Centrifugar a 300xg durante 5 minutos. Con cuidado, aspirar el sobrenadante y resuspender en 5 ml de PBS. Repetir la centrifugación y la aspiración, y resuspender en 10 l de PBS por inyección.
3. Preparación de los animales
- Utilizando una jeringa de insulina, administrar una inyección intraperitoneal de cóctel roedores anestesia (ketamina 37,6 mg / ml, la xilazina 1,92 mg / mL, acepromacina 0,38 mg / ml) a un l por gramo de peso corporal (GBW). Espere 5 minutos para que el animal se sedado. Comprobar el latido del corazón y el lugar del animal en un cojín de calefacción. Mantener los animales en un cojín de calefacción en todo momento hasta su recuperación.
- Después de la sedación, administrar una gota de HCl proparacaína en el ojo derecho. Vuelva a colocar los animales en el teclado se calienta y esperar 1 minuto.
- Administrar una gota de fenilefrina HCl en el ojo derecho. Vuelva a colocar el animal en el teclado se calienta y espere 5 minutos. Si la dilatación de la pupila no ha ocurrido, volver a administrar una gota y esperar otros 5 minutos.
- Observar a los animales para detectar signos de movimiento o contracción muscular, que puede ocurrir en> 30 minutos después de la sedación. Ante los primeros síntomas de movimiento, administrar 1 l / gbw de ketamina HCl (diluida a 10 mg / ml en PBS) y espere 5 minutos.
4. La inyección de células tumorales
- Coloque el animal anestesiado bajo el microscopio de su lado, con el ojo derecho hacia arriba y con la cabeza apoyada sobre una gasa y se centra en obtener un reflejo rojo en el ojo derecho del fondo de ojo (pupila debe ser dilatada en este momento) cuando se observa a través del microscopio .
- Sostener el globo ocular derecho presionando suavemente al mismo tiempo con dos dedos sobre los párpados y mantener esta posición de manera constante durante el resto del procedimiento.
- Utilizando una aguja estéril de calibre 30 aguja conectada a una jeringa Luer-lock, perforar el globo lateralmente a través de la conjuntiva y la esclera adyacente al limbo corneal en el área de la pars plana (Figura 1) y sólo a través de la coroides en la cavidad vítrea. Retire la aguja de la apertura.
- Esterilizar la aguja Hamilton con un algodón con alcohol. Dibuja la suspensión de células en la jeringa Hamilton e inserte la aguja en el orificio hasta que la aguja se visualiza a través del microscopio detrás de la cámara en el vítreo, cerca de la retina. Con la ayuda de una segunda persona mientras se mantiene la aguja de manera constante en esta posición, presione el émbolo lenta. Retire la aguja. Si es necesario, use un hisopo de algodón para absorber cualquier líquido de la apertura.
- Suavemente liberar la presión de los párpados para cerrar los párpados del ratón.
- Administrar una gota de hipromelosa para cada ojo y devolver los animales al cojín calentado para la recuperación.
5. Seguimiento de los ratones inyectados y la cosecha de los tumores
- Todos los días, examinará los ojos inyectados de leucocoria (reflejo blanco papilar) y / o distensión periocular que por lo general se manifiesta 2-4 semanas después de la inyección.
- Una vez que el crecimiento del tumor se detecta, la eutanasia de animales de acuerdo con las directrices institucionales.
- Si el ojo y el tumor está cubierto por los párpados, el uso del bisturí para realizar dos incisiones ortogonal a la hendidura palpebral y levantar los colgajos de piel.
- Bajo visualización con el microscopio estereoscópico, hacer una incisión circunferencial en el limbo, la eliminación de la córnea y el cristalino, y con mucho cuidado diseccionar la mayor parte de la masa del tumor de los tejidos con otros tweezers. Lugar del tumor en estéril RPMI-1640.
- Utilizar pinzas para extraer lentamente el mundo abierto de la toma. Para asegurar un nervio óptico adjunto para la invasión del tumor se pueden visualizar, tire del mundo hasta que el nervio está expuesto y el uso de tijeras para cortar el nervio mayor tiempo posible. Lugar en formol al 10% para el procesamiento normal para el examen histológico.
6. Los resultados representativos:
Tumorspheres retinoblastoma comenzarán a aparecer a partir del tejido desglosados casi de inmediato, ya que se liberan de la masa tumoral. Dentro de 2-4 días, más tumorspheres se empiezan a formar y aumentar de tamaño. Las esferas tienden a ser regulares y presentan una estrategia bien definida, la membrana que rodea el conjunto secundario (Figura 2).
El animal se presenta típicamente con leucocoria en las 4 semanas después de la inyección (Figura 3b), seguido por la ampliación de la tierra y la distensión de los tejidos circundantes 5-8 semanas después de la inyección al crecer el tumor (Figura 3c).
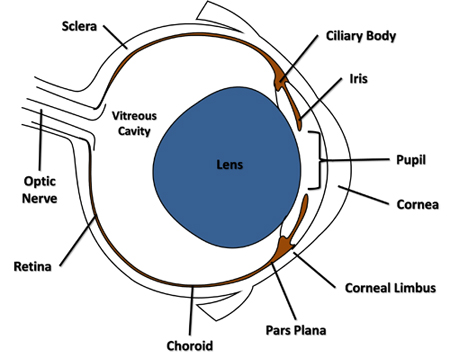
Figura 1. Transversal diagrama del ojo del ratón destacando características mencionadas en el protocolo.
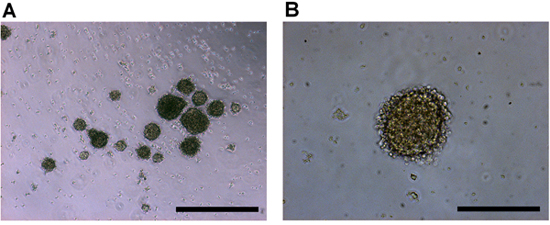
Figura 2. Cultivo de células humanas in vitro retinoblastoma imágenes en un 4x), y b) aumento del objetivo de 10x. Células de retinoblastoma tumor primario producir tumorspheres con una forma regular esferoide y una membrana externa crujiente. Las barras de escala representan a) 500 m, y b) micras 200.
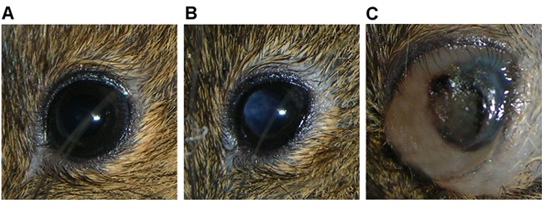
Figura 3 Ojo de Rag2 -. / - Ratón que muestra una serie de características) normal, b) indicativo de una masa tumoral en la cavidad vítrea leucocoria, y c) una gran masa tumoral de llenar el mundo con distensión periocular asociada, hemorragia intraocular.
Discusión
La técnica descrita en este documento facilita la propagación de los tumores de retinoblastoma intraocular en su entorno, intravítrea. La técnica de inyección intraocular se ha utilizado en el pasado para crear tumores de líneas celulares derivadas retinoblastoma-1, así como para entregar los vectores virales para la terapia génica 2,3 intraocular. Esta técnica ha sido utilizada con éxito para producir tumores humanos retinoblastoma mediante la inyección de las células del tumor primario y la inyección de tumorspheres así como la propagación de serie de los tumores de xenoinjerto. Evidencia visible de la formación de tumores (por lo general leucocoria) se nota por primera vez en 4 semanas, después de que la hemorragia intraocular y la distensión del globo y / o tejidos que rodean la órbita se desarrollan dentro de 5-8 semanas. Una minoría de los ratones inyectados dañar el ojo inyectado, provocando el cierre permanente de los párpados. En estos casos, la distensión es la única señal de la formación de tumores.
Establecimiento de tumores murinos xenoinjertos no ha tenido éxito con todos los tumores de retinoblastoma humanos, a pesar de la propagación de los tumores de xenoinjerto establecido es de gran éxito. Esta observación sugiere que ciertas características del tumor primario, como la agresividad y el nivel de diferenciación o de algún otro factor desconocido, pueden estar influyendo en la capacidad de estos tumores a persistir en el ambiente ocular murino.
La cantidad de tejido que pueden ser adquiridos a partir de un tumor retinoblastoma humanos es bastante pequeña, y hay importantes limitaciones en la capacidad de las células de cultivo retinoblastoma humanos in vitro, tales como tiempo de vida limitado, la pérdida de la histología del tumor sólido y cambios en el fenotipo celular. Este protocolo proporciona una forma relativamente sencilla de propagar el tumor humano y establecer un modelo murino de la enfermedad humana. Esto permite que más in vitro y la experimentación in vivo de la biología de retinoblastoma y ya el mantenimiento de la parte exterior del tumor del paciente.
Divulgaciones
Los experimentos con animales se realizaron de acuerdo con las directrices y normas establecidas por el Colegio Baylor de Medicina IACUC Comité.
Agradecimientos
La financiación de este proyecto está a cargo de la Fundación Clayton para la Investigación y la Fundación Retina investigación.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre | Empresa | Catálogo # | Comentarios |
|---|---|---|---|
| Clorhidrato de fenilefrina al 2,5% | Bausch & Lomb | 053-11 | Oftálmica solución |
| 30 ga la aguja | BD | 305128 | Bisel regular |
| 10 ml Luer-Lock Jeringa | BD | 309604 | |
| 3/10-cc jeringa de insulina | BD | 328431 | |
| Torundas con alcohol | BD | 326895 | |
| 6-Bueno Plate, el cultivo de tejidos tratados | BD | 353046 | |
| Proparacaína HCl 0,5% | Mayordomo de la peste equina | 017239 | Oftálmica solución |
| La ketamina HCl 100mg/ml | Fort Dodge | 4402A | |
| 10-l Hamilton jeringa | Hamilton Company | 7648-01 | |
| 32 ga Hamilton Aguja | Hamilton Company | 7803-04 | Costumbre longitud - 0.5 " |
| Neurobasal-A los medios de comunicación | Invitrogen | 10888-022 | |
| B-27 Suplemento Menos vitamina A, 50 veces | Invitrogen | 12587-010 | |
| RPMI-1640 | Mediatech | 10 a 040 CV | |
| No esenciales solución de aminoácidos, 100X | Mediatech | 25 a 025-CI | |
| L-Glutamina, 100X | Mediatech | 25 a 005-CI | |
| Desechables bisturí # 11 | Miltex | 4-411 | |
| Roedores Combo anestesia | n / a | n / a | En casa de farmacia formulación (ketamina 37,6 mg / ml, la xilazina 1,92 mg / mL, acepromacina 0,38 mg / mL) |
| Recombinante factor de crecimiento epidérmico (EGF) | StemCell Tecnologías | 02633 | Reconstituir a 10 mg / ml de solución de archivo |
| Recombinante humano del factor de crecimiento de fibroblastos básico (bFGF) | StemCell Tecnologías | 02634 | Reconstituir a 10 mg / ml de solución de archivo |
| OMS-75 Microscopio operaciones | Topcon Medical Systems | OMS-75 | Este modelo ha sido descontinuado |
| Formalina al 10% | VWR | 95042-908 |
Referencias
- Chèvez-Barrios, P. Metastatic and Nonmetastatic Models of Retinoblastoma. Am. J. Pathol. 157, 1405-1412 (2000).
- Suber, M. L., Hurwitz, M. Y., Chèvez-Barrios, P., Hurwitz, R. L. Immune consequences of intraocular administration of modified adenoviral vectors. Hum. Gene Ther. 12, 833-838 (2001).
- Mallam, J. N., Hurwitz, M. Y., Mahoney, T., Chèvez-Barrios, P., Hurwitz, R. L. Efficient Gene Transfer into Retinal Cells Using Adenoviral Vectors: Dependence on Receptor Expression. Invest. Ophthalmol. Vis. Sci. 45, 1680-1687 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados