Method Article
Создание и распространение опухолей человека Ретинобластома в иммунодефицитных мышей
* Эти авторы внесли равный вклад
В этой статье
Резюме
Метод описан для распространения опухолей человека ретинобластомы у мышей. Опухолевые клетки напрямую вводили в глазах иммунодефицитных мышей. Вторичные опухоли были успешно созданы с использованием как клетки непосредственно найденным опухолей человека и культурной tumorspheres.
Аннотация
Культивирование ретинобластома опухолевых клеток в определенных СМИ стволовых клеток приводит к первичному tumorspheres которые могут быть выращены и поддерживается только в течение ограниченного времени. Эти культурные tumorspheres могут проявлять заметно различных клеточных фенотипов, когда по сравнению с первоначальной опухоли. Демонстрация того, что культивируемые клетки имеют возможности формирования новых опухолей, важно обеспечить, чтобы культурная модель клетки биологии опухоли.
Здесь мы приводим протокол за распространение опухолей человека ретинобластомы в естественных условиях использования RAG2 - / - иммунодефицитных мышей. Искусственный человеческий tumorspheres ретинобластома низкого прохода или клеток, полученных из свежесобранных опухолей человека ретинобластома вводится непосредственно в полость стекловидного тела мышиных глаз форма опухоли в течение 2-4 недель. Эти опухоли могут быть собраны и либо дальнейших пассировать в мышиных глаз в естественных условиях или выращивают как tumorspheres в пробирке. Распространение была успешно проведена, по крайней мере тремя проходами что позволит установить постоянный источник человеческих тканей ретинобластома для дальнейших экспериментов.
Уэсли С. Бонд и Лалита Вадхва являются со-первых авторов.
протокол
1. Подготовка ретинобластома tumorspheres
- Получить образец ретинобластома опухоли под IRB, утвержденных протоколом.
- Подготовка свежих определены СМИ стволовых клеток (Neurobasal-медиа, 1X B-27 дополнения минус витамина, 1X несущественные аминокислоты кислоты, 1X L-глутамина, 20 нг / мл ЭФР, 10 нг / мл bFGF).
- Механически дезагрегировать опухолевой ткани с помощью скальпеля использованием сквозной технику в стерильной, культуры тканей обработанных 6-луночный планшет. Сразу же добавить 100 мкл определены СМИ стволовых клеток в ткани и мягко распространению фарш ткани с помощью скальпеля. Добавьте 5 мл определены СМИ стволовых клеток к колодцу.
- Инкубировать при 37 ° C, 5% СО 2 во влажной инкубатор и проверить ежедневно. Некоторые tumorspheres должны вытекать из опухолевой ткани нарушается почти сразу, и все больше в течение 2-4 дней.
- Еженедельно, центрифуги tumorspheres на 300xg в течение 5 минут, ресуспендируют в свежеприготовленный определены СМИ стволовых клеток, и пипетки вверх-вниз 10 раз, чтобы сорвать больше, централизованно некротических сферах, а также позволяет новым, здоровым сфер форме.
2. Подготовка опухолевых клеток для инъекций
- Если инъекционных культурный tumorspheres, мягко пипетки сферы в 15-мл коническую трубку. Аккуратно пипетки вверх и вниз с серологические пипетки 10-15 раз сорвать сферах.
- Граф клетки для инъекций использованием hemacytometer, и аликвоту не менее 50000 клеток на введение в новую трубу. Подготовка к инъекции, как многие, как возможно на основе числа клеток имеется.
- Центрифуга на 300xg течение 5 минут. Тщательно аспирата супернатант и ресуспендируют в 5 мл PBS. Повторите центрифугирования и стремление, и ресуспендируют в 10 мкл PBS на инъекцию.
3. Подготовка животных
- Использование инсулиновый шприц, администрирования при введении препарата в грызун коктейль анестезии (кетамин 37,6 мг / мл, ксилазина 1,92 мг / мл, acepromazine 0,38 мг / мл) на 1 мкл на грамм массы тела (GBW). Подождите 5 минут, чтобы животное могло стать седации. Проверьте пульс и место животного на нагретой панели. Поддерживать животных на нагревают площадку в любое время до выздоровления.
- После седации, администрирования 1 каплю раствора для proparacaine правого глаза. Замените животные на подогреваемых блокнот и подождите 1 минуту.
- Администрирование 1 каплю раствора для фенилэфрин правого глаза. Замените животные на площадке подогревом и подождать 5 минут. Если расширение зрачка не произошло, повторно управлять 1 капли и подождать еще 5 минут.
- Монитор животных на наличие признаков движения или подергивания, которые могут возникнуть на> 30 минут после успокоения. При первых признаках движения, управление 1 мкл / GBW кетамина HCl (разбавляют до 10 мг / мл в PBS) и подождите 5 минут.
4. Инъекции клеток опухоли
- Место под наркозом животных под микроскопом на боку, с правого глаза вверх и с голову на марлю и в центре, чтобы получить красный рефлекс глазного дна правого глаза (ученик должен быть расширенными в это время), когда наблюдается через микроскоп .
- Подоприте право мира, осторожно надавив одновременно с двумя пальцами на веки и держать эту позицию уверенно на оставшуюся часть процедуры.
- Использование стерильных 30-игла прилагается к Луер-Лок шприц, проколоть миру сбоку через конъюнктивы и склеры, прилегающих к роговице лимба в районе Парс-Плана (рис. 1) и только через сосудистую оболочку в полость стекловидного тела. Удалите иглу из отверстия.
- Стерилизуйте иглу Гамильтона с тампоном, смоченным спиртом. Нарисуйте клеточной суспензии в шприц Гамильтон и вставить иглу в отверстие до иглы визуализируется через микроскоп за линзы в стекловидное возле сетчатки. С помощью второго человека, держа иглу постоянно в этом положении, нажмите поршень медленно. Удалите иглу. Если необходимо, используйте ватный тампон, чтобы поглощать жидкости из отверстия.
- Аккуратно релиз давлением веки, чтобы закрыть мыши веки.
- Администрирование 1 каплю гипромеллоза для каждого глаза и вернуть животное подогревом площадкой для восстановления.
5. Мониторинг вводили мышам и уборки опухолей
- Ежедневно, изучить вводят око за leukocoria (белые папиллярные рефлекс) и / или periocular вздутие, которое обычно проявляется через 2-4 недели после инъекции.
- Как только рост опухолей обнаружен, эвтаназии животных в соответствии с ведомственным руководящим принципам.
- Если глаза и опухоль распространяется век, использовать скальпель, чтобы сделать два разреза ортогональной глазной щели и поднимите кожных лоскутов.
- Под визуализации с помощью стереоскопического микроскопа, делают разрез в окружной лимба, удаление роговицы и хрусталика, и тщательно анализировать основную часть опухоли из других тканей с использованием TweeЦерс. Место опухоли в стерильной среде RPMI-1640 средств массовой информации.
- Используйте пинцет, чтобы медленно потяните открытым миру из розетки. Для обеспечения прилагается зрительного нерва так опухолевой инвазии могут быть визуализированы, тянуть шар до нерва подвергается и использовать ножницы, чтобы вырезать нерва как можно дольше. Место в 10% формалине для регулярной обработки для гистологического исследования.
6. Представитель Результаты:
Ретинобластома tumorspheres начнут появляться с разбивкой ткань практически сразу же, как они будут освобождены от опухоли. В течение 2-4 дней, более tumorspheres начнет формировать и будет увеличиваться в размерах. Сферах, как правило, регулярные и имеют четко определенного, среднего мембраны, окружающей агрегат (рис. 2).
Животного обычно проявляется leukocoria в течение 4 недель после инъекции (рис. 3б), а затем расширение земной шар и растяжения окружающих тканей через 5-8 недель после инъекции, как опухоль растет (рис. 3в).
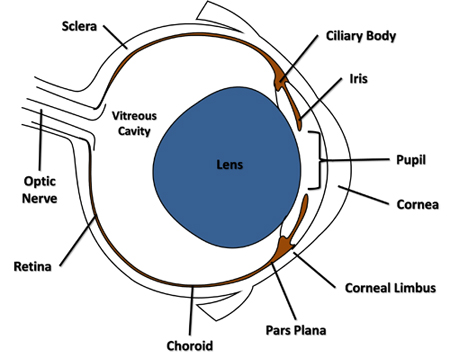
Рисунок 1. Поперечного сечения диаграммы мыши глаз подсветка функции, указанные в протоколе.
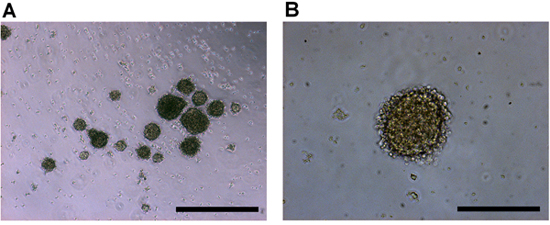
Рисунок 2. Культуры человеческих клеток в пробирке ретинобластома отображаеются) 4x, и б) 10-кратным увеличением цели. Ретинобластома первичные опухолевые клетки производят tumorspheres с регулярной сфероида форму и четкие наружной мембраны. Шкала бары представляют) 500 мкм, и б) 200 мкм.
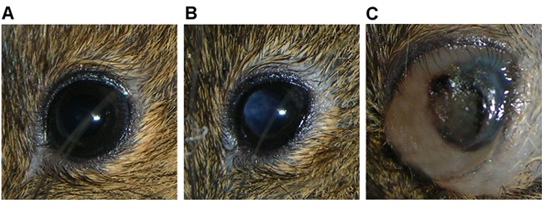
Рисунок 3 Глаз RAG2 -. / - Мыши показывает) нормальные функции, б) leukocoria свидетельствует о опухолевой массы в полость стекловидного тела, и в) большая масса опухоли заполнения миру с соответствующими растяжение periocular, внутриглазное кровотечение.
Обсуждение
Методике, описанной здесь способствует распространению опухоли ретинобластомы в их внутриглазное, интравитреальные среде. Внутриглазного технику инъекции был использован в прошлое, чтобы создать опухоли от ретинобластомы полученных клеточных линий 1, а также для доставки вирусных векторов для генной терапии внутриглазным 2,3. Эта методика была успешно использована для получения человеческих опухолей ретинобластома по прямым впрыском клеток из первичной опухоли и введение tumorspheres, а также серийные распространения ксенотрансплантата опухолей. Видимые свидетельства образование опухолей (обычно leukocoria), как правило, впервые отмечено в течение 4 недель, после чего внутриглазное кровотечение и вздутие земного шара и / или тканей, окружающих орбиту развиваются в течение 5-8 недель. Меньшинство вводили мышам вводили травмировать глаз, что привело к окончательному закрытию век. В этих случаях, вздутие является единственным признаком образования опухоли.
Создание мышиных опухолей ксенотрансплантата не была успешной со всеми человеческими опухолями ретинобластома, хотя и распространении раковых опухолей ксенотрансплантата является весьма успешным. Это наблюдение позволяет предположить, что некоторые характеристики первичной опухоли, такие, как инвазивность и уровень дифференциации или другой неизвестный фактор, может быть, влияющих на способность этих опухолей упорствовать в мышиной среды окуляра.
Количество ткани, которые могут быть приобретены у человека опухоли ретинобластома весьма мала, и Есть существенные ограничения на способность к культуре человеческих клеток ретинобластомы в пробирке, такие как ограниченный срок службы, потеря твердого гистология опухоли и изменения в клеточной фенотипа. Этот протокол обеспечивает относительно простой способ для распространения опухоли человека и создания мышиной модели заболевания человека. Это позволяет в дальнейшем в пробирке и в естественных экспериментов по биологии ретинобластомы и дольше поддержания опухоли за пределы пациента.
Раскрытие информации
Эксперименты на животных были проведены в соответствии с руководящими принципами и правилами, установленными Медицинского колледжа Бэйлора IACUC комитета.
Благодарности
Финансирование данного проекта осуществляется Клейтон научного фонда и Фонда Retina исследований.
Материалы
| Name | Company | Catalog Number | Comments |
| Имя | Компания | Каталог # | Комментарии |
|---|---|---|---|
| Фенилэфрин HCl 2,5% | Bausch & Lomb | 053-11 | Офтальмология решение |
| 30-га иглы | BD | 305128 | Регулярные конические |
| 10-мл Луер-Лок Шприц | BD | 309604 | |
| 3/10-cc инсулиновый шприц | BD | 328431 | |
| Тампоны спиртовые | BD | 326895 | |
| 6-луночный планшет, культуры тканей обработанных | BD | 353046 | |
| Proparacaine HCl 0,5% | Батлер AHS | 017239 | Офтальмология решение |
| Кетамин HCl 100мг/мл | Форт Додж | 4402A | |
| 10-мкл Hamilton Шприц | Компания Hamilton | 7648-01 | |
| 32-га Гамильтон иглы | Компания Hamilton | 7803-04 | Custom длина - 0,5 " |
| Neurobasal-Медиа | Invitrogen | 10888-022 | |
| B-27 Дополнение Минус витамин А, 50X | Invitrogen | 12587-010 | |
| RPMI-1640 СМИ | Mediatech | 10-040-CV | |
| Номера для незаменимых аминокислот кислоты, 100X | Mediatech | 25-025-CI | |
| L-глютамин, 100X | Mediatech | 25-005-ДИ | |
| Одноразовые № 11 скальпеля | Miltex | 4-411 | |
| Combo грызунов Анестезия | н / | н / | Внутренний аптеке формулировке (кетамин 37,6 мг / мл, ксилазина 1,92 мг / мл, acepromazine 0,38 мг / мл) |
| Рекомбинантного человеческого эпидермального фактора роста (EGF) | STEMCELL Технологии | 02633 | Развести в 10 мкг / мл раствора акции |
| Рекомбинантного человеческого основной фактор роста фибробластов (bFGF) | STEMCELL Технологии | 02634 | Развести в 10 мкг / мл раствора акции |
| OMS-75 Операционный микроскоп | Topcon Medical Systems | OMS-75 | Эта модель была прекращена |
| 10% формалине | VWR | 95042-908 |
Ссылки
- Chèvez-Barrios, P. Metastatic and Nonmetastatic Models of Retinoblastoma. Am. J. Pathol. 157, 1405-1412 (2000).
- Suber, M. L., Hurwitz, M. Y., Chèvez-Barrios, P., Hurwitz, R. L. Immune consequences of intraocular administration of modified adenoviral vectors. Hum. Gene Ther. 12, 833-838 (2001).
- Mallam, J. N., Hurwitz, M. Y., Mahoney, T., Chèvez-Barrios, P., Hurwitz, R. L. Efficient Gene Transfer into Retinal Cells Using Adenoviral Vectors: Dependence on Receptor Expression. Invest. Ophthalmol. Vis. Sci. 45, 1680-1687 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены