Method Article
Création et propagation des tumeurs de l'homme en rétinoblastome immunitaire chez les souris déficientes
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Une méthode est décrite pour propager les tumeurs humaines chez la souris rétinoblastome. Les cellules tumorales sont injectées directement dans les yeux du système immunitaire chez les souris déficientes. Tumeurs secondaires ont été établies avec succès en utilisant les deux cellules directement récoltées à partir de tumeurs humaines et tumorspheres cultivés.
Résumé
La culture de cellules tumorales dans le rétinoblastome défini les médias cellules souches suscite tumorspheres primaires qui peuvent être cultivées et entretenues pour seulement un temps limité. Ces tumorspheres cultivés peuvent présenter nettement différents phénotypes cellulaires par rapport aux tumeurs d'origine. La démonstration que les cellules cultivées ont la capacité de former de nouvelles tumeurs est important de s'assurer que le modèle de cellules cultivées de la biologie de la tumeur d'origine.
Nous présentons ici un protocole pour la propagation des tumeurs du rétinoblastome humain in vivo utilisant Rag2 - / - immunitaire des souris déficientes. Cultured tumorspheres rétinoblastome humain de passage faible ou cellules obtenues à partir fraîchement récoltées tumeurs du rétinoblastome humain injecté directement dans la cavité vitréenne d'yeux murin former des tumeurs dans les 2-4 semaines. Ces tumeurs peuvent être récoltées et d'autres passages soit dans les yeux murins in vivo ou cultivées comme tumorspheres in vitro. Propagation a été effectuée avec succès pendant au moins trois passages établissant ainsi une source continue de tissus humains pour le rétinoblastome de nouvelles expérimentations.
Wesley S. Bond et Lalita Wadhwa sont co-premiers auteurs.
Protocole
1. Préparation de tumorspheres rétinoblastome
- Obtenir un échantillon tumoral rétinoblastome dans un IRB-protocole approuvé.
- Préparer une solution fraîche défini les médias de cellules souches (Neurobasal-A médias, 1X B-27 Supplément de moins de vitamine A, 1X non essentiels solution d'acides aminés, 1X L-glutamine, 20 ng / ml EGF, 10 ng / ml de bFGF).
- Mécaniquement désagréger le tissu tumoral avec un scalpel en utilisant une technique transversale dans un tissu stérile, la culture traitée à 6 puits assiette. Immédiatement ajouter 100 ul de définir les médias de cellules souches pour le tissu et écartez doucement les tissus hachés à l'aide du scalpel. Ajouter 5 ml de définir les médias de cellules souches pour le bien.
- Incuber à 37 ° C, 5% de CO 2 dans un incubateur humidifié et inspecter tous les jours. Certains tumorspheres devraient découler du tissu tumoral perturbé presque immédiatement, avec un nombre croissant au cours de 2-4 jours.
- Hebdomadaire, tumorspheres centrifuger à 300xg pendant 5 minutes, remettre en suspension dans fraîchement préparés défini les médias de cellules souches, et une pipette de haut en bas 10 fois plus de perturber, de sphères et de permettre au centre nécrotique nouvelle, saine pour former des sphères.
2. Préparation des cellules tumorales pour l'injection
- Si l'injection de tumorspheres cultivés, doucement sphères de pipette dans un tube de 15 ml conique. Délicatement la pipette de haut en bas avec une pipette sérologique 10-15 fois à perturber les sphères.
- Compter les cellules d'être injecté à l'aide d'un hématimètre et aliquot au moins 50.000 cellules par injection dans un nouveau tube. Préparez-vous à des injections que possible en fonction du nombre de cellules disponibles.
- Centrifuger à 300xg pendant 5 minutes. Aspirer délicatement le surnageant et remettre en suspension dans 5 ml de PBS. Répétez la centrifugation et de l'aspiration, et remettre en suspension dans 10 pl de PBS par injection.
3. Préparation des animaux
- En utilisant une seringue à insuline, d'administrer une injection intrapéritonéale de cocktail d'anesthésie chez les rongeurs (kétamine 37,6 mg / mL, la xylazine 1,92 mg / mL, l'acépromazine 0,38 mg / ml) à 1 l par gramme de poids corporel (GBW). Attendez 5 minutes pour que l'animal devient un sédatif. Vérifier pouls et la place de l'animal sur un tapis chauffant. Maintenir les animaux sur un tapis chauffant, à tout moment jusqu'à la guérison.
- Après la sédation, administrer une goutte de HCl proparacaïne à l'oeil droit. Remplacer des animaux sur coussin chauffé et attendre 1 minute.
- Administrer une goutte de chlorhydrate de phényléphrine à l'oeil droit. Remplacer l'animal sur le coussin chauffé et attendez 5 minutes. Si la dilatation de la pupille n'a pas eu lieu, ré-administrer 1 goutte et d'attendre encore 5 minutes.
- Surveiller les animaux pour des signes de mouvement ou de tics, qui peut survenir à> 30 minutes après la sédation. Dès les premiers signes de mouvement, d'administrer une ul / GBW de kétamine HCl (dilué à 10 mg / ml dans PBS) et attendez 5 minutes.
4. L'injection de cellules tumorales
- Placez l'animal anesthésié sous le microscope sur le côté, avec l'œil droit vers le haut et avec la tête posée sur de la gaze et centré afin d'obtenir un réflexe rouge de l'œil droit du fond d'œil (pupille doit être dilatée à cette époque) lorsqu'on les observe au microscope .
- Caler le globe à droite en appuyant doucement avec deux doigts simultanément sur les paupières et maintenez cette position de façon constante pour le reste de la procédure.
- En utilisant une solution stérile de calibre 30 aiguille reliée à une seringue luer-lock, percer dans le monde latéralement à travers la conjonctive et la sclère adjacente à la cornée du limbe dans le domaine de la pars plana (figure 1) et seulement à travers la choroïde dans la cavité vitréenne. Retirez l'aiguille de l'ouverture.
- Stériliser l'aiguille Hamilton avec une compresse imbibée d'alcool. Dessinez la suspension cellulaire dans la seringue Hamilton et insérer l'aiguille dans l'ouverture jusqu'à l'aiguille est visualisée à travers le microscope derrière l'objectif dans le vitré près de la rétine. Avec l'aide d'une deuxième personne tout en maintenant l'aiguille de façon constante dans cette position, enfoncez lentement le piston. Retirer l'aiguille. Si nécessaire, utilisez un coton-tige pour absorber tout liquide de l'ouverture.
- Relâchez doucement la pression des paupières de fermer les paupières de la souris.
- Administrer une goutte d'hypromellose à chaque oeil et le retour des animaux à coussin chauffé pour la récupération.
5. Suivi des souris injectées et la récolte des tumeurs
- Quotidien, examiner l'œil injecté de leucocorie (blanc papillaire réflexe) et / ou distension périoculaire qui devient généralement apparente 2-4 semaines après l'injection.
- Une fois la croissance tumorale est détectée, euthanasier des animaux en fonction de directives institutionnelles.
- Si l'œil et la tumeur sont couverts par les paupières, utilisez le scalpel pour faire deux incisions orthogonale à la fente palpébrale et soulever les rabats de peau.
- Sous la visualisation au microscope stéréoscopique, faire une incision circulaire au niveau du limbe, la suppression de la cornée et le cristallin, et soigneusement disséquer le gros de la masse tumorale d'autres tissus en utilisant tweenisateurs. Placez la tumeur dans stériles RPMI-1640 médias.
- Utilisez des pinces pour tirer lentement le globe ouverte de la douille. Afin de garantir un nerf optique, de sorte attachés invasion tumorale peuvent être visualisées, tirer le globe jusqu'à ce que le nerf est exposée et utiliser des ciseaux pour couper le nerf le plus longtemps possible. Placer dans formol à 10% pour le traitement régulier pour un examen histologique.
6. Les résultats représentatifs:
Tumorspheres rétinoblastome va commencer à apparaître à partir des tissus désagrégés presque immédiatement car ils sont libérés de la masse tumorale. Dans 2-4 jours, plus tumorspheres commence à se former et va augmenter en taille. Les sphères ont tendance à être régulières et présentent une stratégie bien définie, membrane secondaire entourant l'ensemble (figure 2).
L'animal présente généralement leucocorie dans les 4 semaines après l'injection (figure 3B), suivie par l'élargissement de la planète et la distension des tissus environnants 5-8 semaines après l'injection que la tumeur se développe (figure 3C).
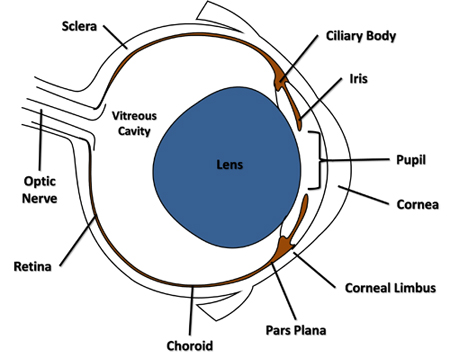
Figure 1. Transversales diagramme de l'oeil de la souris en soulignant les caractéristiques mentionnées dans le protocole.
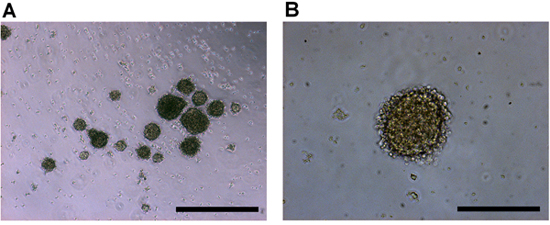
Figure 2. Culture de cellules humaines in vitro rétinoblastome imagée à un 4x), et b) grossissement de l'objectif 10x. Le rétinoblastome cellules tumorales primaires produisent tumorspheres avec une forme régulière sphéroïde et une membrane extérieure croustillante. Barres d'échelle représentent un 500) um, et b) 200 um.
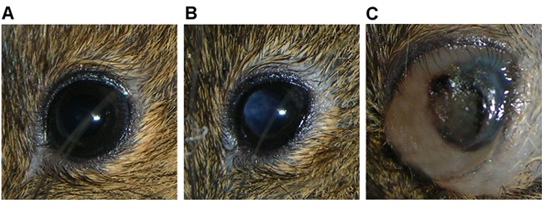
Figure 3 Oeil de Rag2 -. / - Souris montrant une des caractéristiques) normale, b) indicatifs d'une masse tumorale dans la cavité vitréenne leucocorie, et c) d'une masse tumorale importante remplissant le globe avec une distension périoculaire associée, une hémorragie intra-oculaire.
Discussion
La technique décrite ici facilite la propagation des tumeurs du rétinoblastome dans leur intraoculaire, le milieu intra-vitréenne. La technique d'injection intra-oculaire a été utilisé dans le passé pour créer des lignées cellulaires de tumeurs du rétinoblastome dérivés 1 ainsi que pour fournir des vecteurs viraux pour la thérapie génique intraoculaire 2,3. Cette technique a maintenant été utilisé avec succès pour produire des tumeurs du rétinoblastome humain par injection directe de cellules de la tumeur primaire et l'injection de tumorspheres ainsi que la propagation de série de tumeurs de xénogreffe. Preuves visibles de la formation de tumeurs (généralement leucocorie) est généralement d'abord noté dans les 4 semaines, après quoi une hémorragie intra-oculaire et une distension du globe et / ou les tissus environnants de l'orbite de développer dans les 5-8 semaines. Une minorité de souris injectées blesser l'œil injecté, conduisant à la fermeture permanente de la paupière. Dans ces cas, la distension est le seul signe de la formation de tumeurs.
Création de tumeurs murines xénogreffe n'a pas été réussie avec l'ensemble des tumeurs du rétinoblastome humain, si la propagation des tumeurs xénogreffe établie est très réussie. Cette observation suggère que certaines caractéristiques de la tumeur primaire, comme envahissant et le niveau de différenciation ou d'autres facteurs inconnus, peuvent influencer la capacité de ces tumeurs à persister dans l'environnement oculaires murin.
La quantité de tissu qui peut être acquise à partir d'une tumeur du rétinoblastome humain est assez petit, et il ya des limites importantes sur l'aptitude à cultiver des cellules humaines in vitro rétinoblastome tels que la durée de vie limitée, la perte de l'histologie des tumeurs solides et des changements dans le phénotype cellulaire. Ce protocole constitue un moyen relativement simple de propager la tumeur humaine et d'établir un modèle murin de la maladie humaine. Cela permet à d'autres in vitro et in vivo d'expérimentation de la biologie du rétinoblastome et plus l'entretien de l'extérieur une tumeur du patient.
Déclarations de divulgation
Expériences sur les animaux ont été effectuées en conformité avec les directives et les règlements énoncés par le Baylor College of Medicine IACUC Comité.
Remerciements
Le financement de ce projet est assuré par la Fondation pour la Recherche et Clayton Research Foundation Retina.
matériels
| Name | Company | Catalog Number | Comments |
| Nom | Société | Catalogue # | Commentaires |
|---|---|---|---|
| Chlorhydrate de phényléphrine 2,5% | Bausch & Lomb | 053-11 | La solution ophtalmique |
| 30-ga Needle | BD | 305128 | Conique régulier |
| 10 ml Seringue Luer-Lock | BD | 309604 | |
| Seringue à insuline 3/10-cc | BD | 328431 | |
| Tampons alcoolisés | BD | 326895 | |
| 6-Bien tissus Plate, de la Culture-traitées | BD | 353046 | |
| Proparacaïne HCl 0,5% | Butler PAPA | 017239 | La solution ophtalmique |
| La kétamine HCl 100mg/mL | Fort Dodge | 4402A | |
| 10 uL seringue Hamilton | Hamilton Company | 7648-01 | |
| 32-ga Hamilton Needle | Hamilton Company | 7803-04 | Longueur sur mesure - 0.5 " |
| Neurobasal-Médias | Invitrogen | 10888-022 | |
| B-27 Supplément Minus vitamine A, 50X | Invitrogen | 12587-010 | |
| RPMI-1640 avec les médias | Mediatech | 10 à 040-CV | |
| Non-solution d'acides aminés essentiels, 100X | Mediatech | 25 à 025-CI | |
| L-Glutamine, 100X | Mediatech | 25 à 005-CI | |
| N ° 11 Scalpel jetable | Miltex | 4-411 | |
| Combo anesthésie rongeurs | n / a | n / a | Formulation de la pharmacie en interne (la kétamine 37,6 mg / mL, la xylazine 1,92 mg / mL, l'acépromazine 0,38 mg / mL) |
| Facteur de croissance humain recombinant épidermique (EGF) | StemCell Technologies | 02633 | Reconstituer à 10 ug / ml de solution concentrée |
| Recombinant Human facteur de croissance basique des fibroblastes (bFGF) | StemCell Technologies | 02634 | Reconstituer à 10 ug / ml de solution concentrée |
| SGD-75 Microscope Operation | Topcon Medical Systems | SGD-75 | Ce modèle a été abandonné |
| Formol à 10% | VWR | 95042-908 |
Références
- Chèvez-Barrios, P. Metastatic and Nonmetastatic Models of Retinoblastoma. Am. J. Pathol. 157, 1405-1412 (2000).
- Suber, M. L., Hurwitz, M. Y., Chèvez-Barrios, P., Hurwitz, R. L. Immune consequences of intraocular administration of modified adenoviral vectors. Hum. Gene Ther. 12, 833-838 (2001).
- Mallam, J. N., Hurwitz, M. Y., Mahoney, T., Chèvez-Barrios, P., Hurwitz, R. L. Efficient Gene Transfer into Retinal Cells Using Adenoviral Vectors: Dependence on Receptor Expression. Invest. Ophthalmol. Vis. Sci. 45, 1680-1687 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon