Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Generación de las células troncales nerviosas de desechados Humanos tejido cortical fetal
En este artículo
Resumen
Un método sencillo y fiable en el aislamiento y cultivo de células madre neurales en humanos descartados tejido cortical fetal se describe. Cultivos derivados de enfermedades neurológicas conocidas humanos pueden ser utilizados para la caracterización de los patológicos procesos celulares y moleculares, así como ofrecer una plataforma para evaluar la eficacia farmacológica.
Resumen
Las células madre neurales (NSC) residen en la zona ventricular neuroepitelio durante el desarrollo de la placa cortical. Estos primeros progenitores en última instancia, dan lugar a los progenitores intermedios y más tarde, los diferentes subtipos de células neuronales y gliales que forman la corteza cerebral. La capacidad de generar y ampliar NSCs humanos (los llamados neuroesferas) a partir de tejido fetal normal descarta proporciona un medio con el cual estudiar directamente los aspectos funcionales de la normalidad del desarrollo humano NSC 1.5. Este enfoque también puede ser dirigido hacia la generación de NSCs de trastornos neurológicos conocidos, ello se traduzca en la oportunidad de identificar los procesos de enfermedad que altera la proliferación de progenitores, la migración y la diferenciación de 6-9. Nos hemos centrado en la identificación de los mecanismos patológicos en humanos NSCs síndrome de Down que pueden contribuir a acelerar el fenotipo de la enfermedad de Alzheimer 10,11. Ni en vivo ni in vitro modelos de ratón se puede replicar el repertorio idéntico de genes localizados en el cromosoma humano 21.
Aquí se utiliza un método sencillo y fiable para aislar el síndrome de Down NSCs de corteza fetal humano abortado y crecer en cultivo. La metodología ofrece aspectos específicos de la recolección de los tejidos, la disección con puntos de referencia anatómicos limitado, separación celular, placas y pases de NSCs humanos. También proporcionamos algunos protocolos básicos para inducir la diferenciación de las NSCs humanos en subtipos de células más selectivo.
Protocolo
1. Preparación de soluciones y materiales para la disección y el mantenimiento de la cultura de células madre neurales
- Prepare 100 ml medio de disección (KNOCKOUT DMEM/F12, Invitogen) antes de tiempo y refrigere.
- Prepare100 ml medio de cultivo (Stem Pro NSC SFM, Invitrogen) y mantener a 37 ° C en un baño de agua.
- Prepare la celda del punto de congelación medio (KNOCKOUT DMEM/F12 10% de SFB + 5% de DMSO) para la crioconservación a largo plazo de las células.
- Si lo desea, prepare un 4% de paraformaldehído (PFA) para la fijación del tejido.
- Pinzas esterilizadas, autoclave y hojas de bisturí con mango se utiliza para la disección.
- Dejar de lado una pistola pipeta, 10 ml pipetas de transferencia, y 40 M de células colador (BD Falcon 352 340) para la disociación.
- Ponga a un lado varios platos de 10 cm de la cultura (BD) para la disección, 50 tubos de centrifugación ml (BD) para la disociación de 1,5 ml tubos de centrifugación para el almacenamiento de tejidos y el congelamiento (BD) para congelar células.
2. Aislar las células madre neurales del cerebro fetal humano
- La recolección de tejido viable inmediatamente después de la terminación del feto es vital para el éxito del procedimiento. Para los procedimientos electivos, el tiempo para obtener las muestras se pueden arreglar de antemano con el fin de minimizar el tiempo después de la muerte fetal. Los productos de la concepción se recogen dentro de las 2 horas después del procedimiento, pero lo ideal se puede lograr en los procedimientos electivos en cuestión de minutos. Los tejidos del feto con frecuencia se fragmentan. Sin embargo, en general, una parte importante del cerebro permanece intacto para la identificación visual. Limitaciones de la edad gestacional (EG) son determinados por la ley estatutaria, pero se han realizado con este protocolo entre 18-22 semanas de gestación.
- Cerebro del feto se coloca en un plato de Petri que contiene 10 ml de hielo frío KNOCKOUT DMEM/F12 solución. Identificar las diferentes partes de la corteza de puntos de referencia anatómicos. Los límites de la corteza frontal y parieto-occipital están orientadas por la intersección de la extrapolación surco central y la cisura de Silvio. Disecar el tejido de la corteza frontal anterior al surco central ya lo largo de la frontera de la cisura de Silvio con cuchillas quirúrgicas, asegurándose de mantener el ventrículo intacto y sin daños.
- Eliminar cualquier residuo de sangre y las meninges del bloque separado de la corteza frontal. Si la muestra es de suficiente calidad, es ideal para diseccionar el bloque en varias muestras más pequeñas para diversos fines: secciones (fija en el 4% de paraformaldehído, PFA) y la proteína / ARNm ensayos (rápido congelado en -80 ° C).
- Transferencia del bloque cerebro selecciona a un tubo de centrífuga de 50 ml, y añadir helada KNOCKOUT DMEM/F12 solución en aproximadamente 3 veces el volumen del tejido. Suavemente disociar el tejido con la pipeta mecánica con una pipeta de transferencia de 10 ml hasta que todos los tejidos se fragmenta (por lo general 20-30 horas), y luego filtrar las células a través de un filtro de 40 micras de células (BD Falcon 352 340) para obtener una sola célula o cerca de suspensión.
- Se centrifuga la suspensión celular a 2000 rpm y la temperatura ambiente durante 5 minutos, resuspender el botón celular en 10 ml de medio de cultivo fresco caliente (Stem Pro NSC SFM), y contar el número de células con un hemocitómetro.
- Añadir 5 ml de medio de cultivo caliente en frascos cada 25 cm 2 cultura, y la transferencia de 2X10 6 celdas a cada frasco. Cultivos se mantienen en un 37 ° C / 5% CO 2 incubadora durante 1 semana antes del análisis. Cambiar la mitad de la media una vez por semana para que las culturas más o experimentos.
3. Manipulaton de las células madre neuronales para la caracterización adicional o experimentaciones
- Neuroesferas generalmente se forman en 1 a 2 semanas bajo las condiciones de cultivo se recomienda con un diámetro de NSC oscilan entre los 200 y 400 micras. Neuroesferas en esta etapa se puede disociar con 0,2 g / L de EDTA libre de calcio y magnesio medio Hanks (Hanks) a 37 ° C durante 15 minutos para obtener células individuales. Suspensión de células se centrifugan a 2000 rpm, lavadas en agua dulce Hanks, y replated en medio de cultivo de abrigo para la subcultura.
- Para iniciar la diferenciación, las células disociadas se colocan en poly-D-lysine/laminin un cubreobjetos recubiertos con una densidad de 1x10 5 células por cubreobjetos (24mmX24mm). La diferenciación de oligodendrocitos se logra mediante el mantenimiento de las células en KNOCKOUT DMEM/F12 (Invitrogen, principal, MD) 2% B27 (50X, Invitrogen, principal, MD) 10 ng / ml bFGF 100 ng / ml + SHH 10ng/ml PDGF-AA dos días, luego de cambiar al mismo medio sin los factores de crecimiento por otros 5 días. Diferenciación neuronal se logra mediante el mantenimiento de las células en KNOCKOUT DMEM/F12 2% B27 (50X) durante 7 días. La diferenciación de astrocitos se realiza el cultivo de células en un KNOCKOUT DMEM/F12% de SFB durante una semana.
- La transfección de células madre neurales con los genes se puede hacer con células disociadas de las neuroesferas preformada. En este sentido, mostraron que las células madre neurales transfectadas con EGFP-C1 de la electroporación. La electroporación de EGFP-C1 construcción se realizó mediante kits Amaxa Nucleofector de células madre neurales (VPG-1004) con Amaxa dispositivo Nucleofector (Lonza AAD-1001), siguiendo las instrucciones de la empresa. En resumen, 5 mg de ADN con 1 x 10 6 células se mezclan con 100 l medio de transfección, y después de la electroporación de pulso, se resuspendieron las células en las células madre neurales mantener medio de cultivo adicional. La diferenciación de las células transfectadas fueron procesados con la disociación de los días neuroesferas 3-4 después de la electroporación, siguiendo los mismos procedimientos descritos en el paso 3.2.
4. Congelar las células madre neurales y las subculturas
- Suspensiones de células disociadas se centrifugan y se resuspenden en medio de congelación con una concentración de 1x10 7 células / frasco / ml. Poco a poco congelar las células a -20 ° C, -80 ° C, entonces la transferencia de nitrógeno líquido para su almacenamiento a largo plazo.
- Las células se descongelan rápido con 37 ° C baño de agua caliente y resuspendido en DMEM/F12 10% de suero de un lavado, se centrifuga para eliminar el medio de congelación, y resuspendido en el medio de cultivo caliente.
5. Los resultados representativos:
Las células madre neurales de un feto normal de 18 semanas de edad gestacional se cultivaron siguiendo los métodos descritos y neuroesferas se puede ver después de una semana con todo, bordes suaves y de tamaño bastante homogénea (Fig.2a). Estos neuroesferas pueden ser transfectadas con EGFP-C1 o de otras construcciones y seguir bajo el microscopio de fluorescencia (Fig.2b,). Neuroesferas se establecieron entonces disocian con EDTA y se sembraron las células dispersas en cubreobjetos recubiertos. Células diferenciadas en los respectivos protocolos fueron fijadas con 4% parafamaldehyde, y teñidas con marcadores de diferentes tipo de células específicas. Multipotencialidad se observa con expresión de marcadores indicativos de las neuronas (Fig2C, D, rodamina) astrocitos (Fig2E, F, rodamina) y oligodendrocitos (Fig2G, H, rodamina). Las células no sometido a la electroporación de EGFP se diferencian también en diferentes tipos de células y se tiñen con marcadores de células específicas diferentes. Multipotencialidad se observa con expresión de marcadores indicativos de las neuronas (Fig3A, B, fluoresceína) astrocitos (Fig3C, rodamina y Fig3D, fluoresceína) y oligodendrocitos (Fig3E, F, rodamina).
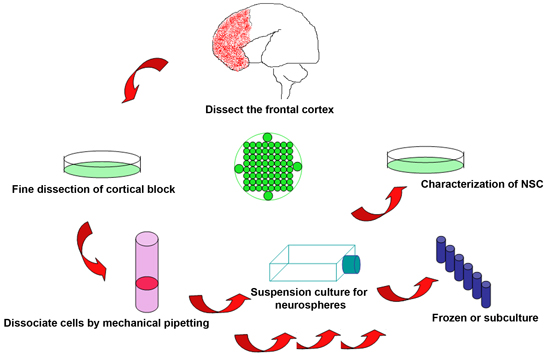
Figura 1. Esquema del procedimiento experimental para aislar las células madre neurales del cerebro fetal humano descartados

Figura 2. Indiferenciadas y diferenciadas las células neuronales humanas propagado in vitro. (A) neuroesferas se muestran bajo el microscopio de contraste de fase muestran bordes suaves, redondos y un rápido crecimiento después de la cultura durante más de una semana. (B) introducción de diversos plásmidos y las construcciones se puede lograr a través de la transfección. Tres días después de EGFP-C1 transfección, las células múltiples muestran una expresión de la proteína fluorescente verde como se ve en la inmunotinción fluoresceína y microscopía de fluorescencia. EGFP-C1 neuroesferas transfectadas no están asociadas y diferenciadas en condiciones diferentes a las neuronas (C, D), los astrocitos (E, F) y oligodendrocitos (G, H) y visto en la fluorescencia de rodamina. Al mismo tiempo, las células transfectadas EGFP positivos se presentan en fluoresceína fluorescencia. Las células transfectadas (cabezas flecha blanca) son indistinguibles de las células no transfectadas (flechas blancas). Los núcleos celulares se tiñen con Hoechst33342. Las barras de escala de 200 m para A, 100 micras para B y 25 micras de CH.
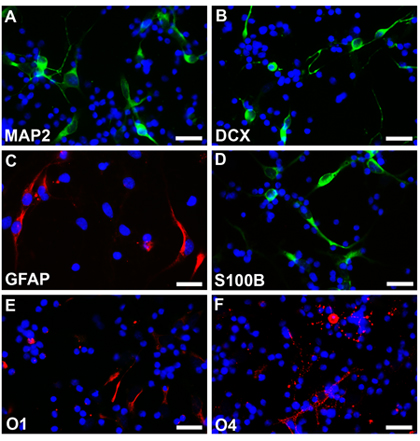
Figura 3. Neuroesferas sin transfección se disocian y diferenciada en diferentes condiciones en las neuronas (A, B, fluoresceína), los astrocitos (C, rodamina, D, fluoresceína) y oligodendrocitos (E, F, rodamina). Los núcleos celulares se tiñen con Hoechst33342. Las barras de escala son de 25 micras para la AF.
Access restricted. Please log in or start a trial to view this content.
Discusión
Existen varios enfoques hacia el cultivo de tejidos frescos y la producción de líneas celulares humanas. Históricamente, el tejido fresco ha sido cosechados y cultivados de inmediato para generar diversos tipos de células en el sistema nervioso central. Esta estrategia, sin embargo está claramente limitado por el número de muestras que se pueden obtener, que en el caso de muestras humanas, suele ser bastante pequeña. Teniendo en cuenta el grado mínimo de la manipulación, las células neuronales cultivadas reci?...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Este trabajo fue apoyado en parte por los Institutos Nacionales de Salud: HD054347 y NS063997-01 de VLS. Este trabajo también fue apoyado en parte por el Fondo Empire State de células madre a través del Estado de Nueva York Departamento de Salud Contrato # C024324 de VLS. Las opiniones expresadas aquí son de exclusiva responsabilidad del autor y no reflejan necesariamente el parecer de la Junta del Empire State de Células Madre, el Estado de Nueva York Departamento de Salud, o el Estado de Nueva York. VLS es un Doris Duke destinatario científico clínico Premio del Desarrollo. También agradecemos el profesor Timothy Vartanian por su don de Anti-O1, O4 Anti-anticuerpos.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| KNOCKOUT DMEM/F12 | Invitrogen | 12660-012 | Disociación medio |
| Madre Pro NSC SFM | Invitrogen | A10509-01 | Medio de cultivo |
| De suero fetal bovino | Invitrogen | 10091-148 | Medio congelados |
| Hanks solución (-Ca 2 +, Mg 2 +) | Invitrogen | 14175-095 | Disociación medio |
| DMSO | Sigma-Aldrich | D2650 | Medio congelados |
| EDTA | Sigma-Aldrich | 431788 | Disociación medio |
| Paraformaldehído | Sigma-Aldrich | 158127 | La fijación de una solución |
| bFGF | I + D | 234-FSE | Diferenciación medio |
| SHH | I + D | 1845-SH | Diferenciación medio |
| PDGF-AA | I + D | 221-AA | Diferenciación medio |
| B27 | Invitrogen | 17504-044 | Diferenciación medio |
| Ratón anti-MAP2 | Sigma-Aldrich | M2320 | 1:200 |
| De conejo anti-DCX | Señalización celular | 4604s | 1:200 |
| De conejo anti-GFAP | Dako | Z0334 | 1:200 |
| De conejo anti-S100B | Dako | Z0311 | 1:200 |
| De conejo anti-O1 | dones del profesor Timothy Vartanian * | 01:50 | |
| De conejo anti-O4 | Regalos del profesor Timothy Vartanian * | 01:50 | |
| 40μm de células colador | BD Falcon | 352340 |
* Timothy Vartanian, MD, PhD, Departamento de Neurología y Neurociencia de la Weill Cornell Medical College, Nueva York, EE.UU.
Referencias
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r, Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities? Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados