É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Geração de células-tronco neurais de Discarded tecido fetal humano Cortical
Neste Artigo
Resumo
Um método simples e confiável sobre o isolamento e cultura de células-tronco neurais de tecido fetal humano descartado cortical é descrito. Derivados de culturas humanas conhecidas doenças neurológicas podem ser usados para a caracterização de processos patológicos celular e molecular, bem como fornecer uma plataforma para avaliar a eficácia farmacológica.
Resumo
Células-tronco neurais (NSCs) residem ao longo da zona neuroepitélio ventricular durante o desenvolvimento da placa cortical. Estes progenitores início em última análise, dar origem a células progenitoras intermediário e depois, os vários subtipos de células neuronais e gliais que formam o córtex cerebral. A capacidade de gerar e expandir NSCs humanos (chamados neurospheres) de tecido normal descartados fetal fornece um meio com o qual a estudar diretamente os aspectos funcionais do desenvolvimento humano normal NSC 1-5. Esta abordagem também pode ser direcionado para a geração de NSCs a partir da conhecida distúrbios neurológicos, assim proporcionando a oportunidade de identificar processos de doenças que alteram a proliferação de células progenitoras, migração e diferenciação 6-9. Temos focado na identificação de mecanismos patológicos em humanos NSCs síndrome de Down que possam contribuir para o fenótipo da doença de Alzheimer acelerada 10,11. Nem in vivo, nem em modelos in vitro do mouse pode replicar o repertório idêntico de genes localizados no cromossomo humano 21.
Aqui nós usamos um método simples e confiável para isolar Baixo NSCs síndrome de humano abortado córtex fetal e cultivá-las em cultura. A metodologia fornece aspectos específicos da colheita do tecido dissecção, com referências anatômicas limitadas, separação de células, revestimento e passaging de NSCs humana. Nós também fornecemos alguns protocolos básicos para induzir diferenciação de NSCs humana em subtipos de células mais seletivo.
Protocolo
1. Preparação de soluções e materiais para dissecção e manutenção da cultura de células-tronco neurais
- Prepare 100 ml de médio dissecção (KNOCKOUT DMEM/F12, Invitogen) antes do tempo e leve à geladeira.
- Prepare100 meio de cultura ml (Stem Pro NSC SFM, Invitrogen) e manter a 37 ° C em banho-maria.
- Prepare-congelamento de células médias (10% KNOCKOUT DMEM/F12 FBS + DMSO 5%) para a criopreservação das células a longo prazo.
- Se desejar, prepare paraformaldeído a 4% (PFA) para fixação do tecido.
- Estéreis, pinças autoclavados e lâminas de bisturi com alças são usados para dissecção.
- Separe uma arma de pipeta, 10 pipetas de transferência ml, e 40 coador de células M (BD Falcon 352.340) para dissociação.
- Separe vários pratos 10 centímetros de cultura (BD) para dissecção, tubos de 50 ml de centrifugação (BD) para dissociação, 1,5 ml para tubos de centrífuga de armazenamento de tecido e frascos congelados (BD) para as células de congelamento.
2. Isolar células-tronco neurais do cérebro humano fetal
- Colheita de tecido viável imediatamente após a cessação do feto é vital para o sucesso do procedimento. Para procedimentos eletivos, o tempo para obter as amostras podem ser providenciado com antecedência, de modo a minimizar o tempo depois da morte fetal. Os produtos da concepção são colhidas dentro de 2 horas pós-procedimento, mas o ideal pode ser alcançado em procedimentos eletivos em poucos minutos. Os tecidos fetais, muitas vezes são fragmentados. No entanto, em geral, uma parcela significativa do cérebro permanece intacto para a identificação visual. Limitações da idade gestacional (IG) são determinados por lei ordinária, mas foram realizados usando este protocolo entre 18-22 semanas IG.
- Cérebro do feto é colocado em placa de Petri de 10 ml contendo gelada KNOCKOUT DMEM/F12 solução. Identificar as diferentes partes do córtex por marcos anatômicos. Limites para o córtex frontal e parieto-occipital são orientados pela interseção extrapolados do sulco central e fissura silviana. Dissecar o tecido do córtex frontal anterior ao sulco central e ao longo da fronteira da fissura silviana com lâminas cirúrgicas, certificando-se de manter o ventrículo intacto e sem danos.
- Remover qualquer resíduo de sangue e meninges do bloco separado do córtex frontal. Se a amostra for de qualidade suficiente, é ideal para dissecar o bloco em várias amostras menores para diversos fins: seções (fixados em paraformaldeído 4%, PFA) e proteína / mRNA ensaios (fast congelados em -80 ° C).
- Transferência do bloco cérebro selecionados para um tubo de centrífuga de 50 ml, e adicionar gelada KNOCKOUT DMEM/F12 solução a cerca de 3 vezes do volume do tecido. Suavemente dissociar o tecido por pipetagem mecânica com uma pipeta 10 ml até que todos os tecidos torna-se fragmentada (geralmente 20-30 vezes), e em seguida, filtrar as células através de uma célula de 40 mM filtro (BD Falcon 352340) para obter única ou quase única célula suspensão.
- Centrifugar a suspensão celular a 2000 rpm e temperatura ambiente por 5 min, ressuspender o pellet celular em 10 ml meio de cultura fresco quente (Stem Pro NSC SFM), e contar o número de células com hemocitômetro.
- Adicionar 5 ml meio de cultura quente em cada 25 cm 2 frascos de cultura, e transferência de 2x10 6 células em cada balão. Culturas são mantidas em 37 ° C / 5% incubadora de CO 2 por 1 semana antes da análise. Alterar meia o meio uma vez por semana para as culturas mais ou experimentos.
3. Manipulaton de células-tronco neurais para a caracterização adicional ou experimentações
- Neurospheres geralmente formam em 1 a 2 semanas sob as condições de cultura recomendada com diâmetro variando entre 200 NSC e 400 m. Neurospheres nesta fase pode ser dissociada com 0,2 g / L de EDTA em cálcio e magnésio livres Hanks médio (Hanks) a 37 ° C por 15 min para obter células individuais. Suspensão de células giram a 2000 rpm, lavado em Hanks fresco, e em meio de cultura replated quente para subcultura.
- Para iniciar a diferenciação, células dissociadas são semeadas em lamínulas poly-D-lysine/laminin uma revestido com uma densidade de 1x10 5 células por lamínula (24mmX24mm). Oligodendrócitos diferenciação é conseguida através da manutenção das células em KNOCKOUT DMEM/F12 (Invitrogen, Main, MD) +2% B27 (50X, Invitrogen, Main, MD) 10 ng / ml bFGF 100 ng / ml + SHH 10ng/ml PDGF-AA para dois dias, em seguida, mudar para o mesmo meio, sem fatores de crescimento por mais 5 dias. Diferenciação neuronal é alcançado pelas células manter em KNOCKOUT DMEM/F12 +2% B27 (50X) durante 7 dias. Diferenciação astrocitária é feito por cultura de células em KNOCKOUT DMEM/F12 +1% FBS por uma semana.
- Transfecção de células-tronco neurais com genes pode ser feito com células dissociada da neurospheres pré-formada. Aqui, nós mostramos que as células-tronco neurais transfectadas com EGFP-C1 por eletroporação. A eletroporação de EGFP-C1 construto foi feito usando Kits AMAXA Nucleofector de células-tronco neurais do rato (VPG-1004) com AMAXA dispositivo Nucleofector (Lonza AAD-1001), seguindo instruções da empresa. Em suma, 5 mg DNA com 1 X 10 6 células foram misturados com 100 mL meio de transfecção, e depois de eletroporação de pulso, as células foram ressuspendidas na manutenção de células-tronco neurais meio de cultura mais. A diferenciação das células transfectadas foram processados com a dissociação do dia 04/03 neurospheres após a eletroporação, seguindo os mesmos procedimentos descritos no passo 3.2.
4. Congelamento de células-tronco neurais e subculturas
- Suspensões de células dissociadas são centrifugadas e ressuspendidas em meio de congelamento, com uma concentração de 1x10 7 células / frasco / ml. Lentamente congelar as células em -20 ° C, -80 ° C, em seguida, transferir para o nitrogênio líquido para o armazenamento de longo tempo.
- As células são rápidas descongelado com 37 ° C banho-maria e ressuspenso em 10% aquecido DMEM/F12 soro para uma lavagem, centrifugação para remover o meio de congelamento, e ressuspenso em meio de cultura aquecido.
5. Resultados representativos:
Células-tronco neurais de um feto normal com 18 semanas de idade gestacional foram cultivadas seguindo os métodos descritos e neurospheres pode ser visto depois de uma semana com a rodada, bordas lisas e tamanho razoavelmente homogêneo (Fig.2A). Estes neurospheres pode ser transfectadas com EGFP-C1 ou outras construções e seguiu sob microscopia de fluorescência (Fig.2B). Neurospheres estabelecidos foram, então, dissociado com EDTA e banhado como células dispersos em lamínulas revestido. Células diferenciadas no âmbito dos protocolos respectivas foram fixados com parafamaldehyde 4%, e corados com marcadores de células diferentes tipo específico. Multipotencialidade é observada com expressão de marcadores indicativos de neurônios (Fig2C, D, rodamina) astrócitos (Fig2E, F, rodamina) e oligodendrócitos (Fig2G, H, rodamina). As células não submetidas a eletroporação de EGFP também foram diferenciadas em diferentes tipos de células e corados com diferentes marcadores celulares específicos. Multipotencialidade é observada com expressão de marcadores indicativos de neurônios (Fig3A, B, fluoroscein) astrócitos (Fig3C, rodamina e Fig3D, fluoroscein) e oligodendrócitos (Fig3E, F, rodamina).
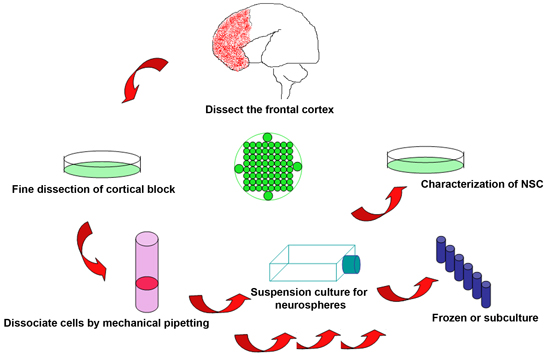
Figura 1. Esquemática do procedimento experimental para isolar células-tronco neurais de descartados cérebro humano fetal

Figura 2. Indiferenciado e diferenciada células neurais propogated in vitro. (A) Neurospheres são mostrados sob microscopia de contraste de fase demonstram lisa, bordas arredondadas e de crescimento rápido após cultura por mais de uma semana. (B) Introdução de plasmídeos várias construções e pode ser alcançado através de transfecção. Três dias após EGFP-C1 transfecção, várias células mostram expressão da proteína verde fluorescente como pode ser visto sob fluoroscein imunocoloração e microscopia de fluorescência. EGFP-C1 neurospheres transfectadas são dissociados e diferenciada sob diferentes condições em neurônios (C, D), os astrócitos (E, F) e oligodendrócitos (G, H) e visto sob fluorescência rodamina. Ao mesmo tempo, as células transfectadas EGFP positivos são mostrados sob fluoroscein fluorescência. Células transfectadas (cabeças de seta branca) são indistinguíveis de células untransfected (setas brancas). Os núcleos das células são corados com Hoechst33342. Barras de escala são 200 mm para A, 100 mm para B e 25 mm para CH.
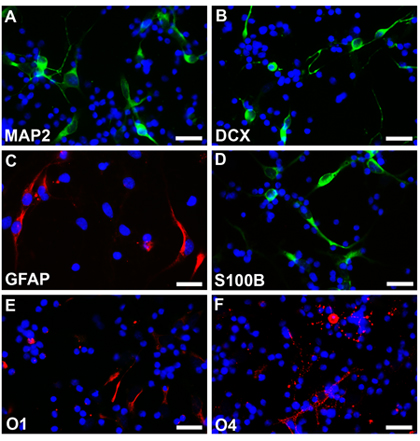
Figura 3. Neurospheres sem transfecção são dissociados e diferenciada sob diferentes condições em neurônios (A, B, fluoroscein), astrócitos (C, rodamina, D, fluoroscein) e oligodendrócitos (E, F, rodamina). Os núcleos das células são corados com Hoechst33342. Barras de escala são de 25 mm para AF.
Discussão
Existem várias abordagens para a cultura de tecidos frescos e produzir linhas de células humanas. Historicamente, tecido fresco foi colhido e imediatamente cultivadas para gerar vários tipos de células no sistema nervoso central. Essa abordagem, porém, é claramente limitado pelo número de amostras que podem ser obtidos, que no caso de amostras humanas, é geralmente muito pequena. Dado o grau mínimo de manipulação, recém-cultura de células neurais fornecer o sistema mais confiável experimental, limitando ar...
Divulgações
Agradecimentos
Este trabalho foi financiado em parte pelos Institutos Nacionais de Saúde: HD054347 e NS063997-01 a VLS. Este trabalho também foi apoiado em parte pelo Fundo Célula-tronco através de Empire State de Nova York Secretaria de Estado da Saúde Contrato # C024324 para VLS. As opiniões aqui expressas são da exclusiva responsabilidade do autor e não necessariamente refletem as do Conselho de Célula-Tronco Empire State, o New York State Department of Health, ou o Estado de Nova York. VLS é um Doris Duke Clinical Scientist Award Recipient Desenvolvimento. Agradecemos também Professor Timothy Vartanian por seu dom de Anti-O1, Anti-O4 anticorpos.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| KNOCKOUT DMEM/F12 | Invitrogen | 12660-012 | Dissociação médio |
| Pro-tronco NSC SFM | Invitrogen | A10509-01 | Meio de cultura |
| Soro fetal bovino | Invitrogen | 10091-148 | Médio congelados |
| Hanks solução (-Ca 2 +,-Mg 2 +) | Invitrogen | 14175-095 | Dissociação médio |
| DMSO | Sigma-Aldrich | D2650 | Médio congelados |
| EDTA | Sigma-Aldrich | 431788 | Dissociação médio |
| Paraformaldeído | Sigma-Aldrich | 158127 | Solução de fixação |
| bFGF | R & D | 234-FSE | Meio de diferenciação |
| SHH | R & D | 1845-SH | Meio de diferenciação |
| PDGF-AA | R & D | 221-AA | Meio de diferenciação |
| B27 | Invitrogen | 17504-044 | Meio de diferenciação |
| Rato Anti-MAP2 | Sigma-Aldrich | M2320 | 1:200 |
| Coelho Anti-DCX | Sinalização celular | 4604s | 1:200 |
| Coelho anti-GFAP | DAKO | Z0334 | 1:200 |
| Coelho anti-S100B | DAKO | Z0311 | 1:200 |
| Coelho Anti-O1 | dons do Professor Timothy Vartanian * | 01:50 | |
| Coelho Anti-O4 | Dons do Professor Timothy Vartanian * | 01:50 | |
| 40μm coador celular | BD Falcon | 352340 |
* Timothy Vartanian, MD, PhD, Departamento de Neurologia e de Neurociência, Weill Cornell Medical College, New York, EUA
Referências
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r., Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados