Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Atılan İnsan Fetal Kortikal Doku Sinir Kök Hücre Üretimi
Bu Makalede
Özet
Atılır insan fetal kortikal doku sinir kök hücrelerin izolasyonu ve kültürü üzerinde basit ve güvenilir bir yöntem açıklanmıştır. Bilinen insan nörolojik bozukluklar türetilen Kültürler farmakolojik etkinliğini değerlendirmek için bir platform sağlamak gibi, hücresel ve moleküler patolojik süreçleri karakterizasyonu için kullanılabilir.
Özet
Nöral kök hücreler (NSC'lerde) kortikal plak gelişimi sırasında ventriküler zon neuroepithelium boyunca bulunur. Bu ilk atalarıdır sonuçta ara atalarıdır yol açan ve daha sonra, serebral korteks oluşturan çeşitli nöronal ve glial hücre alt tipleri. Atılır, normal fetal doku, insan NSC'lerde (böylece neurospheres denir) oluşturmak ve genişletmek için kapasite doğrudan normal insan MGK geliştirme 1-5 fonksiyonel yönlerini incelemek için bir araç sağlar. Bu yaklaşım aynı zamanda, böylece progenitör proliferasyon, göç ve farklılaşma 6-9 değiştiren hastalık süreçleri tanımlamak için fırsat karşılayabilme bilinen nörolojik bozukluklar NSC'lerde nesil doğru olabilir . Biz hızlandırılmış Alzheimer hastalığı fenotip 10,11 katkıda bulunabilecek insan Down sendromu NSC'lerde patolojik mekanizmaların belirlenmesi üzerine odaklanmıştır. Ne, in vivo, ne in vitro fare modellerinde 21 insan kromozomu üzerinde bulunan genlerin aynı repertuar çoğaltabilirsiniz .
Burada iptal insan fetal korteks Down sendromu NSC'lerde kültür izole etmek ve onları büyümeye basit ve güvenilir bir yöntemi kullanabilirsiniz. Metodolojisi sınırlı anatomik işaretleri, hücre sıralama, kaplama ve insan NSC'lerde Pasajlanması doku diseksiyonu hasat belirli yönlerine sağlar. Biz de daha seçici hücre alt tiplere insan NSC'lerde farklılaşma inducing için bazı temel protokolleri sağlar.
Protokol
1. Diseksiyon ve sinir kök hücre kültürü bakımı için çözümler ve malzemelerin hazırlanması
- 100ml diseksiyonu orta (nakavt DMEM/F12, Invitogen) vaktinden önce hazırlayın ve buzdolabına kaldırın.
- Prepare100 ml kültür ortamı (Stem Pro MGK SFM, Invitrogen) ve 37 tutmak ° C su banyosu.
- Uzun süreli hücre dondurulması için hücre dondurma orta (nakavt DMEM/F12 10% FBS +% 5 DMSO) hazırlayın.
- İsterseniz, doku fiksasyonu için% 4 paraformaldehid (PFA) hazırlamak.
- Kulplu Steril, otoklavlanmış forseps ve bisturi ağızları diseksiyon için kullanılır.
- Bir pipet tabancası, 10 ml transferi pipetler, ve 40 mcM hücre disosiasyon süzgeç (BD Falcon 352.340) bir kenara koyun.
- 10 cm diseksiyon için çeşitli kültür kaplarına (BD), disosiasyon için 50 ml santrifüj tüplerine (BD), donma hücrelerin doku saklama ve donmuş şişeleri (BD) için 1,5 ml santrifüj tüplerine kenara koyun.
2. Insan fetal beyin insan sinir kök hücreleri Yalıtımlı
- Fetus sona ermesinden hemen sonra canlı doku Hasat prosedürün başarısı için hayati önem taşımaktadır. Seçmeli prosedürleri için, numune almaya zamanlama fetal ölümünden sonra zamanı en aza indirmek amacıyla önceden düzenlenmiş olabilir. 2 saat prosedürü içinde anlayışının ürünleri hasat edilir, ancak ideal bir dakika içinde seçmeli prosedürleri elde edilebilir. Fetal dokularda genellikle parçalanmış. Ancak, genel olarak beynin önemli bir bölümünü görsel kimlik için sağlam kalır. Gebelik yaşı (GA) Sınırlamalar yasal hukuk tarafından belirlenir ancak GA 18-22 hafta arasında bu protokol kullanılarak yapılmıştır.
- Fetal beyin buz nakavt DMEM/F12 çözüm içeren 10 ml Petri kabı yerleştirilir. Anatomik işaretleri korteksin farklı parçalarını tanımak. Frontal ve parieto-oksipital korteks Sınırları merkezi sulkus ve sylvian fissür ekstrapole kesiştiği odaklı. Ventrikül sağlam ve hasarsız tutmak için emin olun, merkezi sulkus ön frontal korteks ve cerrahi bıçaklar ile sylvian fissür sınırındaki doku parçalara ayır.
- Frontal korteks ayrılan blok herhangi bir kalıntı kan ve meninks çıkarın. Örnek yeterli kalitede ise, çeşitli amaçlar için birkaç küçük örnekleri içine blok incelemek için idealdir: bölümler (PFA,% 4 paraformaldehid sabit) ve protein / mRNA testleri (hızlı -80 ° C donmuş).
- Seçilen beyin blok 50 ml santrifüj tüpüne aktarın ve hakkında 3 kez doku hacmi az buz nakavt DMEM/F12 çözüm eklemek. 10 ml transfer pipetle yavaşça mekanik pipetleme doku ayrıştırmaları tüm dokulara kadar (genellikle 20-30 kez) parçalanmış olur ve daha sonra tek ya da yakın tek bir hücre elde etmek için 40 mcM hücre süzgeç (BD Falcon 352.340) ile hücrelerin filtre süspansiyon.
- Hücre süspansiyonu 2000 rpm ve oda sıcaklığında 5 dakika süreyle santrifüj, 10 ml taze sıcak bir kültür ortamı (Stem Pro MGK SFM) hücre pelletini tekrar süspansiyon ve hemasitometre ile hücre sayısını.
- 5 ml sıcak bir kültür ortamı, her biri 25 cm 2 kültür şişeler içine ekleyin ve her balona 2x10 6 hücre transferi. Kültürler 37 korunur ° C /% 5 CO 2 inkübatör analizden önce 1 hafta boyunca. Daha fazla kültür ve deneyler için haftada bir kez yarım orta değiştirin.
3. Nöral kök hücreler daha fazla karakterizasyonu veya deneylerine için Manipulaton
- Neurospheres genellikle MGK çapı 200 ve 400 mikron arasında değişen, önerilen kültür koşulları altında 1 ila 2 hafta form. Neurospheres bu aşamada tek hücre elde etmek için 15 dakika süreyle 37 kalsiyum ve magnezyum ücretsiz Hanks orta (Tom Hanks) 0.2 g / L EDTA ° C ile ayrıştırıldı olabilir. Hücreler süspansiyonu, taze Hanks durulanır 2000 rpm döndü ve altkültürün sıcak kültür ortamı replated.
- Farklılaşma başlatmak için, ayrışmış hücreleri lamel başına 1x10 5 hücreleri (24mmX24mm) yoğunluğu poly-D-lysine/laminin 1 kaplı lamelleri kaplanmıştır. Oligodendrosit farklılaşması için nakavt DMEM/F12 (Invitrogen, Ana, MD) +2% B27 (50X, Invitrogen, Ana, MD) 10 ng / ml bFGF 100 ng / ml SSH + 10 ng PDGF-AA hücreleri koruyarak elde edilir 2 gün sonra 5 gün süreyle büyüme faktörleri olmadan aynı ortama geçiş. 7 gün boyunca nöronal farklılaşma nakavt muhafaza hücreleri tarafından DMEM/F12 +2% B27 (50X) elde edilir. Astrosit farklılaşma, bir hafta boyunca nakavt DMEM/F12% 1 FBS kültür hücreleri tarafından yapılır.
- Genleri ile nöral kök hücreler Transfeksiyon preformed neurospheres ayrı hücreleri ile yapılabilir. Burada, nöral kök hücreler elektroporasyon EGFP-C1 ile transfekte gösterdi. EGFP-C1 inşa elektroporasyon (Fare Nöral Kök Hücreler AMAXA Nucleofector Kitleri kullanılarak yapıldı VPGŞirketin talimat aşağıdaki AMAXA Nucleofector Device (Lonza AAD-1001), 1004). Kısacası, 1 X 10 6 hücreleri ile 5 mg DNA 100 ul transfeksiyon orta ile karışık, ve darbe elektroporasyon sonra, hücreleri, sinir kök hücreleri daha fazla kültür ortamı sürdürmek yeniden süspanse edildi. Transfekte hücrelerin farklılaşması adım 3.2 'de açıklanan aynı prosedürler izlenerek, neurospheres elektroporasyon sonra 3-4 gün ayrışma ile işlendi.
4. Donma sinir kök hücreleri ve altkültürlerin
- Grubuyla aynı hücre süspansiyonları 1x10 7 hücre / flakon / ml 'lik bir konsantrasyon ile santrifüj ve donma ortamda yeniden süspanse. -20 ° C, -80 hücrelerin yavaş yavaş dondurma ° C için sıvı nitrojen aktarmak sonra da uzun süre depolama.
- Hücreler hızlı 37 ile çözülmüş ° C su banyosu ve yeniden süspanse +10% serum DMEM/F12 bir yıkama için ısındı, donma orta kaldırmak için santrifüj ve ısıtılmış bir kültür ortamı yeniden bekletildi.
5. Temsilcisi Sonuçlar:
Sinir kök hücreleri normal bir fetus gebelik yaşı 18 hafta açıklanan yöntem ve neurospheres, yuvarlak, düzgün sınırları ve oldukça homojen bir boyutu (Fig.2A) ile bir hafta sonra görülebilir kültüre edildi. Bu neurospheres EGFP-C1 veya diğer yapıları ile transfekte ve floresan mikroskobu (Fig.2B) altında takip edilebilir. Daha sonra kurulan neurospheres EDTA ile kaplı lamelleri üzerinde dağınık hücreler olarak ayrışmış ve kaplama. % 4 parafamaldehyde ile ilgili protokol çerçevesinde farklılaşmış hücreler sabit ve farklı hücre tipi özel işaretleri ile boyandı. Multipotentiality (Fig2E, F, rodamin) astrositler (Fig2C, D, rodamin) nöronların gösterge işaretleri ve oligodendrosit (Fig2G, H, rodamin) ifadesi ile görülmektedir. EGFP, elektroporasyon geçirmiş hücrelerin farklı hücre türlerine de farklılaşmış ve farklı hücre özel işaretleri ile boyandı. Multipotentiality (Fig3C, rodamin ve Fig3D, fluoroscein) astrositler (Fig3A, B, fluoroscein) nöronların gösterge işaretleri ve oligodendrosit (Fig3E, F, rodamin) ifadesi ile görülmektedir.
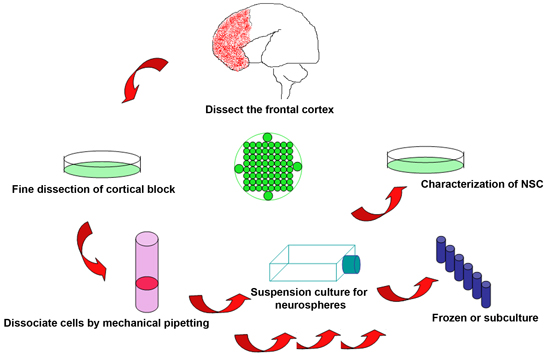
Şekil 1 atılır insan fetal beyin sinir kök hücreleri izole etmek için deneysel işlemin şematik

Şekil 2, in vitro propogated ayrım yapılmamış ve farklı insan sinir hücrelerinin . (A) Neurospheres pürüzsüz, yuvarlak sınırları ve kültür üzerinden 1 hafta sonra hızlı bir büyüme gösteren faz kontrast mikroskobu altında gösterilmiştir. (B) çeşitli plazmid ve yapıları Giriş transfeksiyon ile elde edilebilir. EGFP-C1 transfeksiyon izleyen üç gün, birden fazla hücre fluoroscein immün floresan mikroskobu altında görülebilen yeşil flüoresan protein ekspresyonu göstermektedir. EGFP-C1 transfekte neurospheres nöronları (C, D), astrositler (E, F) ve oligodendrosit (G, H) içine farklı koşullar altında, ayrışmış ve farklılaştırılmış ve rodamin floresan altında görülmektedir. Aynı zamanda, transfekte EGFP pozitif hücrelerin fluoroscein floresan altında gösterilmiştir. Transfekte hücreleri (beyaz ok uçları) untransfected hücreleri (beyaz oklar) ayırt edilemez. Hücre çekirdekleri Hoechst33342 ile boyandı. Ölçeği çubuklar 200 mikron A, B için 100 mikron ve 25 mikron CH için.
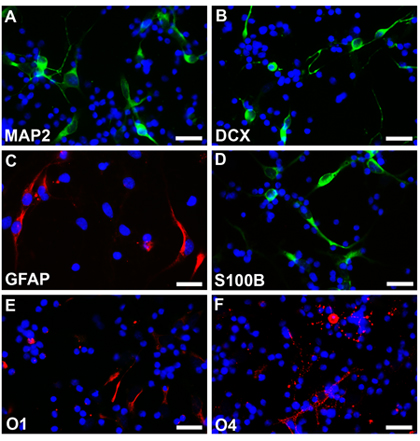
Şekil 3 transfeksiyon olmadan Neurospheres ayrışmış ve farklı nöronların (A, B, fluoroscein), astrositler (C rodamin, D, fluoroscein) ve oligodendrosit (E, F, rodamin) içine farklı koşullar altında. Hücre çekirdekleri Hoechst33342 ile boyandı. Ölçeği bar AF için 25 mikron.
Tartışmalar
Kültür taze doku ve üreten insan hücre hatları yönelik çeşitli yaklaşımlar vardır. Tarihsel olarak, taze doku hasat ve merkezi sinir sisteminde çeşitli hücre tipleri oluşturmak için hemen kültür. Bu yaklaşım, ancak net bir şekilde elde durumda insan örnekleri için, genellikle oldukça küçük olabilir örneklerinin sayısı ile sınırlıdır. Minimal manipülasyon derecesi göz önüne alındığında, taze kültür sinir hücreleri uzun kültür potansiyel eserler sınırlayarak en güvenilir d...
Açıklamalar
Teşekkürler
HD054347 ve NS063997-01 VLS için: Bu çalışma Ulusal Sağlık Enstitüleri tarafından desteklenmektedir. Bu çalışma aynı zamanda New York Dışişleri Bakanlığı aracılığıyla Sağlık Sözleşme # C024324 VLS Empire State Kök Hücre Fonu tarafından desteklenmiştir. Burada ifade edilen görüşler yalnızca yazarın aittir ve ille de Empire State Kök Hücre Kurulu, New York Eyaleti Sağlık Departmanı, ya da New York Devlet yansıtmamaktadır. VLS Doris Duke Klinik Scientist Gelişim Ödülü Alıcı. Ayrıca Profesör Timothy Vartanian Anti-O1, Anti-O4 antikorlar onun hediye için teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifin Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
|---|---|---|---|
| Nakavt DMEM/F12 | Invitrogen | 12660-012 | Disosiyasyon orta |
| Kök Pro MGK SFM | Invitrogen | A10509-01 | Kültür ortamı |
| Fetal sığır serumu | Invitrogen | 10091-148 | Dondurulmuş orta |
| Hanks çözümü (-Ca 2 +,-Mg 2 +) | Invitrogen | 14175-095 | Disosiyasyon orta |
| DMSO | Sigma-Aldrich | D2650 | Dondurulmuş orta |
| EDTA | Sigma-Aldrich | 431788 | Disosiyasyon orta |
| Paraformaldehit | Sigma-Aldrich | 158127 | Fiksasyon çözüm |
| bFGF | Ar-Ge | 234-FSE | Farklılaşma orta |
| SSH | Ar-Ge | 1845-SH | Farklılaşma orta |
| PDGF-AA | Ar-Ge | 221-AA | Farklılaşma orta |
| B27 | Invitrogen | 17504-044 | Farklılaşma orta |
| Fare anti-map2 | Sigma-Aldrich | M2320 | 1:200 |
| Tavşan anti-DCX | Hücre sinyal | 4604s | 1:200 |
| Tavşan anti-GFAP | DAKO | Z0334 | 1:200 |
| Tavşan anti-S100B | DAKO | Z0311 | 1:200 |
| Tavşan anti-O1 | Profesör Timothy Vartanian hediyeler * | 01:50 | |
| Tavşan anti-O4 | Profesör Timothy Vartanian hediyeler * | 01:50 | |
| 40μm hücre süzgecinden | BD Falcon | 352340 |
* Timothy Vartanian, MD, PhD, Nöroloji ve Nörobilim, Weill Cornell Medical College, New York, ABD Bölümü
Referanslar
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r., Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır