Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Генерация нервные стволовые клетки из эмбриона человека Выкинуть корковой ткани
В этой статье
Резюме
Простой и надежный метод изоляции и культуры нервных стволовых клеток из выброшенных человеческого плода корковой ткани описано. Культуры, полученные из известных человеческих неврологические расстройства могут быть использованы для характеристики патологических клеточных и молекулярных процессов, а также обеспечит платформу для оценки фармакологической эффективности.
Аннотация
Нервные стволовые клетки (NSCs) проживают вместе нейроэпителия зоны желудочков во время развития кортикальной пластинки. Эти ранние предшественники в конечном счете привести к промежуточной прародителей и позже, различных нервных и глиальных клеток подтипов, которые образуют кору головного мозга. Способность генерировать и расширить человеческие NSCs (так называемые нейросферы) из выброшенных нормальной эмбриональной ткани обеспечивает средства, с которыми непосредственно изучать функциональные аспекты нормального человеческого развития НСК 1-5. Этот подход может также быть направлена на генерацию NSCs от известных неврологических расстройств, тем самым предоставив возможность определить болезненные процессы, которые изменяют предшественников пролиферации, миграции и дифференциации 6-9. Мы сосредоточились на выявлении патологических механизмов в человеческом Вниз NSCs синдром, который может способствовать болезни фенотип ускоренного Альцгеймера 10,11. Ни в естественных условиях, ни в лабораторных мышах может повторить идентичных репертуар генов, расположенных на хромосомы человека 21.
Здесь мы используем простой и надежный способ, чтобы изолировать синдромом Дауна NSCs из абортированных человеческих эмбриональных коры и вырастить их в культуру. Методология предусматривает конкретные аспекты уборки ткани, рассечение с ограниченными ориентиры анатомические, сортировки клеток, покрытий и пассажи человека NSCs. Мы также предоставляем некоторые основные протоколы для индукции дифференциации человеческого NSCs в более избирательным подтипа клетки.
протокол
1. Приготовление растворов и материалов для вскрытия и поддержание культуры нейронных стволовых клеток
- Подготовка 100мл рассечение среды (KNOCKOUT DMEM/F12, Invitogen) заранее и поставить в холодильник.
- Prepare100 мл культуральной среды (Stem Pro НСК SFM, Invitrogen) и хранить при температуре 37 ° С на водяной бане.
- Подготовка клеточного замораживания среды (KNOCKOUT DMEM/F12 +10% FBS + 5% ДМСО) на длительный срок криоконсервации клеток.
- При необходимости, подготовить 4% параформальдегида (PFA) для фиксации ткани.
- Стерильные, автоклавного щипцы и скальпель лезвиями с ручками используются для вскрытия.
- Установите в сторону пистолет пипетки, пипетки 10 мл передачи, и 40 мкМ ячейки фильтра (BD Сокол 352340) для диссоциации.
- Отложите несколько 10 см культуры блюд (BD) для вскрытия, 50 мл центрифужные пробирки (BD) для диссоциации, 1,5 мл пробирки центрифуги для хранения замороженных тканей и флаконах (BD) для замораживания клеток.
2. Изоляция человеческих нервных стволовых клеток из человеческого мозга плода
- Заготовка жизнеспособные ткани сразу после окончания плода является жизненно важным для успеха процедуры. Для выборных процедур, сроки получить образцы могут быть организованы заранее, таким образом, чтобы минимизировать время после гибели плода. Продукты зачатия собирают в течение 2 часов после процедуры, но в идеале может быть достигнуто на выборные процедуры в течение нескольких минут. Фетальных тканей часто носят фрагментарный характер. Однако в целом значительная часть мозга остается неизменным для визуальной идентификации. Ограничения гестационного возраста (GA) определяются статутного права, но были выполнены с помощью этого протокола между 18-22 неделями GA.
- Мозг плода помещают в 10 мл чашки Петри содержащие ледяной KNOCKOUT DMEM/F12 решение. Определить различные части коры анатомических ориентиров. Границы лобной и теменно-затылочной коре ориентированы экстраполированы пересечении центральной борозды и латеральной борозды. Рассеките тканей лобной коры кпереди от центральной борозды и вдоль границы с латеральной борозды хирургические лезвия, убедившись, что держать желудочка целости и сохранности.
- Удалить остатки крови и мозговые оболочки из разделенных блок фронтальной коры головного мозга. Если образец достаточно высокого качества, она идеально подходит, чтобы рассекать блока на несколько небольших образцов для различных целей: разделы (фиксировали в 4% параформальдегида, PFA) и белок / РНК анализы (быстро замороженных в -80 ° С).
- Передача выбранного блока мозга к 50 мл центрифужную пробирку и добавить ледяной KNOCKOUT DMEM/F12 решение примерно в 3 раза объема ткани в. Аккуратно отделить ткани от механических пипетки с пипеткой 10 мл передача, пока все ткани становится фрагментированным (как правило, в 20-30 раз), а затем фильтр клеток через 40 мкМ ячейки фильтра (BD Сокол 352 340), чтобы получить одну или вблизи одной клетки подвески.
- Центрифуга клеточной суспензии при 2000 оборотах в минуту и комнатной температуре в течение 5 мин, ресуспендируют осадок клеток в 10 мл теплой свежей питательной среды (Stem Pro НСК УЛП), и посчитайте количество клеток с гемоцитометра.
- Добавьте 5 мл теплой питательной среды на каждые 25 см 2 колбах культуры, и передача 2-10 6 ячеек в каждой колбе. Культур ведутся в 37 ° С / 5% СО 2 инкубатора в течение 1 недели до анализа. Изменение половины среду один раз в неделю для дальнейшего культур или экспериментов.
3. Manipulaton нейронных стволовых клеток для дальнейшей характеристики или экспериментов
- Нейросферы обычно формируются в 1 до 2 недель в рекомендованных условий культивирования диаметром НСК в диапазоне между 200 и 400 мкм. Нейросферы на данном этапе могут быть отделены с 0,2 г / л ЭДТА кальция и магния свободной Хэнкс среды (Хэнкс) при 37 ° С в течение 15 мин для получения одиночных клеток. Клетки подвески прядут при 2000 оборотах в минуту, промыть в пресной Хэнкс, и replated в теплую питательную среду для субкультуры.
- Для начала дифференциации, диссоциированных клетки высевают на poly-D-lysine/laminin 1 покрытием покровные при плотности 1x10 5 клеток на покровное (24mmX24mm). Олигодендроцитов дифференциация достигается путем поддержания клеток в KNOCKOUT DMEM/F12 (Invitrogen, Главное, MD) +2% B27 (50х, Invitrogen, Главное, MD) +10 нг / мл bFGF +100 нг / мл SHH + 10ng/ml PDGF-АА 2 дня, то переход к той же среде без факторов роста в течение еще 5 дней. Нейронные дифференциация достигается путем поддержания клеток в KNOCKOUT DMEM/F12 +2% B27 (50х) в течение 7 дней. Астроцитов дифференциации осуществляется путем культивирования клеток в нокаут DMEM/F12 +1% FBS в течение недели.
- Трансфекция нервных стволовых клеток с генами можно сделать с диссоциированных клеток из предварительно нейросферы. Здесь мы показали, нервные стволовые клетки трансфицированных EGFP-C1 путем электропорации. Электропорации EGFP-C1 построить было сделано с использованием AMAXA Nucleofector Наборы для мыши нервные стволовые клетки (ВПГ-1004) с AMAXA Nucleofector устройств (Lonza AAD-1001), следуя инструкции компании. Короче говоря, 5 мкг ДНК с 1 х 10 6 клеток смешивают с 100 мкл среды трансфекции, а после электропорации импульс, клетки ресуспендировали в нервные стволовые клетки поддержания среды для дальнейшего культуры. Дифференциация трансфекции клетки были обработаны с диссоциацией нейросферы 3-4 дня после электропорации, следуя той же процедуре, описанной в пункте 3.2.
4. Замораживание нервные стволовые клетки и субкультур
- Расхождение между клеточные суспензии центрифугируют и ресуспендируют в морозную среду с концентрацией 1х10 7 клеток / флакон / мл. Медленно, замораживание клеток в -20 ° С, -80 ° C и трансфер в жидком азоте в течение длительного хранения.
- Клетки быстро талой с 37 ° С водяной бане и ресуспендировали в подогретом DMEM/F12 +10% сыворотки для мытья, центрифугируют для удаления замерзания среды, и ресуспендировали в нагретой питательной среды.
5. Представитель Результаты:
Нервные стволовые клетки из нормального плода на 18 недель гестационного возраста культивируют следующие описаны методы и нейросферы можно увидеть через неделю с круглыми, гладкими границами и довольно однородный размер (рис. 2). Эти нейросферы можно трансфицированных EGFP-C1 или другие конструкции и применяемые в соответствии флуоресцентной микроскопии (рис.2б). Основанная нейросферы затем были диссоциированы с ЭДТА и высевают, как рассеянный клеток на покровных покрытием. Клетки дифференцированы в рамках соответствующих протоколов были зафиксированы с 4% parafamaldehyde, и окрашивали различные типа клеток специфических маркеров. Multipotentiality наблюдается с экспрессией маркеров свидетельствует о нейронов (Fig2C, D, родамин) астроциты (Fig2E, Ж, родамин) и олигодендроцитов (Fig2G, H, родамин). Клетки не претерпела электропорации EGFP также дифференцировались в различные типы клеток и окрашивают другой ячейке специфических маркеров. Multipotentiality наблюдается с экспрессией маркеров свидетельствует о нейронов (Fig3A, B, fluoroscein) астроциты (Fig3C, родамин и Fig3D, fluoroscein) и олигодендроцитов (Fig3E, Ж, родамин).
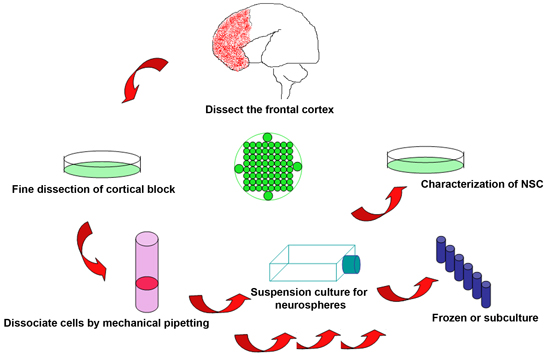
Рисунок 1. Схема экспериментальной процедуры, чтобы изолировать нервные стволовые клетки из выброшенных человеческого мозга плода

Рисунок 2. Недифференцированная и дифференцированная человеческих нервных клеток propogated в пробирке. (А) нейросферы показаны на этапе микроскопии отличие демонстрируют гладкие, круглые границы и быстрый рост после культуре более 1 недели. (Б) введение различных плазмид и конструкций может быть достигнуто путем трансфекции. Три дня после EGFP-C1 трансфекции, несколько ячеек показать выражение зеленого флуоресцентного белка, как видно по fluoroscein иммунной и флуоресцентной микроскопии. EGFP-C1 трансфицированных нейросферы разобщены и дифференцированных в различных условиях в нейроны (C, D), астроциты (E, F) и олигодендроцитов (G, H) и видел под родамина флуоресценции. Одновременно с этим, трансфицированных EGFP положительных клеток показаны под fluoroscein флуоресценции. Трансфицированных клеток (белые головки стрелка) ничем не отличаются от untransfected клеток (белые стрелки). Ядра клеток окрашиваются с Hoechst33342. Шкала бары 200 мкм, 100 мкм для B и 25 мкм для CH.
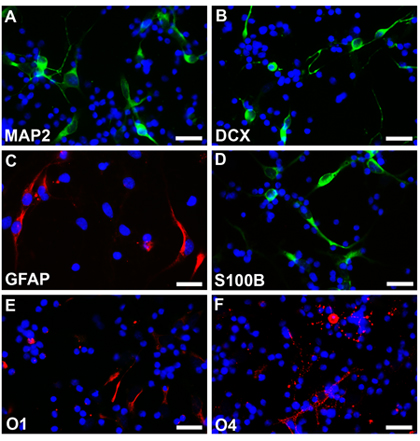
Рисунок 3. Нейросферы без трансфекции разобщены и дифференцированных в различных условиях в нейроны (A, B, fluoroscein), астроциты (С, родамин, D, fluoroscein) и олигодендроцитов (E, F, родамин). Ядра клеток окрашиваются с Hoechst33342. Шкала баров 25 мкм для автофокусировки.
Обсуждение
Существуют различные подходы к культуре свежей ткани и производство человеческих клеточных линий. Исторически сложилось так, свежей ткани были собраны и культурным сразу генерировать различные типы клеток в центральной нервной системе. Этот подход, однако, четко ограничено количест?...
Раскрытие информации
Благодарности
Эта работа была выполнена при частичной поддержке Национального института здоровья: HD054347 и NS063997-01 к VLS. Эта работа также была частично поддержана Стволовые Эмпайр-Стейт-Сотовый фонд через Нью-Йорк Департамент здравоохранения штата Договор № C024324 для VLS. Мнения, высказанные здесь, являются исключительно автору и не обязательно отражают точку зрения Стволовые Эмпайр-Стейт-Сотовый совета штата Нью-Йорк Департамент здравоохранения, и штата Нью-Йорк. VLS является Дорис Дьюк Клинические Ученый развитием получателя премии. Мы также благодарим профессора Тимоти Вартанян за его дар Anti-O1, Анти-O4 антител.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| KNOCKOUT DMEM/F12 | Invitrogen | 12660-012 | Диссоциация среда |
| Стволовые Pro НСК SFM | Invitrogen | A10509-01 | Культура среда |
| Эмбриональной телячьей сыворотки | Invitrogen | 10091-148 | Замороженные среда |
| Хэнкс решение (-Ca 2 +,-Mg 2 +) | Invitrogen | 14175-095 | Диссоциация среда |
| ДМСО | Sigma-Aldrich | D2650 | Замороженные среда |
| ЭДТА | Sigma-Aldrich | 431788 | Диссоциация среда |
| Параформальдегид | Sigma-Aldrich | 158127 | Фиксация решение |
| bFGF | R & D | 234-FSE | Дифференциация среда |
| SHH | R & D | 1845-SH | Дифференциация среда |
| PDGF-AA | R & D | 221-AA | Дифференциация среда |
| B27 | Invitrogen | 17504-044 | Дифференциация среда |
| Мышь Anti-MAP2 | Sigma-Aldrich | M2320 | 1:200 |
| Кролик Anti-DCX | Сотовые сигнализации | 4604s | 1:200 |
| Кролик Anti-GFAP | DAKO | Z0334 | 1:200 |
| Кролик Anti-S100B | DAKO | Z0311 | 1:200 |
| Кролик Anti-O1 | подарки профессора Тимоти Вартанян * | 1:50 | |
| Кролик Anti-O4 | Подарки профессора Тимоти Вартанян * | 1:50 | |
| 40 мкм ячейки фильтра | BD Сокол | 352340 |
* Тимоти Вартанян, доктор медицинских наук, доктор наук, Кафедра неврологии и неврологии, Weill Cornell Medical College, Нью-Йорк, США
Ссылки
- Gage, F. H., Ray, J., Fisher, L. J. Isolation, characterization, and use of stem cells from the CNS. Annu. Rev. Neurosci. 18, 159-192 (1995).
- Vescovi, A. L., Snyder, E. Y. Establishment and properties of neural stem cell clones: plasticity in vitro and in vivo. Brain Pathol. 9, 569-598 (1999).
- Schwartz, P., Bryant, P., Fuja, T., Su, H., O'Dowd, D., Klassen, H. Isolation and characterization of neural progenitor cells from post-mortem human cortex. J Neurosci Res. 74, 838-851 (2003).
- Martinez-Serrano, A., Rubio, F. J., Navarro, B., Bueno, C., Villa, A. Human neural stem and progenitor cells: in vitro and in vivo properties, and potential for gene therapy and cell replacement in the CNS. Curr Gene Ther. 1, 279-299 (2001).
- Rajan, P., Snyder, E. Neural stem cells and their manipulation. Methods Enzymol. 419, 23-52 (2006).
- Ruiz-Lozano, P., Rajan, P. Stem cells as in vitro models of disease. Curr Stem Cell Res Ther. 2, 280-292 (2007).
- Sheen, V., Ferland, R., Harney, M., Hill, R., Neal, J., Banham, A., Brown, P., Chenn, A., Corbo, J., Hecht, J., Folkerth, R., Walsh, C. Impaired proliferation and migration in human Miller-Dieker neural precursors. Ann Neurol. 60, 137-144 (2006).
- Bahn, S., Mimmack, M., Ryan, M., Caldwell, M., Jauniaux, E., Starkey, M., Svendsen, C., Emson, P. Neuronal target genes of the neuron-restrictive silencer factor in neurospheres derived from fetuses with Down's syndrome: a gene expression study. Lancet. 359, 310-315 (2002).
- Ferland, R. J., Batiz, L. F., Neal, J., Lian, G., Bundock, E., Lu, J., Hsiao, Y. C., Diamond, R., Mei, D., Banham, A. H. Disruption of neural progenitors along the ventricular and subventricular zones in periventricular heterotopia. Hum Mol Genet. 18, 497-516 (2009).
- Esposito, G., Imitola, J., Lu, J., De Filippis, D., Scuderi, C., Ganesh, V. S., Folkerth, R., Hecht, J., Shin, S., Iuvone, T., Chesnut, J., Steardo, L., Sheen, V. Genomic and functional profiling of human Down syndrome neural progenitors implicates S100B and aquaporin 4 in cell injury. Hum Mol Genet. 17, 440-457 (2008).
- Esposito, G., Scuderi, C., Lu, J., Savani, C., De Filippis, D., Iuvone, T., Steardo, L. J. r., Sheen, V., Steardo, L. S100B induces tau protein hyperphosphorylation via Dickopff-1 up-regulation and disrupts the Wnt pathway in human neural stem cells. J Cell Mol Med. 12, 914-927 (2008).
- Flax, J. D., Aurora, S., Yang, C., Simonin, C., Wills, A. M., Billinghurst, L. L., Jendoubi, M., Sidman, R. L., Wolfe, J. H., Kim, S. U., Snyder, E. Y. Engraftable human neural stem cells respond to developmental cues, replace neurons, and express foreign genes. Nat Biotechnol. 16, 1033-1039 (1998).
- Fults, D., Pedone, C. A., Morse, H. G., Rose, J. W., McKay, R. D. Establishment and characterization of a human primitive neuroectodermal tumor cell line from the cerebral hemisphere. J Neuropathol Exp Neurol. 51, 272-280 (1992).
- Conti, L., Cattaneo, E. Neural stem cell systems: physiological players or in vitro entities?. Nat Rev Neurosci. 11, 176-187 (2010).
- Svendsen, C. N., ter Borg, M. G., Armstrong, R. J., Rosser, A. E., Chandran, S., Ostenfeld, T., Caldwell, M. A. A new method for the rapid and long term growth of human neural precursor cells. J Neurosci Methods. 85, 141-152 (1998).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены