Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Inyección de insulina y extracción hemolinfa para medir la sensibilidad a la insulina en adultos Drosophila melanogaster
En este artículo
Resumen
Señalización de la insulina conserva las vías se encuentran en la mosca de la fruta Drosophila melanogaster Hacer de este organismo una herramienta potencial para el modelado de los trastornos metabólicos como la diabetes tipo II. Con este fin, es fundamental para establecer pruebas fisiológicas para medir efectivamente la acción sistémica a la insulina en la utilización de glucosa periférica en la mosca adulta.
Resumen
Conserva los mecanismos de detección de nutrientes existen entre los mamíferos y mosca de la fruta que se asemeja péptidos de mamíferos insulina y el glucagón, respectivamente, la función de mantener la homeostasis de la glucosa durante el desarrollo de 1,2 estadios larvarios. Los estudios sobre las moscas adultas en gran medida post-mitótico han puesto de manifiesto la perturbación de la homeostasis de la glucosa como resultado de la ablación genética de la insulina-like peptide (ILP) que producen las células (IPC) 3. Por lo tanto, las moscas adultas frutas son una gran promesa como un sistema modelo adecuado genética de los trastornos metabólicos como la diabetes tipo II. Para seguir desarrollando el sistema de mosca de la fruta, comparable pruebas fisiológicas para medir la tolerancia a la glucosa y la sensibilidad a la insulina en los mamíferos se debe establecer. Con este fin, recientemente se ha descrito un nuevo procedimiento para medir la respuesta de tolerancia oral a la glucosa en la mosca adulta y han demostrado la importancia de la IPC para adultos en el mantenimiento de la homeostasis de la glucosa 4,5. Aquí, se ha modificado el procedimiento descrito anteriormente para la inyección de insulina 6 y lo combinó con un método de extracción de hemolinfa novela para medir la sensibilidad periférica a la insulina en la mosca adulta. Excepcionalmente, el protocolo permite dirigir las mediciones fisiológicas de la capacidad de la mosca adulta de disponer de una carga de glucosa periférica tras la inyección de insulina, una metodología que hace que sea factible para caracterizar mutantes señalización de la insulina y las posibles intervenciones que afectan la tolerancia a la glucosa y la sensibilidad a la insulina en la mosca adulta.
Protocolo
1. La insulina preparación de la solución
- Prepare una solución fresca insulina bovina mediante la disolución de la insulina en PBS para alcanzar la concentración de 0,01 mg / ml. Tanto la insulina / PBS PBS y soluciones de control deben ser mantenidos en hielo durante todo el procedimiento de inyección. Estas soluciones deben prepararse con 0,5% (v / v) FD & C Azul no. Un colorante de alimentos.
2. Aguja de preparación y la inyección Puesta en marcha
- Prepare agujas capilares de vidrio utilizando una micropipeta puller.The siguientes ajustes extractor producir agujas de calidad suficiente para la inyección: Heat, 345; Pull, 210; velocidad, 100; Tiempo, 200 (100 ms). Agujas recién sacó deben ser debilitados por presionando la punta a través de un tejido Kimwipe. Este proceso elimina el embotamiento de punta alargada de alta resistencia y produce una punta más gruesos con un diámetro de poro más grande.
- Coloque las agujas punta roma en un tubo de microcentrífuga que contiene la insulina / PBS o solución de PBS. Capilar resultados de la acción en la parte trasera de llenado de cada aguja. Observe la punta de la aguja bajo un microscopio estereoscópico para asegurar que no queden burbujas de aire o restos aparecer en la punta. Deseche las agujas que no se llenen limpiamente.
- Insertar las agujas se introducen en el porta-agujas manual de microinyector y la posición del titular de la aguja con un micromanipulador para que la punta de la aguja es visible a través de un microscopio estereoscópico. Aplique una presión positiva en la columna de líquido en la aguja girando el manual de perilla microinyector micrómetro unido al émbolo de la jeringa microinyector.
- Verifique que la presión suficiente para el desplazamiento del fluido se ha aplicado al tocar un Kimwipe a la punta de la aguja y la confirmación de flujo de fluidos.
- Una vez que la aguja ha sido preparado para la inyección, colocar una tabla de calibración para el eje de la aguja con cinta adhesiva transparente, y llevar la punta de la aguja en el foco a través de un microscopio estereoscópico con 20X.
3. Preparación volar
- Diez días de edad, las moscas hembras se utilizan para los experimentos de inyección. Recoger las moscas dentro de las 24 h de la eclosión. Anestesiar a las moscas con CO 2 humidificado en un cojín de gas, tipo de hombres y mujeres moscas a cabo en viales que contienen el patrón o la dieta para el tratamiento. Mantener las moscas hembras en dietas experimentales por 10 días.
- En el décimo día después de la eclosión y la separación de las dietas experimentales, la transferencia de las moscas de sus alimentos que contienen los viales a los viales que contiene un tapón de 5 ml de 2% de agar y matarlos de hambre de 12 a 16 h.
- Transferencia de las moscas de hambre viales que contienen 10% de filtros de la glucosa en remojo durante una hora antes de la inyección de insulina.
- En pocas palabras anestesiar a las moscas con CO 2 humidificado glucosa después de comer y después inmovilizar frío en hielo.
4. Procedimiento de inyección
- Pellizque suavemente una mosca en frío inmovilizado con un par de pinzas finas y mantenerlo cerca de la punta de la aguja de modo que la punta es adyacente a la región anterior del lado izquierdo del tórax de la mosca. Llevar las dos de la punta de la aguja y el tórax de la mosca en el foco bajo el microscopio estereoscópico.
- Suavemente mueva la marcha hacia la punta de la aguja de modo que la punta de la aguja toca el centro de la protuberancia de la región prescutum izquierda del tórax de la mosca (Fig. 1). Una vez que el vuelo esté debidamente orientados y alineados con la punta de la aguja, continuar avanzando en la marcha en la aguja de modo que la aguja empala el centro de la prescutum.
- Aplicar presión positiva si es necesario mediante la mejora de émbolo de la jeringa con perilla micromanipulador la microinyector hasta 0,1 l de fluido se inyecta en la marcha. El flujo de líquido en hemocele de la mosca impartirá un color azul al lado izquierdo del tórax anterior. De vez en cuando hay que retirar y avanzar varias veces para desalojar cualquier obstrucción punta de la aguja y permitir el flujo de fluido.
- Permitir moscas inyectadas a recuperarse en los viales de agar al 2% para los puntos de tiempo determinado antes de la extracción de hemolinfa.
5. Hemolinfa Colección
- En pocas palabras anestesiar las moscas con CO 2 humidificado en los puntos de tiempo deseado después de la inyección y la posición de cada vuelo dorsal-boca abajo en cinta de doble cara colocada en la superficie de una plataforma de CO 2. Organizar las moscas, incluso en las filas con cápsulas de la cabeza alineada. Se puede utilizar un aplicador de madera recortada para presionar por sus alas en la cinta adhesiva y asegurar la inmovilización.
- Una vez que las moscas se fija a la cinta, sujete cada trompa mosca con unas pinzas finas y tire de él hacia la región ventral y posterior de la mosca de manera que la parte frontal de la cápsula de la cabeza es visible a través del microscopio estereoscópico.
- Con la otra mano y mientras mantiene la trompa en su lugar, perfore el centro de la cápsula de la cabeza justo encima de la sutura ptilinal utilizando una aguja de tungsteno agudo (Fig. 2). Hay que tener cuidado de no insertar la aguja demasiado lejos ya que es fácil de perforar la punta de la aguja a través del otro lado de la cápsula de la cabeza y, posteriormente, perder control de flujo de hemolinfa. Punción todas las moscas en un grupo de la inyección antes de recoger la hemolinfa.
- Una vez que la cápsula de la cabeza ha sido perforado, use un aplicador de madera recortada para aplicar suavemente presión sobre el abdomen de la mosca. Puede ser útil para rodar la marcha más de lo que se apoya en su parte ventral al aplicar presión. Este procedimiento produce una gota de hemolinfa en el sitio de punción cabeza cápsula.
- Toque uno de los extremos de un tubo capilar se 1μl a la gota de hemolinfa emergentes del sitio de la punción cabeza cápsula. La hemolinfa se entre en el tubo a través de la acción capilar. Determinar y registrar la cantidad de hemolinfa recogidos por el control de la columna de líquido dentro del tubo capilar con una tabla de volumen se graduó.
6. Hemolinfa la determinación de glucosa
- Expulsión de las muestras de hemolinfa en pocillos de la microplaca con 100 l de reactivo de glucosa Infinity. Mantenga la placa de hielo durante la carga de las muestras de hemolinfa.
- Establecer una curva estándar de carga por separado cada una l de soluciones de reserva de glucosa en 50 mM, 25 mm, 12,5 mm, y 6.25mM 3.125mM.
- Incubar las muestras a 37 ° C durante 10 minutos.
- Detectar la absorbancia a 340 nm.
- Cuenta para el volumen de la hemolinfa recogidos y determinar la concentración de glucosa en la muestra sobre la base de la curva estándar con concentraciones de glucosa conocidos.
7. Resultados representante
Una respuesta típica de tolerancia a la insulina se detecta en la insulina inyectada moscas cuando se detecta un descenso en los niveles circulantes de glucosa 15 minutos después de la inyección. Por el contrario, esa respuesta no se ve en las moscas de PBS inyectado (Fig. 3). Esta respuesta en la utilización de glucosa periférica continúa en la insulina inyectada vuela hasta 30 minutos después de la inyección. En forma rutinaria extraer 0.2-0.5 l de la hemolinfa por 4-5 moscas en cada grupo de la inyección. Tres grupos de inyección se incluyen en cada experimento.

Figura 1. El lado izquierdo del tórax que muestra Drosophila sitio inserción de la aguja (Modificado de Demerec, 1950) 7. Insertar la aguja en el centro de la prescutum en la región anterior, dorsal del lado izquierdo del tórax.
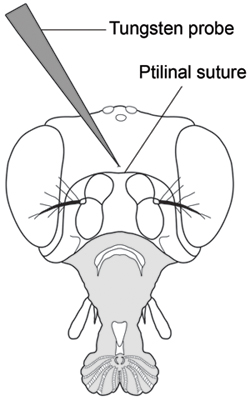
Figura 2. Vista frontal de la cabeza de Drosophila que muestra la ubicación de punción para la extracción de hemolinfa (Modificado de Demerec, 1950) 7. Perforar la cápsula de la cabeza con una sonda de tungsteno finamente afiladas en el centro de la cápsula de la cabeza justo encima de la sutura ptilinal.
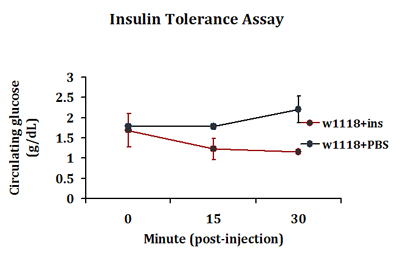
Figura 3. Una respuesta típica de tolerancia a la insulina detectada en el control de moscas adultas. Control de moscas w 1118 fueron inyectados con insulina bovina (1 ng en PBS) o PBS. Las moscas en los grupos de replicar fueron autorizados a recuperar los minutos 0, 15 ó 30 y niveles de glucosa circulante se midieron.
Discusión
La técnica descrita en este informe es potencialmente útil en cualquier estudio que investiga los procesos fisiológicos que resulta en alteraciones detectables en la composición de la hemolinfa de Drosophila. Mediante la combinación de la inyección y recolección de la hemolinfa de esta manera, es posible determinar los efectos inmediatos fisiológicamente relevantes de un determinado tratamiento experimental o manipulación. La principal ventaja de esta "sangría" técnica en la recolección de...
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por subvenciones del Servicio Nacional de YW.CF (AG21068, AG31086).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / equipo | Empresa | Número de catálogo | |
|---|---|---|---|
| Insulina bovina | Sigma | I5500 | |
| Infinito reactivo de glucosa | Thermo Electron Corporation | TR1541 | |
| Manual microinyector | Sutter Instrumento | ||
| P-87 Flamming / Brown micropipeta extractor | Sutter Instrumento | ||
| Un solo cuerpo de vidrio de borosilicato capilares | AM Sistemas | 626000 | |
| FD & C Azul N º 1 | McCormick & Company | ||
| Un tubo capilar se l | Drummond | ||
| Tres ejes manual de micromanipulador y la base | Mundial de Instrumentos de Precisión |
Referencias
- Rulifson, E. J., Kim, S. K., Nusse, R. Ablation of insulin-producing neurons in flies: growth and diabetic phenotypes. Science. 296, 1118-1118 (2002).
- Kim, S. K., Rulifson, E. J. Conserved mechanisms of glucose sensing and regulation by Drosophila corpora cardiaca cells. Nature. 431, 316-316 (2004).
- Broughton, S. J. Longer lifespan, altered metabolism, and stress resistance in Drosophila from ablation of cells making insulin-like ligands. Proc Natl Acad Sci U S A. 102, 3105-3105 (2005).
- Haselton, A. Partial ablation of adult Drosophila insulin-producing neurons modulates glucose homeostasis and extends life span without insulin resistance. Cell Cycle. 9, 3063-3063 (2010).
- Haselton, A. T., Fridell, Y. W. Adult Drosophila melanogaster as a model for the study of glucose homeostasis. Aging (Albany NY). 2, 523-523 (2010).
- Belgacem, Y. H., Martin, J. R. Disruption of insulin pathways alters trehalose level and abolishes sexual dimorphism in locomotor activity in Drosophila. J Neurobiol. 66, 19-19 (2006).
- Demerec, M. . Biology of Drosophila. , (1950).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados