Method Article
Time-lapse microscopía de embriogénesis temprana en Caenorhabditis elegans
En este artículo
Resumen
En este artículo se describe una técnica para la visualización de los primeros eventos de la embriogénesis en el nematodo Caenorhabditis elegans.
Resumen
Caenorhabditis elegans ha sido utilizada a menudo como un sistema modelo en estudios de los primeros procesos de desarrollo. La transparencia de los embriones, los recursos genéticos, y la relativa facilidad de transformación, son cualidades que hacen de C. elegans es un modelo excelente para la embriogénesis temprana. Basada en el láser microscopía confocal y las etiquetas de marcado con fluorescencia permiten a los investigadores de atenerse a las estructuras celulares y las proteínas del embrión en desarrollo. Por ejemplo, se puede seguir orgánulos específicos, tales como los lisosomas o las mitocondrias, el uso de tintes marcados con fluorescencia. Estos colorantes pueden ser entregados a los primeros embriones por medio de microinyección en la gónada de adultos. Además, la localización de las proteínas específicas se pueden seguir usando etiquetas fluorescentes de proteínas. Algunos ejemplos se presentan a continuación demuestran el uso de un colorante fluorescente lisosomales, así como marcado con fluorescencia proteínas histonas y ubiquitina. La histona etiqueta se utiliza para visualizar el ADN y así identificar la fase del ciclo celular. GFP-etiquetados ubiquitina revela la dinámica de las vesículas ubiquitinadas en el embrión temprano. Las observaciones de los lisosomas etiquetados y GFP:: ubiquitina puede ser usado para determinar si existe colocalización entre las vesículas ubiquitinated y lisosomas. Una técnica para la microinyección del colorante lisosomales se presenta. Técnicas para la generación de cepas transgenenic se presentan en otras partes (1, 2). Para las imágenes, los embriones se cortan de los nematodos adultos hermafroditas y montado en un 2% de agarosa almohadillas seguido por microscopía lapso de tiempo en un láser estándar microscopio confocal de barrido o de un microscopio confocal de disco giratorio. Esta metodología ofrece para la visualización de alta resolución de la embriogénesis temprana.
Protocolo
1. Culturas nematodo
- Obtener la adecuada C. elegans cepa de la Genética Caenorhabditis Stock Center (CGC) o de un colega.
- Crecen los nematodos en placas de agar NGM sembrado con césped OP50 bacteriana (3). Para el análisis de las buenas prácticas agrarias crecimiento cepas a 25 ° C se recomienda.
- El día antes de su experimento microscopio, recoger al menos 40 larvas L4 en placas de semillas y colocar las placas a 25 ° C durante la noche. Estos gusanos se los adultos jóvenes para el experimento.
2. Inyecciones
Si se desea ver la estructura, tales como los lisosomas o las mitocondrias, los adultos pueden ser inyectadas con colorante fluorescente antes de su visualización.
- Prepare seca almohadillas de inyección de agarosa. (Esto se puede hacer uno a varios días de antelación)
- Prepare fundido agarosa al 2% en agua. Con una pipeta Pasteur colocar 2 gotas en un cubreobjetos 22X54 mm. Coloque otro cubreobjetos en cruz en la parte superior de la gota. A fin de lograr el espesor adecuado, pulse sobre el cubre la parte superior hasta el diámetro de la almohadilla es de alrededor de 1,5 cm. Deje reposar durante 5-10 minutos.
- Quitar cubreobjetos encima. Deshidratar el pad de agarosa al colocarlo en un horno de 80 º C durante 1 hora o permitir que se sientan en mesa de trabajo durante la noche.
- Prepare Mitotracker o solución LysoTracker.
- Diluir agente fluorescente en tampón de huevo. Por lo general utilizan una dilución de 1:10 de Mitotracker o LysoTracker.
- La aguja de inyección se hace de un vaso capilar 1,2 OD. Saque la aguja de la inyección con un extractor de aguja.
- Use una pipeta Pastuer tiró para llenar de nuevo la aguja con el colorante diluido.
- Lugar de la punción con una luz libre, cámara húmeda hasta su uso.
- Pre-inyección: Configuración del microscopio y la aguja.
- Monte la aguja de inyección en un aparato de inyección. Nuestro aparato es un micromanipulador Narishige de transmisión directa montado en el escenario de un microscopio Nikon TE200 invertido equipado con capacidad de imagen DIC.
- Conecte la aguja a un tubo de 1,2 mm de identificación que se conecta al regulador de presión. Ya sea con aire comprimido o nitrógeno puede ser utilizado como una fuente de presión externa. Ajuste el regulador a 20-25 psi.
- Coloque 2 gotas de aceite mineral pesado (aceite de parafina) en la almohadilla de la inyección.
- Coloque la almohadilla de la inyección en el microscopio y bajar la aguja en el aceite. Verifique para asegurarse de que el líquido fluye libremente de la aguja cuando se aplica presión. Aplique una presión de inyección y observar si el líquido fluye fuera de la aguja. Si no, tendrá que romper suavemente la punta de la aguja. La aguja puede ser roto por conducir con suavidad la punta en un pequeño fragmento de cubreobjetos rotos colocados en la plataforma de inyección. Después de que la aguja está fluyendo, pasar a la siguiente etapa.
- Inyección.
- Aproximadamente una hora antes de la visualización de embriones, la transferencia de los gusanos adultos jóvenes en la gota de aceite en la plataforma de inyección. Realizar la transferencia con el microscopio de disección. Utilice un alambre de platino recoger gusano con una punta afilada para la transferencia de los gusanos.
- Organizar 3 a 10 gusanos para que se extiende directamente en la plataforma. Para la inyección, es más fácil si los gusanos se alinean paralelas entre sí y un poco menos de un largo gusano de distancia. Una vez que los gusanos están en la plataforma de inyección, es importante trabajar de forma rápida y completa el proceso de inyección antes de morir que los gusanos de la desecación.
- Coloque el cubreobjetos con gusanos en la platina del microscopio del microscopio de la inyección. Centrarse en la parte central (raquis) del tubo de las gónadas distal. A continuación, utilice el micromanipulador para mover la punta de la aguja en el mismo plano focal. Mover el escenario horizontalmente, de modo que el gusano se pincha con la aguja. Una vez que la punta de la aguja se encuentra dentro del raquis, de ejercer presión y permitir que la gónada para llenar con la mezcla de tinte. Inyectar los dos brazos de las gónadas de los gusanos en la plataforma de inyección.
- Después de la inyección, use un tira pipeta Pasteur para entregar alrededor de 0,5 ml de tampón de huevo a los gusanos. Esto evitará que mueran a causa de la deshidratación y les permiten recuperarse del procedimiento de la inyección.
- Permitir a los gusanos a recuperar durante 1-2 horas a temperatura ambiente con una luz libre de cámara húmeda.
3. Agarosa almohadilla para ver los embriones
- Prepare fundido agarosa al 2% en tampón de huevo.
- Con una pipeta de Pasteur, poner 3 gotas de agarosa fundida sobre un portaobjetos limpio.
- Lugar de diapositivas entre dos diapositivas otros que tienen una capa de cinta de etiquetado que los cubre. Estos sirven como separadores que se asegurará de que su plataforma de agarosa es el espesor correcto.
- Coloque una segunda placa de microscopio limpio perpendicularmente hacia abajo sobre las gotas de agarosa. Presione hacia abajo hasta carro superior se basa en la cinta a partir de diapositivas guía.
- Justo antes de que esté listo para montar embriones para la observación, quitar el carro superior.
4. Embriones de montaje para su visualización
- Si los gusanos no se han inyectado, siga los dos pasos siguientes. De lo contrario les pase.
- Elija los gusanos adultos jóvenes de la placa que se ha preparado el día anterior. Usted debe ser capaz de ver los embriones en el interior de los adultos jóvenes.
- Elige 05.20 gusanos en una placa de NGM cabeza de serie. Permitir a los gusanos a arrastrarse por la placa de cabeza de serie por unos minutos para que los gusanos se perderá la mayor parte de las bacterias que se pega a ellos.
- Obtener embriones jóvenes de los gusanos adultos
- Coloque una gota 50-20 l de buffer de huevo en el centro de un cubre objetos de vidrio de 18 mm 2 (un espesor de 1,5 cubreobjetos es preferible).
- Se mueven los gusanos de la placa de cabeza de serie o una almohadilla de inyección dentro de la gota de tampón de huevo.
- Cortar los gusanos abrir con una aguja hipodérmica de calibre 26. A cielo abierto, el gusano cerca de la vulva. Usted debe ver los embriones se derrame fuera de la lombriz.
- Montaje en portaobjetos de microscopio
- Invertir el portaobjetos de microscopio que se preparó con la plataforma de agarosa y se baja en el cubre con embriones.
- Si lapso de tiempo prolongado es necesario, utilizar vaselina para sellar los bordes del cubreobjetos para evitar la desecación.
5. Microscopía
- Encontrar los embriones adecuados.
- Lugar se deslizan sobre platina del microscopio. Escaneado con lente de 10X para encontrar embriones.
- Para encontrar embriones en fase inicial, la búsqueda de los embriones que se encuentran en proceso de completar la meiosis materna. Embriones meiótica se pueden distinguir a partir de embriones después, porque no han sufrido reducción. (Después de embriones ha completado la meiosis, se puede ver una brecha importante entre la membrana celular y la cáscara del huevo en el extremo anterior.)
- Una vez que haya identificado una adecuada etapas del embrión, se mueven a una lente de aumento mayor para la grabación de la embriogénesis.
- Imágenes
- En este ejemplo, estamos imaginando embriones que expresan la mCherry:: GFP y H2B:: Ub proteínas etiquetadas. Estamos usando el Zeiss LSM700 microscopio de barrido láser convencionales.
- Las imágenes son recolectados a través de la lente 1.4NA 63X. Los 488 y 555 se utilizan láseres con un mínimo de potencia del láser y la máxima ganancia. AZ pila se recoge cada 10-15 segundos. Dependiendo de la extensión de photobleaching, 30-60 puntos de tiempo se recogen. Imágenes Z pila se desplomó en una imagen de la proyección máxima para la final de lapso de tiempo de vídeo.
6. Los resultados representativos:
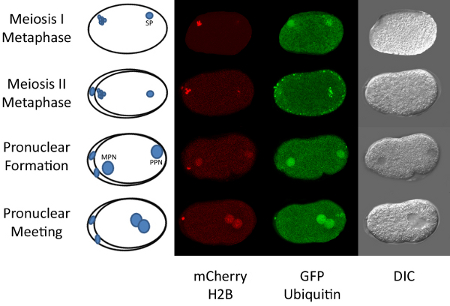
Figura 1. Fecundación hasta la primera mitosis en C. elegans.
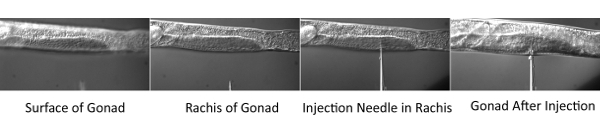
Figura 2. Procedimiento de microinyección.
Vídeo suplementario un lapso de tiempo de vídeo de la GFP:.. Azul ubiquitina más LysoTracker en un embrión de meiótica Haga clic aquí para ver el vídeo.
Discusión
Después de la fusión con el espermatozoide, el cigoto sufre una serie de eventos dinámicos. Estos eventos transformar el ovocito de una célula relativamente estable en el embrión en rápido desarrollo. En muchos organismos, reordenamientos citoplasmática son fundamentales para el establecimiento de la polaridad de embrionario y para la activación del huevo. El C. embrión elegans es una excelente oportunidad para la observación de estos primeros eventos de la activación del huevo y la embriogénesis. El embrión es transparente y se producen los eventos tempranos de desarrollo relativamente rápido después de la fecundación. C. elegans investigadores han generado muchas tensiones útil transgénicos que expresan proteínas marcadas con fluorescencia que participan en el desarrollo temprano. El uso de estas cepas, junto con RNAi o mutantes proporciona un sistema eficaz para la disección de las vías moleculares que subyacen al desarrollo de un organismo multicelular (5, 6, 7, 8). En este artículo de vídeo presenta un enfoque práctico a la utilización de estas herramientas y técnicas para registrar los acontecimientos durante la embriogénesis temprana en C. elegans.
La madurez C. ovocito elegans es detenido en la profase de la meiosis I y se fertiliza en la espermateca de la hermafrodita adulto. Después de la fecundación, el óvulo avanza a través del resto de la meiosis I y II. Estas etapas se pueden observar con la etiqueta fluorescente histona H2B (5). Durante la finalización de la meiosis materna, el ADN de los espermatozoides se mantiene condensada (ver Figura 1). Tras la finalización de la meiosis, el ADN materno y paterno se convierte en la forma y decondensed dos pronúcleos. El pronúcleo materno migra hacia el pronúcleo paterno y se unen cerca del centro del embrión. Mitosis rápidamente sobreviene después de la reunión pronuclear. Todos estos eventos se producen en menos de una hora. Por lo tanto, time-lapse microscopía de esta secuencia de eventos puede llevar a cabo fácilmente. La realización de esta técnica requiere cierta facilidad en el cultivo de nematodos, así como conocimientos básicos de microscopía, además de acceso a un microscopio confocal.
El ejemplo que aquí se presenta utiliza un transgénico C. elegans cepa que expresa dos proteínas fluorescentes, GFP:: ubiquitina y mCherry:: H2B. Un microscopio láser confocal de barrido se utiliza para observar la localización dinámica de estas dos proteínas. Además, mostramos que la inyección de LysoTracker etiqueta fluorescente se puede utilizar para seguir el destino de los lisosomas en el embrión tras la fecundación. La inyección de un rastreador de la etiqueta también se puede realizar para la visualización de las concentraciones de calcio mitocondrial o local (9). En teoría, el protocolo de la inyección podría ser usado para ver cualquier tipo de molécula marcada con fluorescencia en el embrión. Esto puede incluir la etiqueta de pequeñas moléculas, proteínas, lípidos, etc En algunos casos, puede que no sea necesario inyectar en realidad seguidores etiquetados como los gusanos fácilmente captación algunos colorantes como MitoTracker (10). Sin embargo, hemos probado las dos remojo y la inyección de LysoTracker y han encontrado mejores resultados con la inyección para la visualización en los embriones.
Consideraciones técnicas:
Los problemas técnicos planteados con este procedimiento incluyen la técnica de microinyección, así como la dificultad en las imágenes de embriones muy tempranos. En cuanto a las microinyecciones, el espesor de la plataforma de inyección de agarosa es fundamental para el éxito de las inyecciones. Si la superficie es demasiado gruesa, los gusanos se dessicate y mueren rápidamente. Si la superficie es muy delgada, los gusanos no se adhieren a la plataforma durante el proceso de inyección.
Los embriones pueden ser sensibles a las condiciones ambientales como la temperatura y las condiciones de amortiguación. Embriones de tipo salvaje debe iniciar descondensación del ADN de los espermatozoides y la migración pronuclear en un minuto o menos para completar la meiosis II (4). A los 20 minutos, el primero debe empezar la citocinesis. Si los embriones son expuestos a la intensidad del láser muy alta o se sobrecalienta o se ha roto durante el montaje, este proceso puede ser interrumpido. Embriones detendrá el desarrollo. Si esto ocurre, el experimento debe ser repetido con la disminución de la potencia del láser o una gruesa almohadilla de agarosa.
Embriones de C. elegans no secretan su cáscara de huevo hasta que poco después de la fecundación. Durante el corto período de tiempo entre la fertilización y la secreción de la cáscara del huevo, los embriones no son viables fuera de la madre (11). Algunos laboratorios han evitado este desafío mediante la imagen embriones en el útero (5, 12). En el útero de imagen ofrece ciertas ventajas, como la capacidad de capturar eventos que ocurren durante o justo después de la fecundación. Sin embargo, esta técnica requiere el uso de un sistema de microscopía que permite obtener imágenes de tejidos profundos. Sistemas como el de dos fotones o múltiples fotones son especialmente adecuados para ello (13, 14). Cuando se utiliza un láser convencionales de detección de giro o microscopio confocal de disco, las mejores imágenes se obtienen de embriones que hahan sido cortados de los gusanos adultos como se describe aquí.
Consideraciones sobre el sistema de imagen:
El tipo de sistema de imagen confocal utiliza depende de las necesidades de los usuarios. En general, los sistemas de escaneo láser se recomienda si se desea obtener imágenes con la mayor resolución posible. Por otro lado, haciendo girar los sistemas de disco son más adecuados para los procesos de formación de imágenes muy dinámicas como la adquisición de la imagen es relativamente rápida y photobleaching / fototoxicidad se reduce.
Los parámetros de imagen específico variará en función del diseño experimental y el sistema de imagen confocal emplea. En imágenes multidimensionales, es necesario considerar el número de canales, planos focales, y el tiempo de puntos recogidos. Debido a los efectos limitantes de photobleaching y fototoxicidad, un número finito de imágenes pueden ser adquiridos en cualquier experimento dado. Por lo tanto, si decide aumentar el número de canales que se adquirió, es probable que la necesidad de reducir el número de planos focales y / o puntos de tiempo y viceversa. El número total de imágenes que pueden ser adquiridos se verá influenciada por la intensidad de la fluoróforo se va a examinar, así como la sensibilidad de la microscopía confocal se utiliza. Fluoróforos más intenso y más instrumentos sensibles se requieren tiempos de exposición y por lo tanto producen menos photobleaching y fototoxicidad.
Un gran número o sistemas de imágenes están disponibles. Vamos a dar detalles sobre los sistemas que se han utilizado en nuestros propios laboratorios. Para los embriones del gusano de imagen haciendo girar la microscopía confocal de disco, se utiliza un microscopio Nikon TE2000U invertida equipada con un objetivo 60X/1.4 NA Plan de Apo. El microscopio está conectado a una unidad de Yokogawa CSU10 disco giratorio, una Hamamatsu C9100-13 EM CCD de la cámara, y una espectral de Investigación Aplicada LMM5 módulo láser fusión con cuatro láseres de estado sólido con salida a 405, 491, 561 y 655 nm. El uso de este sistema podemos capturar uno o dos canales, entre seis y doce aviones de coordinación, y 25 a 50 puntos de tiempo (de 30 a 60 segundos de intervalo). Un tiempo de exposición típica es de 100 a 200 milisegundos.
Para los embriones de imágenes con microscopía confocal de barrido láser, se utiliza un Zeiss LSM700 equipado con dos canales y cuatro láseres de estado sólido (405, 488, 555 y 635 nm). Este sistema está conectado a un microscopio Zeiss Axio Observador invertido con un Plan de Apo-objetivo 63X/1.4NA utiliza para obtener imágenes del embrión. El sistema utiliza el software Zeiss ZEN para la adquisición de imágenes, que también provee el procesamiento de imágenes y análisis limitados. Cuando la imagen con dos fluorocromos, por lo general se reúnen 1-5 planos focales (~ 0,5 m de distancia) y cobrar una pila Z cada 15 segundos. Las colecciones se continuó hasta photobleaching significativo se ha producido. Para generar la final de lapso de tiempo de vídeo, imágenes Z stack se consolidan mediante la herramienta de máxima proyección en el software de ZEN. Los vídeos son exportados desde el software como archivos AVI.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Nos gustaría agradecer la financiación de los Institutos Nacionales de Salud (R15-03 GM065444 a LB) y el Programa de Investigación Intramural del Instituto Nacional de Salud (NIH) y el Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (KO). Un premio NSF (DBI-0923402) financió la adquisición de un microscopio confocal LSM700. También nos gustaría agradecer la asistencia general y comentarios sobre el manuscrito del Dr. Andy oro. El crédito va para toda la comunidad de C. elegans para compartir recursos, protocolos, y las ideas.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Composición |
|---|---|---|---|
| Huevo Buffer | Hepes pH 7,2 5 mM, NaCl 110 mm, 4 mm de acetato de KCl, Mg 5 mM, 5 mM de CaCl2 | ||
| Mitotracker | Invitrogen | M-7512 | |
| LysoTracker | Invitrogen | L-7525 | |
| Inyección capilar pipeta | Harvard Apparatus, Kent, Reino Unido | GC120F-10 | |
| Extractor de agujas | Kopf | Modelo 700C | |
| Microinyector aparato | Tritech Investigación | Minj-1 regulador de microinyección |
Referencias
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J Vis Exp. (18), e833-e833 (2008).
- Hochbaum, D., Ferguson, A. A., Fisher, A. L. Generation of Transgenic C. elegans by Biolistic Transformation. J Vis Exp. (42), e2090-e2090 (2010).
- Brenner, S. The Genetics of Caenrohabditis elegans. Genetics. 77, 71-94 (1974).
- Oegema, K., Hyman, A. A. Cell division WormBook. , (2006).
- McNally, K. L., McNally, F. J. Fertilization initiates the transition from anaphase I to metaphase II during female meiosis in C. elegans. Dev Biol. 282, 218-230 (2005).
- Sato, K., Sato, M., Audhya, A., Oegema, K., Schweinsberg, P., Grant, B. D. Dynamic regulation of caveolin-1 trafficking in the germ line and embryo of Caenorhabditis elegans. Mol Biol Cell. 17, 3085-3094 (2006).
- Stitzel, M. L., Pellettieri, J., Seydoux, G. The C. elegans DYRK Kinase MBK-2 Marks Oocyte Proteins for Degradation in Response to Meiotic Maturation. Curr Biol. 16, 56-62 (2006).
- Schetter, A., Askjaer, P., Piano, F., Mattaj, I., Kemphues, K. Nucleoporins NPP-1, NPP-3, NPP-4, NPP-11 and NPP-13 are required for proper spindle orientation in C. elegans. Dev. Biol. 289, 360-371 (2006).
- Samuel, A. D., Murthy, V. N., Hengartner, M. O. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol. 1, (2001).
- Badrinath, A. S., White, J. S. Contrasting patterns of mitochondrial redistribution in the early lineages of Caenorhabditis elegans and Acrobeloides sp. PS1146. Dev. Biol. 258, 270-275 (2003).
- Johnston, W. L., Krizus, A., Dennis, J. W. The eggshell is required for meiotic fidelity, polar-body extrusion and polarization of the C. elegans embryo. BMC Biol. 4, 35-35 (2006).
- Parry, J. M., Velarde, N. V., Lefkovith, A. J., Zegarek, M. H., Hang, J. S., Ohm, J., Klancer, R., Maruyama, R., Druzhinina, M. K., Grant, B. D., Piano, F., Singson, A. EGG-4 and EGG-5 Link Events of the Oocyte-to-Embryo Transition with Meiotic Progression in C. elegans. Curr Biol. 19, 1752-1757 (2009).
- Centonze, V. E., White, J. G. Multiphoton excitation provides optical sections from deeper within scattering specimens than confocal imaging. Biophys J. 75, 2015-2024 (1998).
- Zinselmeyer, B. H., Dempster, J., Wokosin, D. L., Cannon, J. J., Pless, R., Parker, I., Miller, M. J. Two-photon microscopy and multidimensional analysis of cell dynamics. Methods Enzymol. 461, 349-378 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados