Method Article
Lapso de tempo Microscopia de embriogênese inicial em Caenorhabditis elegans
Neste Artigo
Resumo
Este artigo descreve uma técnica para a visualização dos eventos iniciais da embriogênese do nemátodo Caenorhabditis elegans.
Resumo
Caenorhabditis elegans tem sido frequentemente utilizado como um sistema modelo em estudos de início de processos de desenvolvimento. A transparência dos embriões, os recursos genéticos, ea relativa facilidade de transformação são qualidades que fazem C. elegans um excelente modelo para a embriogênese inicial. Baseados em laser microscopia confocal e tags fluorescente etiquetado permitem aos pesquisadores seguir específicos estruturas celulares e proteínas no embrião em desenvolvimento. Por exemplo, pode-se seguir organelas específicas, tais como lisossomos ou mitocôndrias, usando corantes fluorescentes rotulados. Esses corantes podem ser entregues ao embrião por meio de microinjeção no gônadas adulto. Além disso, a localização de proteínas específicas podem ser seguidos usando tags proteína fluorescente. Exemplos são aqui apresentados demonstram o uso de um corante fluorescente lisossomal, bem como fluorescente etiquetado proteínas histonas e ubiquitina. A histona rotulados é usado para visualizar o DNA e assim identificar o estágio do ciclo celular. GFP-tagged ubiquitina revela a dinâmica de vesículas ubiquitinated no embrião. Observações dos lisossomos rotulados e GFP:: ubiquitina pode ser usado para determinar se há co-localização entre as vesículas ubiquitinated e lisossomos. A técnica de microinjeção do corante lisossomal é apresentado. Técnicas para a geração de cepas transgenenic são apresentados em outros lugares (1, 2). Para a imagem latente, os embriões são cortadas de nematóides adultos hermafrodita e montados em blocos de agarose 2% seguido por lapso de tempo em um microscópio de varredura a laser padrão microscópio confocal ou um microscópio confocal disco giratório. Esta metodologia prevê a visualização de alta resolução de embriogênese precoce.
Protocolo
1. Culturas nematóide
- Obter o C. apropriado elegans tensão da Genética Caenorhabditis stock Center (CGC) ou de um colega.
- Nematóides crescer em placas de agar NGM semeados com um gramado OP50 bacteriana (3). Para a análise da GFP crescimento cepas a 25 ° C é recomendado.
- Um dia antes de sua experiência de microscopia, pegar pelo menos 40 L4 larvas em placas sem sementes e colocar as placas a 25 ° C durante a noite. Esses vermes serão os jovens adultos para o experimento.
2. Injeções
Se é desejável para ver estruturas como lisossomos ou mitocôndrias, os adultos podem ser injetados com corante fluorescente antes da visualização.
- Prepare almofadas injeção secas agarose. (Isto pode ser feito um a muitos dias antes)
- Prepare fundido agarose 2% em água. Com uma pipeta Pasteur colocar 2 gotas sobre uma lamela 22X54 milímetros. Coloque outro lamela transversalmente no topo da gota. Para atingir a espessura adequada, pressione no lamela superior até o diâmetro do bloco é em torno de 1,5 cm. Deixe descansar por 5-10 minutos.
- Remover lamela superior. Desidratar o bloco de agarose, colocando-o em um forno de 80 ° C por 1 hora ou deixe descansar na bancada durante a noite.
- Prepare Mitotracker ou solução Lyso Tracker.
- Diluir agente fluorescente no buffer Egg. Normalmente usamos uma diluição de 1:10 de Mitotracker ou Lyso Tracker.
- A agulha de injeção é feita de um vidro de 1,2 OD capilar. Puxe a agulha de injeção usando um extrator de agulhas.
- Use uma pipeta Pastuer puxado para trás preencher a agulha com o corante diluído.
- Coloque em uma agulha de luz sem câmara, umidificado até o uso.
- Injeção de pré-: Configurando o microscópio e agulha.
- Monte agulha de injeção para aparelhos de injeção. Nosso aparelho é um micromanipulador Narishige acionamento direto montada no palco de um microscópio invertido Nikon TE200 equipado com capacidade de imageamento DIC.
- Conecte a agulha para um tubo de 1,2 milímetros ID que é conectado ao regulador de pressão. Tanto de ar comprimido ou nitrogênio pode ser usado como uma fonte de pressão externa. Ajuste o regulador de 20-25 psi.
- Coloque 2 gotas de óleo mineral pesado (óleo de parafina) para o bloco de injeção.
- Coloque a almofada de injeção para o microscópio e inferior a agulha no óleo. Verifique para ter certeza de que os fluxos líquidos livremente a partir da agulha, quando a pressão é aplicada. Aplique a pressão de injeção e observar se fluido flui para fora da agulha. Se não, você terá que quebrar delicadamente o fim da agulha. A agulha pode ser quebrado por dirigir com cuidado a ponta em um pequeno pedaço de lamínula quebrado colocados no bloco de injeção. Após a agulha está fluindo, passar para a próxima etapa.
- Injeção.
- Aproximadamente 1 hora antes da exibição de embriões, a transferência de vermes adultos jovens para a queda do petróleo no bloco de injeção. Realizar esta transferência usando o microscópio de dissecação. Use uma platina pegar verme fio com uma ponta aguda para worms transferência.
- Organizar 3-10 vermes para que eles estão mentindo diretamente no teclado. Injectável, é mais fácil se os vermes estão alinhados paralelamente uns aos outros e um pouco menos de um comprimento de vermes separados. Uma vez que os vermes estão no bloco de injeção é importante para o trabalho rapidamente e concluir o processo antes da injeção de worms perecer de dessecação.
- Coloque a lamínula com worms no palco do microscópio do microscópio de injeção. Foco na parte central (ráquis) do tubo gônadas distal. Então use o micromanipulador para mover a ponta da agulha para o mesmo plano focal. Mover o palco horizontalmente para que o worm é perfurado pela agulha. Uma vez que a ponta da agulha está dentro da coluna vertebral, aplique pressão e permitir que a gônada para encher com a mistura de corante. Injetar ambos os braços das gônadas de todos os worms na almofada da injeção.
- Após a injeção, use uma pipeta Pasteur puxado para entregar cerca de 0,5 ml de tampão de ovo para os vermes. Isto irá mantê-los de morrer de desidratação e permitir-lhes recuperar a partir do procedimento de injeção.
- Permitir que os vermes para se recuperar de 1-2 horas em temperatura ambiente com uma luz sem câmara, umidificado.
3. Agarose pad para visualização embriões
- Prepare fundido agarose 2% em tampão Egg.
- Com uma pipeta Pasteur, colocar 3 gotas de agarose fundida em uma lâmina de microscópio limpa.
- Slides lugar entre dois outros slides que têm uma camada de rotulagem fita cobrindo-os. Estes servem como espaçadores que irá garantir que o seu bloco de agarose é a espessura correta.
- Coloque uma lâmina de microscópio limpa segundo perpendicularmente para baixo sobre as gotas de agarose. Pressione para baixo até slide superior repousa sobre fita de slides guia.
- Pouco antes de você está pronto para montar embriões para observação, remover o slide superior.
4. Embriões de montagem para a visualização
- Se worms não foram injetados, siga as próximas duas etapas. Caso contrário, pule eles.
- Escolha vermes adultos jovens da placa que foi preparado no dia anterior. Você deve ser capaz de ver os embriões dentro dos adultos jovens.
- Escolha 50-20 worms em uma placa NGM unseeded. Permitir que os vermes a rastejar na placa unseeded por alguns minutos para que os vermes vão perder a maior parte das bactérias que está preso a eles.
- Obtenção de embriões jovens de vermes adultos
- Colocar uma gota 50-20 mL de tampão de ovo no meio de uma lamela de vidro 18 mm 2 (espessura de 1,5 lamela é preferível).
- Mova worms da placa unseeded ou almofada de injeção na gota de tampão Egg.
- Corte worms aberta com uma agulha hipodérmica calibre 26. Corte para abrir o worm perto da vulva. Você deverá ver embriões espalhe pelo worm.
- Montagem em lâmina de microscópio
- Inverter a lâmina de microscópio que foi preparado com o bloco de agarose e abaixá-lo para a lamínula com embriões.
- Se lapso de tempo prolongado é necessário, usar vaselina para selar as bordas da lamínula para evitar dessecação.
5. Microscopia
- Encontrar os embriões apropriado.
- Slides lugar para o palco microscópio. Varredura com lente de 10X para encontrar embriões.
- Para encontrar embriões fase inicial, pesquisa de embriões que estão em vias de completar a meiose materna. Meiótica embriões podem ser distinguidos a partir de embriões mais tarde, porque eles não sofreram encurtamento. (Depois de embriões tenham concluído a meiose, é possível ver uma diferença significativa entre a membrana celular e da casca do ovo no final anterior.)
- Depois de ter identificado uma adequada encenado embrião, mover-se para uma lente de maior ampliação para a gravação de embriogênese.
- Imagem
- Neste exemplo, estamos imaginando embriões que expressam a mCherry:: H2B e GFP:: Ub proteínas marcadas. Estamos usando o microscópio de varredura Zeiss LSM700 convencionais laser.
- As imagens são coletados por meio da lente 63X 1.4NA. A 488 e 555 lasers são usados com potência do laser mínimo e máximo ganho. Pilha AZ é coletado a cada 10-15 segundos. Dependendo da extensão da fotodegradação, 30-60 pontos no tempo são coletados. Imagens da pilha Z estão recolhidos em uma imagem de projeção máxima para o vídeo de lapso de tempo final.
6. Resultados representativos:
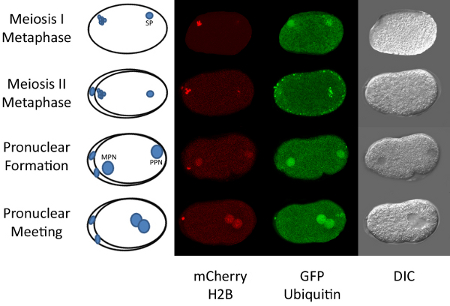
Figura 1. Fertilização para Mitose Primeira C. elegans.
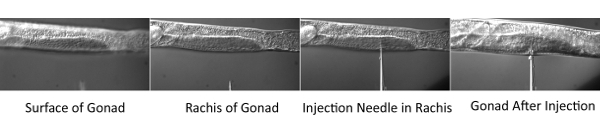
Figura 2. Procedimento de microinjeção.
Suplementar Video 1 Time-lapse video da GFP:.. Azul ubiquitina mais Lyso Tracker em um embrião meiótica Clique aqui para ver o vídeo.
Discussão
Após a fusão com o espermatozóide, o zigoto sofre uma série de eventos dinâmicos. Estes acontecimentos transformam o ovócito de uma célula relativamente estática em que o embrião se desenvolvendo rapidamente. Em muitos organismos, rearranjos citoplasmática são críticos para o estabelecimento de polaridade embrionárias e para a ativação do ovo. O C. embrião elegans proporciona uma excelente oportunidade para observar esses eventos precoces da ativação do ovo e embriogênese. O embrião é transparente e início de eventos de desenvolvimento ocorrem de forma relativamente rápida após a fertilização. C. pesquisadores elegans tem gerado muitos úteis cepas transgênicas que expressam proteínas fluorescentes marcados envolvidos no início do desenvolvimento. Usando essas cepas, juntamente com RNAi ou mutantes fornece um sistema poderoso para dissecar as vias moleculares que estão na base do desenvolvimento de um organismo multicelular (5, 6, 7, 8). Este artigo vídeo apresenta uma abordagem prática para o uso dessas ferramentas e técnicas para registrar eventos durante a embriogênese no início de C. elegans.
O C. madura oócito elegans é preso em prófase da meiose I e é fertilizado na espermateca do hermafrodita adulto. Após a fecundação, o oócito prossegue até o final da meiose I e II. Estes estágios podem ser observados usando fluorescente etiquetado histona H2B (5). Durante a conclusão da meiose materna, o DNA do esperma permanece condensado (ver Figura 1). Após a conclusão da meiose, o DNA materno e paterno se torna descondensada ea forma pronúcleos dois. O pronúcleo materna migra para o pronúcleo paternal e eles se juntam perto do centro do embrião. Mitose rapidamente se segue após reunião pronuclear. Todos esses eventos ocorrem em menos de uma hora. Assim, lapso de tempo microscopia desta seqüência de eventos pode ser facilmente realizado. Realizar esta técnica requer certa facilidade no cultivo de nematóides, bem como habilidades básicas de microscopia para além do acesso a um microscópio confocal.
O exemplo aqui apresentado utiliza um C. transgênicos elegans tensão que expressa duas proteínas fluorescentes, GFP:: ubiquitina e mCherry:: H2B. Um microscópio de varredura confocal a laser é usada para observar a localização dinâmica dessas duas proteínas. Além disso, mostramos que a injeção de Lyso Tracker fluorescente etiquetado pode ser usado para seguir o destino dos lisossomos no embrião após a fertilização. Injeção de um tracker rotulados também pode ser realizada para a visualização de concentrações de cálcio mitocôndrias ou local (9). Em teoria, o protocolo de injeção pode ser usado para visualizar qualquer tipo de molécula fluorescente etiquetado no embrião. Isto pode incluir rotulados pequenas moléculas, proteínas, lipídios, etc Em alguns casos, pode não ser necessário para realmente injetar trackers rotulados como os vermes prontamente absorção alguns corantes, como mitotracker (10). No entanto, temos tentado tanto de imersão e injeção de Lyso Tracker e encontraram resultados muito melhores com injeção para visualização em embriões.
Considerações técnicas:
Os desafios técnicos apresentados com este procedimento incluem a técnica de microinjeção, bem como a dificuldade em embriões de imagem muito cedo. Em relação microinjeções, a espessura da almofada de injeção agarose é fundamental para injeções de sucesso. Se o bloco é muito grosso, as minhocas vão dessicate e morrem rapidamente. Se o teclado é muito fino, os vermes não vai ficar com o bloco durante o processo de injeção.
Os embriões podem ser sensíveis às condições ambientais, como temperatura e as condições de buffer. Embriões tipo selvagem deve iniciar descondensação do DNA do esperma e migração pronuclear dentro de um minuto ou assim de completar a meiose II (4). Dentro de 20 minutos, a citocinese primeiro deve começar. Se os embriões são expostos a intensidade do laser muito alta ou estão superaquecidos ou esmagados durante a montagem, este processo pode ser interrompido. Tais embriões vai prender desenvolvimento. Se isso ocorrer, o experimento deve ser repetido com diminuição da potência do laser ou uma espessa almofada de agarose.
Embriões C. elegans não secretam sua casca de ovo até pouco depois da fertilização. Durante o curto período de tempo entre a fertilização ea secreção da casca do ovo, os embriões não são viáveis fora da mãe (11). Alguns laboratórios têm evitado este desafio embriões no útero de imagens (5, 12). Utero imagem oferece certas vantagens, tais como a capacidade de capturar eventos que ocorrem durante ou logo após a fertilização. No entanto, esta técnica requer o uso de um sistema de microscopia que permite imagens de tecidos profundos. Sistemas como o de dois fótons ou multi-fotão são especialmente adequadas para este (13, 14). Quando se utiliza um laser convencional de digitalização ou spinning microscópio confocal de disco, as melhores imagens são obtidas de embriões que hafui cortada do verme adulto, como descrito aqui.
Considerações do Sistema de imagem:
O tipo de sistema de imagem confocal utilizado depende das necessidades dos usuários. Em geral, os sistemas de varredura a laser são recomendadas se que se deseja adquirir imagens com resolução mais alta possível. Por outro lado, os sistemas de disco giratório são mais adequados para os processos de imagem altamente dinâmico como a aquisição de imagens é relativamente rápido e fotobranqueamento fototoxicidade / é reduzida.
Os parâmetros de imagem específico irá variar dependendo do desenho experimental e do sistema de imagem confocal empregados. Multidimensional em imagem, é preciso considerar o número de canais, planos focais, e tempo de pontos que estão sendo coletados. Devido aos efeitos limitantes de fotodegradação e fototoxicidade, um número finito de imagens podem ser adquiridas em qualquer experimento. Assim, se você optar por aumentar o número de canais a serem adquiridos, você provavelmente precisará reduzir o número de aviões focal e / ou pontos de tempo e vice-versa. O número total de imagens que podem ser adquiridos serão influenciadas pela intensidade do fluoróforo sendo fotografada, assim como a sensibilidade do microscópio confocal a ser utilizado. Fluoróforos mais intensa e mais sensíveis instrumentos vai exigir menor tempo de exposição e, portanto, produzir menos fotobranqueamento e fototoxicidade.
Um grande número ou sistemas de imagem estão disponíveis. Daremos mais detalhes sobre os sistemas que têm sido utilizadas em nossos próprios laboratórios. Para embriões imagem verme girando microscopia confocal de disco, usamos um microscópio Nikon TE2000U invertido equipado com um 60X/1.4 NA Plano de Apo objetivo. O microscópio está ligado a uma unidade de disco Yokogawa CSU10 fiação, uma Hamamatsu C9100-13 EM CCD da câmera, e um Spectral Applied Research LMM5 laser de módulo de mesclagem que contém quatro lasers de estado sólido com saída a 405, 491, 561 e 655 nm. Usando este sistema podemos capturar um ou dois canais, 6-12 planos focais, e 25 a 50 pontos no tempo (entre 30 e 60 segundos de intervalo). Um tempo de exposição típico é de 100 a 200 milissegundos.
Para embriões de imagem com laser scanning microscopia confocal, usamos um LSM700 Zeiss equipado com dois canais e quatro lasers de estado sólido (405, 488, 555 e 635 nm). Este sistema é acoplada a um microscópio Zeiss Axio Observer invertido com um Plano de Apo-objetivo 63X/1.4NA usado para imagens de embrião. O sistema utiliza o software Zeiss ZEN para aquisição de imagem, que também fornece processamento de imagem limitada e análise. Quando imagem com dois fluorocromos, que normalmente se reúnem 05/01 planos focais (~ 0,5 m de distância) e recolher uma pilha Z a cada 15 segundos. Coleções são continuou até fotobranqueamento significativa ocorreu. Para gerar o vídeo lapso de tempo final, imagens da pilha Z são consolidadas usando a ferramenta de projeção máxima no software ZEN. Vídeos são exportados a partir do software como arquivos avi.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Nós gostaríamos de agradecer o financiamento do National Institutes of Health (R15-03 para GM065444 LB) e do Programa de Pesquisa Intramural do National Institutes of Health (NIH) e do Instituto Nacional de Diabetes e Doenças Digestivas e Renais (KO). Um prêmio NSF (DBI-0923402) financiou a aquisição do microscópio confocal LSM700. Gostaríamos também de agradecer a assistência geral e comentários úteis sobre o manuscrito do Dr. Andy Ouro. Crédito vai para todo o C. elegans comunidade para a partilha de recursos, protocolos e idéias.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Composição |
|---|---|---|---|
| Ovo de buffer | Hepes 5mM pH 7.2, 110mm NaCl, KCl 4 mM, acetato de Mg 5mM, 5mM CaCl 2 | ||
| Mitotracker | Invitrogen | M-7512 | |
| Lyso Tracker | Invitrogen | L-7525 | |
| Pipetar injeção capilar | Harvard Apparatus, Kent, Reino Unido | GC120F-10 | |
| Agulha Puller | Kopf | Modelo 700C | |
| Microinjetor Aparelho | Tritech Research | Minj-1 regulador de microinjeção |
Referências
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J Vis Exp. (18), e833-e833 (2008).
- Hochbaum, D., Ferguson, A. A., Fisher, A. L. Generation of Transgenic C. elegans by Biolistic Transformation. J Vis Exp. (42), e2090-e2090 (2010).
- Brenner, S. The Genetics of Caenrohabditis elegans. Genetics. 77, 71-94 (1974).
- Oegema, K., Hyman, A. A. Cell division WormBook. , (2006).
- McNally, K. L., McNally, F. J. Fertilization initiates the transition from anaphase I to metaphase II during female meiosis in C. elegans. Dev Biol. 282, 218-230 (2005).
- Sato, K., Sato, M., Audhya, A., Oegema, K., Schweinsberg, P., Grant, B. D. Dynamic regulation of caveolin-1 trafficking in the germ line and embryo of Caenorhabditis elegans. Mol Biol Cell. 17, 3085-3094 (2006).
- Stitzel, M. L., Pellettieri, J., Seydoux, G. The C. elegans DYRK Kinase MBK-2 Marks Oocyte Proteins for Degradation in Response to Meiotic Maturation. Curr Biol. 16, 56-62 (2006).
- Schetter, A., Askjaer, P., Piano, F., Mattaj, I., Kemphues, K. Nucleoporins NPP-1, NPP-3, NPP-4, NPP-11 and NPP-13 are required for proper spindle orientation in C. elegans. Dev. Biol. 289, 360-371 (2006).
- Samuel, A. D., Murthy, V. N., Hengartner, M. O. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol. 1, (2001).
- Badrinath, A. S., White, J. S. Contrasting patterns of mitochondrial redistribution in the early lineages of Caenorhabditis elegans and Acrobeloides sp. PS1146. Dev. Biol. 258, 270-275 (2003).
- Johnston, W. L., Krizus, A., Dennis, J. W. The eggshell is required for meiotic fidelity, polar-body extrusion and polarization of the C. elegans embryo. BMC Biol. 4, 35-35 (2006).
- Parry, J. M., Velarde, N. V., Lefkovith, A. J., Zegarek, M. H., Hang, J. S., Ohm, J., Klancer, R., Maruyama, R., Druzhinina, M. K., Grant, B. D., Piano, F., Singson, A. EGG-4 and EGG-5 Link Events of the Oocyte-to-Embryo Transition with Meiotic Progression in C. elegans. Curr Biol. 19, 1752-1757 (2009).
- Centonze, V. E., White, J. G. Multiphoton excitation provides optical sections from deeper within scattering specimens than confocal imaging. Biophys J. 75, 2015-2024 (1998).
- Zinselmeyer, B. H., Dempster, J., Wokosin, D. L., Cannon, J. J., Pless, R., Parker, I., Miller, M. J. Two-photon microscopy and multidimensional analysis of cell dynamics. Methods Enzymol. 461, 349-378 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados