Method Article
Microscopia time-lapse di Embriogenesi All'inizio del Caenorhabditis elegans
In questo articolo
Riepilogo
Questo articolo descrive una tecnica per la visualizzazione degli eventi precoci dell'embriogenesi nel nematode Caenorhabditis elegans.
Abstract
Caenorhabditis elegans è stato spesso utilizzato come sistema modello negli studi dei primi processi di sviluppo. La trasparenza degli embrioni, le risorse genetiche, e la relativa facilità di trasformazione sono qualità che rendono C. elegans, un modello eccellente per embriogenesi precoce. Laser a base di microscopia confocale e tag fluorescente permetterà ai ricercatori di seguire specifiche strutture cellulari e le proteine di un embrione in via di sviluppo. Per esempio, si può seguire organelli specifici, come i lisosomi o mitocondri, utilizzando coloranti fluorescente. Questi coloranti possono essere consegnato l'embrione precoce mediante microiniezione nella gonade adulti. Inoltre, la localizzazione di specifiche proteine può essere seguita usando i tag proteina fluorescente. Gli esempi sono qui presentati dimostrano l'uso di un colorante fluorescente lisosomiale e fluorescente tag proteine istoniche e ubiquitina. L'istone etichettato è usato per visualizzare il DNA e quindi identificare la fase del ciclo cellulare. GFP-tagged ubiquitina rivela la dinamica delle vescicole ubiquinate nell'embrione precoce. Le osservazioni dei lisosomi etichettati e GFP:: ubiquitina può essere usato per determinare se vi è colocalizzazione tra vescicole ubiquitinate e lisosomi. Una tecnica per la microiniezione del colorante lisosomiale è presentato. Tecniche per la generazione di ceppi transgenenic sono presentati altrove (1, 2). Per l'imaging, gli embrioni sono tagliati fuori per adulti nematodi ermafroditi, montato su cuscinetti di agarosio 2% seguito dal time-lapse microscopia a scansione laser standard microscopio confocale o di un microscopio confocale disco rotante. Questa metodologia prevede la visualizzazione ad alta risoluzione di embriogenesi precoce.
Protocollo
1. Nematode culture
- Ottenere l'appropriato C. elegans ceppo dal Genetics Caenorhabditis archivi Center (CGC) o da un collega.
- Nematodi crescere su piastre di agar NGM seminato con prato OP50 batterica (3). Per l'analisi della crescita GFP ceppi a 25 ° C è raccomandato.
- Il giorno prima l'esperimento microscopia, raccogliere almeno 40 L4 su piastre seminate e posizionare le piastre a 25 ° C durante la notte. Questi worm saranno giovani adulti per l'esperimento.
2. Iniezioni
Se è auspicabile per visualizzare le strutture come i lisosomi e dei mitocondri, gli adulti possono essere iniettati con colorante fluorescente prima della visualizzazione.
- Preparare secca pastiglie iniezione agarosio. (Questo può essere fatto da uno a molti giorni prima)
- Preparare fuso agarosio al 2% in acqua. Con una pipetta Pasteur mettere 2 gocce su un vetrino coprioggetti 22X54 millimetri. Posto un altro coprioggetti trasversale sulla parte superiore della goccia. Al fine di raggiungere lo spessore giusto, premere sul coprioggetti superiore fino al diametro del pad è di circa 1,5 cm. Lasciate riposare per 5-10 minuti.
- Rimuovere coprioggetti superiore. Disidratare il pad agarosio mettendolo in un forno a 80 ° C per 1 ora o consentire di sedersi sul banco durante la notte.
- Preparare Mitotracker o soluzione Lysotracker.
- Diluire l'agente fluorescente nel tampone Egg. Noi di solito utilizzare una diluizione 1:10 di Mitotracker o Lysotracker.
- L'ago d'iniezione è costituito da un vetro 1,2 OD capillare. Tirare l'ago di iniezione con un estrattore ago.
- Utilizzare una pipetta Pastuer tirato a riempire di nuovo l'ago con il colorante diluito.
- L'ago posto in una luce-free, camera umidificata fino al momento dell'uso.
- Pre-Iniezione: Impostazione del microscopio e ago.
- Monte ago per l'iniezione su apparati di iniezione. Il nostro apparato è un disco diretto micromanipolatore Narishige montato sul palco di un microscopio invertito Nikon TE200 dotato di capacità di imaging DIC.
- Collegare l'ago in una provetta da 1,2 millimetri ID che è collegato al regolatore di pressione. Sia aria compressa o azoto può essere utilizzato come una sorgente di pressione esterna. Impostare il regolatore a 20-25 psi.
- Mettere 2 gocce di olio minerale pesante (olio di paraffina) sul pad iniezione.
- Posizionare il pad iniezione sul microscopio e abbassare l'ago nel petrolio. Controllare che il fluido che liberamente dall'ago quando la pressione è applicata. Applicare una pressione di iniezione e osservare se esce del liquido l'ago. In caso contrario, sarà necessario rompere delicatamente la fine dell'ago. L'ago può essere rotto con delicatezza la punta di guida in un piccolo pezzo di coprioggetti rotto immessi sul pad di iniezione. Dopo che l'ago è scorrevole, passare alla fase successiva.
- Iniezione.
- Circa 1 ora prima di embrioni di visualizzazione, il trasferimento di vermi adulti giovani nella goccia di olio sulla rampa di iniezione. Effettuare questo trasferimento usando il microscopio da dissezione. Utilizzare un filo di platino raccogliere verme con una punta per il trasferimento di vermi.
- Disporre 3-10 vermi in modo che essi giacciono direttamente sul pad. Per l'iniezione, è più facile se i vermi sono allineati parallelamente l'uno all'altro e un po 'meno di un verme lunghezza di distanza. Una volta che i vermi sono sulla rampa di iniezione è importante lavorare velocemente e completare il processo di iniezione prima che i vermi muoiono di disidratazione.
- Posizionare il coprioggetti con i vermi sul palco microscopio del microscopio iniezione. Messa a fuoco nella parte centrale (rachide) del tubo gonade distale. Quindi utilizzare il micromanipolatore per spostare la punta dell'ago nello stesso piano focale. Spostare lo stadio orizzontalmente in modo che il worm viene forato con l'ago. Una volta che la punta dell'ago è all'interno del rachide, applicare la pressione e consentire la gonade da riempire con il composto colorante. Iniettare entrambe le braccia gonade di tutti i vermi sulla rampa di iniezione.
- Dopo l'iniezione, usare una pipetta Pasteur tirato per fornire circa 0,5 ml di tampone Egg per i vermi. Questo li non morire di disidratazione e permettere loro di riprendersi dalla procedura di iniezione.
- Lasciare che il worm di recuperare per 1-2 ore a temperatura ambiente in una luce priva di camera umidificata.
3. Agarosio pad per la visualizzazione di embrioni
- Preparare fuso agarosio al 2% in tampone di Egg.
- Con una pipetta Pasteur, mettere 3 gocce di fuso agarosio su un vetrino da microscopio pulito.
- Scivolo tra due vetrini altri che hanno uno strato di etichettatura nastro che li copre. Queste servono come distanziatori che farà in modo che il vostro pad agarosio è lo spessore giusto.
- Posizionare un vetrino da microscopio pulito secondo perpendicolarmente verso il basso sulla gocce agarosio. Premere verso il basso fino a far scorrere in alto poggia su nastro da diapositive guida.
- Poco prima si è pronti per il montaggio degli embrioni per l'osservazione, rimuovere la slitta superiore.
4. Embrioni di montaggio per la visualizzazione
- Se i vermi non sono state iniettate, seguire i due passaggi successivi. In caso contrario, li salta.
- Scegli vermi adulti giovani dalla piastra che è stato preparato il giorno prima. Dovreste essere in grado di vedere gli embrioni all'interno gli adulti giovani.
- Scegli 5-20 vermi su una piastra di NGM testa di serie. Lasciare i vermi a strisciare sul piatto testa di serie per alcuni minuti in modo che il worm perderà la maggior parte dei batteri che è attaccato a loro.
- Ottenere embrioni giovani vermi adulti
- Inserire una goccia 5-20 ml di tampone uovo nel mezzo di mm 18 2 coprioggetti vetro (uno spessore di 1,5 coprioggetti è preferibile).
- Spostare i vermi dalla piastra di testa di serie o pad iniezione nel goccia di tampone Egg.
- Tagliare worm apre con un ago ipodermico calibro 26. Taglio aperto il verme vicino alla vulva. Dovreste vedere embrioni fuoriuscita del worm.
- Montaggio su vetrino da microscopio
- Invertire il vetrino da microscopio che è stato preparato con il pad agarosio e abbassarlo sulla coprioggetti con embrioni.
- Se il lasso di tempo prolungato è necessario, usare la vaselina per sigillare i bordi del coprioggetti per evitare essiccazione.
5. Microscopia
- Trovare gli embrioni appropriato.
- Porre il vetrino sul microscopio palco. Scansione con obiettivo 10X per trovare gli embrioni.
- Per trovare gli embrioni prima fase, la ricerca di embrioni che sono in procinto di completare la meiosi materna. Meiotico embrioni possono essere distinti dagli embrioni in seguito, perché non hanno subito un accorciamento. (Dopo che gli embrioni hanno completato la meiosi, si può vedere un divario significativo tra la membrana cellulare e il guscio d'uovo alla fine anteriore.)
- Una volta identificato un embrione opportunamente messo in scena, spostarsi in una lente di ingrandimento superiore per la registrazione di embriogenesi.
- Imaging
- In questo esempio, stiamo immaginando embrioni che esprimono la mCherry:: H2B e GFP:: Ub proteine marcate. Stiamo usando il Zeiss LSM700 convenzionale microscopio a scansione laser.
- Le immagini sono raccolti con la lente 63x 1.4NA. La 488 e 555 laser sono utilizzati con potenza laser minimo e massimo guadagno. Pila AZ vengono raccolti ogni 10-15 secondi. A seconda del grado di photobleaching, 30-60 punti di tempo sono raccolti. Immagini pila Z sono crollate in un'immagine sporgenza massima per l'ultimo time-lapse video.
6. Rappresentante dei risultati:
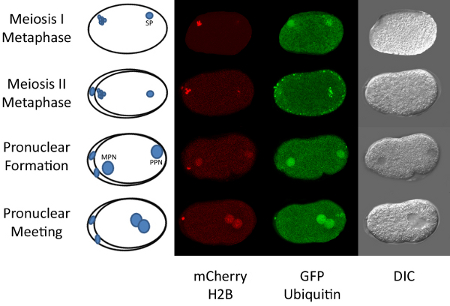
Figura 1. Fecondazione a prima mitosi in C. elegans.
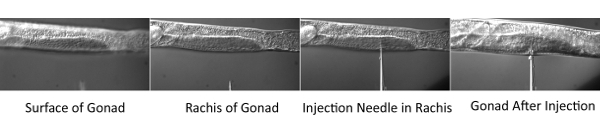
Figura 2. Procedura di microiniezione.
Video supplementare 1 Time-lapse video della GFP:.. Blu ubiquitina più Lysotracker in un embrione meiotica Clicca qui per visualizzare il video.
Discussione
Dopo la fusione con lo spermatozoo, lo zigote subisce una serie di eventi dinamici. Questi eventi trasformare l'ovocita da una cella relativamente statico in un embrione in rapido sviluppo. In molti organismi, riarrangiamenti citoplasmatiche sono fondamentali per stabilire la polarità embrionale e per l'attivazione uovo. Il C. embrione elegans rappresenta un'opportunità eccellente per l'osservazione di questi primi eventi di attivazione uovo e l'embriogenesi. L'embrione è trasparente e presto gli eventi si verificano in modo relativamente rapido sviluppo dopo la fecondazione. C. elegans ricercatori hanno generato molti ceppi utili transgenici che esprimono proteine fluorescenti etichettati coinvolto nello sviluppo precoce. L'utilizzo di questi ceppi con RNAi o mutanti fornisce un sistema potente per sezionare le vie molecolari che sono alla base dello sviluppo di un organismo multicellulare (5, 6, 7, 8). In questo articolo video presenta un approccio pratico per utilizzare questi strumenti e le tecniche per registrare gli eventi durante l'embriogenesi precoce in C. elegans.
Il maturo C. ovocita elegans è arrestato in profase della meiosi I e viene fecondato nella spermateca della ermafrodita adulto. Dopo la fecondazione, l'ovocita procede attraverso il resto della meiosi I e II. Queste fasi possono essere osservate con fluorescente istone H2B (5). Durante il completamento della meiosi materna, il DNA dello sperma rimane condensata (vedi Figura 1). Dopo il completamento della meiosi, il DNA materno e paterno diventa decondensed e le due pronuclei forma. Il pronucleo materno migra verso il pronucleo paterno e si uniscono vicino al centro dell'embrione. Mitosi Segue subito dopo l'incontro con pronucleo. Tutti questi eventi si verificano in meno di un'ora. Così, time-lapse microscopia di questa sequenza di eventi può essere facilmente realizzato. L'esecuzione di questa tecnica richiede una certa facilità in coltura nematodi così come le abilità di base in microscopia oltre all'accesso a un microscopio confocale.
L'esempio qui presentato utilizza un transgenico C. ceppo elegans che esprime due proteine fluorescenti, GFP:: ubiquitina e mCherry:: H2B. Un microscopio confocale a scansione laser è utilizzato per osservare la localizzazione dinamica di queste due proteine. Inoltre, abbiamo dimostrato che l'iniezione di Lysotracker fluorescente può essere usato per seguire il destino dei lisosomi nell'embrione dopo la fecondazione. L'iniezione di un tracker etichetta può essere eseguita anche per la visualizzazione delle concentrazioni di calcio mitocondri o locale (9). In teoria, il protocollo di iniezione potrebbe essere usato per visualizzare qualsiasi tipo di molecola fluorescente negli embrioni. Ciò potrebbe includere l'etichetta piccole molecole, proteine, lipidi, ecc In alcuni casi, potrebbe non essere necessario iniettare effettivamente inseguitori etichettati come i vermi prontamente assorbimento alcuni coloranti come mitotracker (10). Tuttavia, abbiamo provato sia ammollo e iniezione di lysotracker e hanno trovato risultati molto migliori con l'iniezione per la visualizzazione in embrioni.
Considerazioni tecniche:
Le sfide tecniche presentate con questa procedura sono la tecnica di microiniezione come pure la difficoltà nella diagnostica per immagini embrioni molto presto. Per quanto riguarda microiniezioni, lo spessore del pad iniezione agarosio è un fattore critico di successo per preparazioni iniettabili. Se il pad è troppo spesso, il worm si Dessicate e muoiono rapidamente. Se il pad è troppo sottile, il worm non si attacca al pad durante il processo di iniezione.
Gli embrioni precoce può essere sensibile alle condizioni ambientali quali la temperatura e le condizioni di buffer. Embrioni di tipo selvaggio dovrebbe avviare decondensazione del DNA dello sperma e la migrazione pronucleo entro un minuto o così di completare la meiosi II (4). In 20 minuti, la citodieresi primo dovrebbe iniziare. Se gli embrioni sono esposti a intensità del laser molto alta o sono surriscaldati o schiacciati durante il montaggio, questo processo può essere interrotto. Tali embrioni saranno arresto dello sviluppo. In questo caso, l'esperimento dovrebbe essere ripetuto con la potenza del laser diminuzione o un pad più spessa agarosio.
C. elegans embrioni non secernono il loro guscio d'uovo fino a poco dopo la fecondazione. Durante il breve periodo di tempo tra la fecondazione e la secrezione del guscio d'uovo, gli embrioni non sono vitali al di fuori della madre (11). Alcuni laboratori hanno evitato questa sfida embrioni in utero di imaging (5, 12). In utero di imaging offre alcuni vantaggi come la possibilità di catturare gli eventi che si verificano durante o subito dopo la fecondazione. Tuttavia, questa tecnica richiede l'utilizzo di un sistema di microscopia che permette l'imaging dei tessuti profondi. Sistemi come due fotoni o multi-fotone sono particolarmente adatti per questo (13, 14). Quando si utilizza un tradizionale scansione laser o spinning microscopio confocale disco, le migliori immagini sono ottenute da embrioni, che hasono già stati tagliati fuori dal verme adulto come descritto qui.
Sistema di imaging Considerazioni:
Il tipo di sistema di imaging confocale utilizzato dipende esigenze degli utenti '. In generale, i sistemi di scansione laser sono consigliate se si vogliono acquisire le immagini con la più alta risoluzione possibile. D'altra parte, sistemi a disco rotante sono più adatti per i processi di imaging altamente dinamici, come l'acquisizione di immagini è relativamente rapido e photobleaching / fototossicità è ridotta.
I parametri di imaging specifiche variano a seconda del disegno sperimentale e il sistema di imaging confocale impiegato. In multidimensionale di imaging, bisogna considerare il numero di canali, piani focali, e ora i punti raccolti. A causa degli effetti della limitazione photobleaching e fototossicità, un numero finito di immagini possono essere acquisite in un dato esperimento. Quindi, se si sceglie di aumentare il numero di canali da acquisire, è probabile che sia necessario ridurre il numero di piani focali e / o punti di tempo e viceversa. Il numero totale di immagini che possono essere acquisite sarà influenzato dall'intensità del fluoroforo viene esposta così come la sensibilità del microscopio confocale in uso. Fluorofori più intenso e più strumenti sensibili richiede tempi di esposizione più brevi e quindi producono meno photobleaching e fototossicità.
Un gran numero o sistemi di imaging sono disponibili. Daremo i dettagli sui sistemi che sono stati utilizzati nei nostri laboratori. Per gli embrioni di imaging verme dal giro microscopia confocale disco, usiamo un microscopio invertito Nikon TE2000U dotato di un Piano 60X/1.4 NA obiettivo Apo. Il microscopio è collegato ad una unità disco CSU10 Yokogawa spinning, una Hamamatsu C9100-13 EM CCD, e una spettrale Ricerca Applicata LMM5 laser modulo unione contenente quattro laser a stato solido con uscita a 405, 491, 561 e 655 nm. Utilizzando questo sistema siamo in grado di catturare uno o due canali, 6-12 piani focali, e 25-50 timepoints (tra i 30 ei 60 secondi). Un tipico tempo di esposizione è di 100 a 200 millisecondi.
Per gli embrioni di imaging con microscopia confocale a scansione laser, si utilizza un obiettivo Zeiss LSM700 dotata di 2 canali e quattro laser a stato solido (405, 488, 555 e 635 nm). Questo sistema è collegato a un microscopio Zeiss Observer Axio invertita con un piano-Apo obiettivo 63X/1.4NA utilizzato per l'imaging embrione. Il sistema utilizza il software Zeiss ZEN per l'acquisizione di immagini che fornisce anche l'elaborazione limitata delle immagini e analisi. Quando l'imaging con due fluorocromi, di solito si riuniscono 1-5 piani focali (~ 0.5 micron a parte) e raccogliere una pila Z ogni 15 secondi. Le collezioni sono continuò fino photobleaching di notevole gravità. Per generare la finale time-lapse video, immagini pila Z sono consolidate con il massimo strumento di proiezione nel software ZEN. I video sono esportati dal software come file avi.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Vorremmo ringraziare i finanziamenti del National Institutes of Health (R15-03 GM065444 a LB) e il programma di ricerca intramurale del National Institutes of Health (NIH) e l'Istituto Nazionale del Diabete e digestivi e malattie del rene (KO). Un premio NSF (DBI-0923402) finanziato l'acquisto del microscopio confocale LSM700. Vorremmo inoltre ringraziare l'assistenza generale e utili commenti sul manoscritto del Dr. Andy d'Oro. Merito va a tutta la C. elegans comunità per la condivisione di risorse, i protocolli e le idee.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Composizione |
|---|---|---|---|
| Uovo Buffer | 5mM Hepes pH 7,2, NaCl 110 mm, 4mm KCl, Acetato Mg 5mM, 5mm CaCl 2 | ||
| Mitotracker | Invitrogen | M-7512 | |
| Lysotracker | Invitrogen | L-7525 | |
| Pipettare iniezione capillare | Harvard Apparatus, Kent, Regno Unito | GC120F-10 | |
| Ago Puller | Kopf | Modello 700C | |
| Microinjector Apparatus | Tritech di ricerca | Minj-1 microiniezione regolatore |
Riferimenti
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J Vis Exp. (18), e833-e833 (2008).
- Hochbaum, D., Ferguson, A. A., Fisher, A. L. Generation of Transgenic C. elegans by Biolistic Transformation. J Vis Exp. (42), e2090-e2090 (2010).
- Brenner, S. The Genetics of Caenrohabditis elegans. Genetics. 77, 71-94 (1974).
- Oegema, K., Hyman, A. A. Cell division WormBook. , (2006).
- McNally, K. L., McNally, F. J. Fertilization initiates the transition from anaphase I to metaphase II during female meiosis in C. elegans. Dev Biol. 282, 218-230 (2005).
- Sato, K., Sato, M., Audhya, A., Oegema, K., Schweinsberg, P., Grant, B. D. Dynamic regulation of caveolin-1 trafficking in the germ line and embryo of Caenorhabditis elegans. Mol Biol Cell. 17, 3085-3094 (2006).
- Stitzel, M. L., Pellettieri, J., Seydoux, G. The C. elegans DYRK Kinase MBK-2 Marks Oocyte Proteins for Degradation in Response to Meiotic Maturation. Curr Biol. 16, 56-62 (2006).
- Schetter, A., Askjaer, P., Piano, F., Mattaj, I., Kemphues, K. Nucleoporins NPP-1, NPP-3, NPP-4, NPP-11 and NPP-13 are required for proper spindle orientation in C. elegans. Dev. Biol. 289, 360-371 (2006).
- Samuel, A. D., Murthy, V. N., Hengartner, M. O. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol. 1, (2001).
- Badrinath, A. S., White, J. S. Contrasting patterns of mitochondrial redistribution in the early lineages of Caenorhabditis elegans and Acrobeloides sp. PS1146. Dev. Biol. 258, 270-275 (2003).
- Johnston, W. L., Krizus, A., Dennis, J. W. The eggshell is required for meiotic fidelity, polar-body extrusion and polarization of the C. elegans embryo. BMC Biol. 4, 35-35 (2006).
- Parry, J. M., Velarde, N. V., Lefkovith, A. J., Zegarek, M. H., Hang, J. S., Ohm, J., Klancer, R., Maruyama, R., Druzhinina, M. K., Grant, B. D., Piano, F., Singson, A. EGG-4 and EGG-5 Link Events of the Oocyte-to-Embryo Transition with Meiotic Progression in C. elegans. Curr Biol. 19, 1752-1757 (2009).
- Centonze, V. E., White, J. G. Multiphoton excitation provides optical sections from deeper within scattering specimens than confocal imaging. Biophys J. 75, 2015-2024 (1998).
- Zinselmeyer, B. H., Dempster, J., Wokosin, D. L., Cannon, J. J., Pless, R., Parker, I., Miller, M. J. Two-photon microscopy and multidimensional analysis of cell dynamics. Methods Enzymol. 461, 349-378 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon