Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Los polímeros con memoria de forma para el cultivo celular activo
En este artículo
Resumen
Un método para el desarrollo de sustratos de cultivo de células con la capacidad de cambiar la topografía en la cultura se describe. El método hace uso de materiales inteligentes conocidos como polímeros con memoria de forma que tengan la capacidad de memorizar de una forma permanente. Este concepto se adapta a una amplia gama de materiales y aplicaciones.
Resumen
Polímeros con memoria de forma (SMP) son una clase de materiales "inteligentes" que tienen la capacidad de cambiar de una forma fija y temporal a una forma permanente de pre-determinado de la aplicación de un estímulo como el calor 1-5. En un ciclo de memoria de forma típica, la leche desnatada en polvo es la primera deformación a una temperatura elevada que es superior a su temperatura de transición, T trans [o bien la temperatura de fusión (T m) o la temperatura de transición vítrea (T g)]. La deformación es elástica en la naturaleza y sobre todo conduce a una reducción de la entropía conformacional de las cadenas de la red constituyente (siguiendo la teoría de la elasticidad de la goma). La deformada SMP se enfría a una temperatura por debajo de su T trans mientras se mantiene la tensión externa o el estrés constante. Durante el enfriamiento, las transiciones de material a un estado más rígido (semi-cristalino o vítreo), que atrapa cinéticamente o se "congela" el material en este estado de baja entropía que conduce a la fijación de forma macroscópica. Recuperación de la forma se activa de forma continua el calentamiento del material a través de T trans con un libre de estrés (sin restricciones) condición. Al permitir que las cadenas de la red (con movilidad recuperado) para relajarse a sus termodinámicamente favorecida, la máxima entropía del estado, el material pasa de forma temporal a la forma permanente.
Las células son capaces de agrimensura de las propiedades mecánicas de su entorno 6. Los mecanismos mediante los cuales las interacciones mecánicas entre las células y su comportamiento físico del ambiente de control celular son áreas de investigación activa. Sustratos de la topografía definida se han convertido en herramientas poderosas para la investigación de estos mecanismos. Mesoescala, microescala, y los patrones de nanoescala de la topografía del sustrato se ha demostrado que para dirigir la alineación de celdas, la adhesión celular, y las fuerzas de la célula de tracción 07/14. Estos hallazgos han puesto de relieve el potencial de la topografía del sustrato para el control y ensayo de las interacciones mecánicas entre las células y su entorno físico durante el cultivo celular, pero los sustratos utilizados hasta la fecha han sido en general pasiva y no puede ser programado para cambiar de manera significativa durante el cultivo. Este físico estancamiento ha limitado el potencial de sustratos para el control topográfico de las células en cultivo.
En este caso, activa de cultivo celular (ACC) los sustratos de leche desnatada en polvo se introducen, que emplean la memoria la superficie de forma que permita un control programado de la topografía del sustrato y la deformación. Estos sustratos demostrar la capacidad de transición de una topografía ranuras temporales a una segunda tópica, memorizado casi plana. Este cambio en la topografía se puede utilizar para controlar el comportamiento de la célula en condiciones estándar de cultivo celular.
Protocolo
1. Isotérmica de curado UV de NOA63
- Una cámara de curado costumbre se ha desarrollado utilizando una placa de vidrio (75 mm x 25 mm x 1 mm), un espaciador de 1 mm de espesor de teflón, y una placa de aluminio (75 mm x 25 mm x 3 mm) como se muestra en la Figura 1. La cámara se lleva a cabo junto con pequeños clips de carpeta.
- Inyectar el NOA63 en la cámara a través de un agujero en el separador de teflón con una aguja de calibre 18. El NOA63 pueden calienta suavemente para facilitar la inyección.
- Coloque la cámara en un plato caliente a 125 ° C y deje que el calor a una temperatura uniforme durante 5 min.
- Pre-curar la NOA63 en una cámara de luz UV (λ max = 365 nm, véase el cuadro) durante 20 minutos con la lámpara de 6,5 cm de la superficie del vidrio.
- Retire la NOA63 de la cámara en caliente con una hoja de afeitar.
- Después de curar la NOA63 bajo la luz UV durante 3 h 40 m en el plato caliente a 125 ° C.
- Guarde el NOA63 desecado a -20 ° C.
2. Caracterización de memoria de forma NOA63
- Preparar una muestra con mancuernas por prensado en caliente de un cura NOA63 película con una medida de perforación (véase el cuadro), cuyas dimensiones se muestran en la Figura 2.
- Cargar la muestra en un analizador mecánico dinámico (DMA; véase el cuadro) con fijación a la tracción. Configurar el instrumento a "fuerza controlada" el modo, entonces el programa del procedimiento de prueba de la siguiente manera:
- Equilibrar a 95,00 ° C
- Isotérmica de 10.00 min
- Rampa de fuerza 0,300 N / min a 2,500 N
- Isotérmica de 5.00 min
- Rampa de 2,00 ° C / min a 20,00 ° C
- Isotérmica de 10.00 min
- Rampa de fuerza 0,300 N / min a 0,015 N
- Isotérmica de 5.00 min
- Rampa de 2,00 ° C / min a 95.00 ° C
- Repita los pasos 2-9 dos veces más
3. Preparación de Sustratos de Cultivo Celular Activa
- Las muestras individuales se pueden preparar a partir de la película curada isotérmicamente SMP. Corte la película SMP con una navaja de tamaño de muestra deseado. Coloque la leche desnatada en polvo en un plato caliente a una temperatura superior a la Tg para reducir el módulo y la facilidad de corte.
- La forma temporal se puede fijar en un número de maneras diferentes. Aquí se utiliza un banco hidráulico superior de la prensa con calefacción / refrigeración placas de relieve una topografía temporal. Ajuste la temperatura de los platos a una temperatura por encima de la Tg.
- Una impresora fue realizada por epoxi curado en un disco de vinilo. Esto producirá una forma temporal de surcos paralelos. En este caso, la impresora había picos triangulares 35 a 40 m de alto y 60 micras de ancho, separadas 80 m de distancia. La impresora se puede hacer de otros materiales y con diferentes topografías, pero debe ser más rígido que el NOA63 a la temperatura de relieve. Coloque las muestras de leche desnatada en polvo boca abajo en la impresora y el lugar de las muestras y la impresora en la prensa.
- Aplicar un ~ 100 kPa de precarga para hacer contacto entre las placas de calefacción y las muestras y mantener durante ~ 5 minutos para permitir que las muestras alcancen una temperatura uniforme.
- Aplicar 6.1 MPa para las muestras y mantener durante 1 minuto. A la tensión de 4,7 MPa conduce a la replicación incompleta de la topografía impresora. La topografía temporales producidos ha redondeado picos de 25 a 35 m de altura y 150 micras. El SMP se fractura si una tensión más grande se aplica. Aplicar pequeños esfuerzos para introducir la topografía con pequeñas amplitudes.
- Reducir la temperatura por debajo de la Tg. Aquí se utiliza la capacidad de enfriamiento de agua de los platos de prensa.
- Cuando la temperatura está por debajo de la Tg, quitar la fuerza aplicada.
- Las muestras pueden ser almacenadas desecado a -20 ° C. Cuando se almacena en estas condiciones, hemos observado una disminución de menos de 1 m de amplitud en la recuperación después de dos meses para las muestras de relieve con la impresora de discos de vinilo.
4. Celda activa Experimento Cultura
- La luz ultravioleta de una cabina de seguridad biológica (BSC) se usa para esterilizar las muestras. Organizar las muestras boca abajo en placas estériles sin tapa y encienda la luz UV BSC durante 6 h.
- Muestras de vuelta a las nuevas placas estériles boca arriba. Encienda la luz UV BSC durante 6 h.
- Las muestras de ahora deben ser equilibrados a un estado relativamente estable de las placas, con las células. Colocar las muestras en una placa de 96 pocillos y añadir 150 ml de medio de cultivo completo.
- Colocar la placa en una incubadora de 30 ° C con 5% de CO 2 hasta llegar a la deseada recuperación parcial. Aquí usamos 30 horas para producir muestras de amplitud suficiente para alinear las celdas.
- Las muestras pueden ahora ser plateado con las células. Colocar las muestras en una nueva placa de 96 pocillos.
- Añadir 150 ml de solución de células de las muestras. Aquí se utiliza C3H/10T1/2 fibroblastos embrionarios de ratón en 20.000 células / ml para lograr células aisladas (por lo general no están en contacto con otras células).
- Para permitir que las células se adhieren y difusión de la topografía temporal, el lugar en una incubadora de 30 ° C durante 9,5 h.
- Para morfología ensayo de célulasgía antes de la transición, extraer muestras y realizar la tinción y imágenes de fluorescencia de las muestras. Este material presenta a través de la mayor parte de autofluorescencia el rango UV y visible. Fluoróforos en el extremo rojo del espectro, como Alexa Fluor 647 se recomiendan para reducir el fondo.
- Para disparar muestras de recuperación, mover la placa a una incubadora a 37 ° C y al cultivo de 19 horas para permitir que el material para recuperarse y permitir que las células de adaptar su morfología a la nueva topografía.
- Extraer muestras y aplicar tinte adecuado (phalloidin de filamentos de actina de imagen) y procedimientos por imágenes.
5. Los resultados representativos:
Curado NOA63 es un sólido transparente, cristalino que tiene excelentes propiedades de memoria de forma, como se muestra en la Figura 3. En este caso, el material fue curado como en el Protocolo 1 anterior y muestra una uniforme g T de 51,1 ° C (determinada a partir del inicio de la caída de E '). Se observa un ciclo de la forma de memoria de forma (calentamiento, deformación, enfriamiento, la recuperación, la figura 3) que, un gran porcentaje de la tensión se ha fijado después de la descarga a 20 ° C, que corresponde a una relación de fijación de 15 (R f) de 89,3 % (promedio de tres ciclos, el mismo por debajo de R r). La tensión fija se recuperó en una tasa de recuperación (R r) del 84,4% en un rango de temperatura relativamente pequeño durante el calentamiento. Además, el rendimiento de memoria de forma no mostraron deterioro hasta tres ciclos, en el que todas las curvas siguen casi exactamente con los demás.
NOA63 se utilizó en este protocolo, ya que está disponible desde el fabricante y se suministra como un cura fácilmente sin disolventes prepolímero con fotoiniciador. Sin embargo, su composición no se da a conocer por el proveedor. Se encontró para permitir la instalación de células de alta y su viabilidad. Por último, la temperatura de transición podría ser ajustado para permitir una magnitud significativa de la recuperación entre dos temperaturas de células compatibles. Un número de otros sistemas de polímero también se podría utilizar con este protocolo, si la temperatura de transición es compatible con el cultivo de células y si promueven la adhesión celular y la viabilidad.
La amplitud de la topografía temporal (ranuras) disminuye con el tiempo a 30 ° C. Por 30 horas a 30 ° C, la amplitud se ha reducido en aproximadamente el 50% (Figura 4, el tiempo 0) 16. Reduce un 10% en los próximos 9,5 h. Cuando la recuperación es provocada por el aumento de la temperatura a 37 ° C, la amplitud se reduce a 0,5% de la amplitud inicial en 9,5 h. Para utilizar la impresora y una tensión de 4,9 MPa relieve, esto corresponde a un cambio funcional de 13 ranuras micras a una superficie casi plana.
Un ejemplo de un comportamiento de la célula controlada mediante el uso de activos sustratos de cultivo celular es un cambio en la organización del citoesqueleto. El temporal de sustratos ranuras antes de la recuperación se activa, el microfilamentos de actina alinean a lo largo de la dirección de los surcos (Figura 5) 16. Después de la recuperación por el aumento de la temperatura, los microfilamentos se han reorganizado y están orientadas al azar. Las muestras de control que tienen ranuras estática o una superficie plana y estática no reorganizarse después de que el aumento de la temperatura (Figura 5b, c).
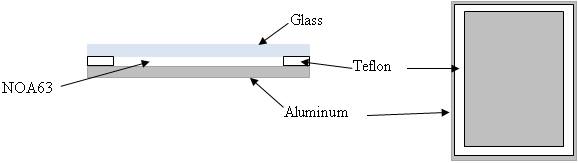
Figura 1: Esquema para la cámara de curado NOA63. En sección transversal (izquierda) y de arriba a abajo sin cubierta de vidrio (derecha).
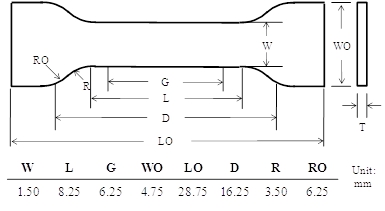
Figura 2: La geometría de la pesa de gimnasia utilizados para la caracterización a granel con memoria de forma W:. Ancho de sección estrecha, L: longitud de sección estrecha, G: longitud de la galga, WO: anchura total, LO: longitud total, D: distancia entre mordazas, R: radio del filete, y RO: radio exterior.
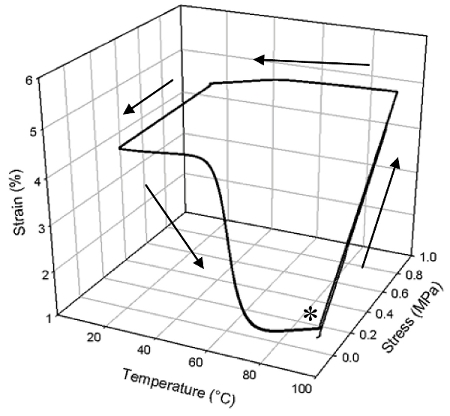
Figura 3: La mayor parte de una vía con memoria de forma de un único NOA63 cura, que se repite tres veces (el asterisco indica el inicio experimental). En el punto marcados con un asterisco, el polímero se ha calentado y se deforma entonces mediante la aplicación de un estrés para definir su forma temporal. Esta cepa se mantiene constante, y se reduce la temperatura para fijar la forma temporal por debajo de la Tg del polímero. La temperatura se incrementa, y el material recupera su forma permanente de la cepa temporal se reduce.
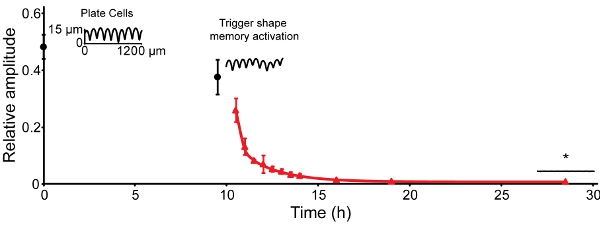
Figura 4: Recuperación de leche desnatada en polvo puede ser activado en cultivo celular compatible con la temperatura. La amplitud de 25,6 ± 0,8 micras presente rec siguientes relieveovered a 12,6 ± 1,5 m después de 30 h de equilibrio a 30 ° C (tiempo 0, los círculos de color negro). Después las muestras fueron trasladados a una incubadora a 37 ° C (9,5 h), la amplitud se recuperó a 1,1 ± 0,2 micras dentro de 3,5 h. La amplitud se recuperó hasta ~ 0,3 ± 0,1 micras dentro de 9,5 horas y ninguna disminución detectable en la final de 9,5 h se observó (triángulos rojos). Las barras de error representan una desviación estándar (n = 4-6). Las huellas son el contacto exploraciones perfilometría de muestras representativas.
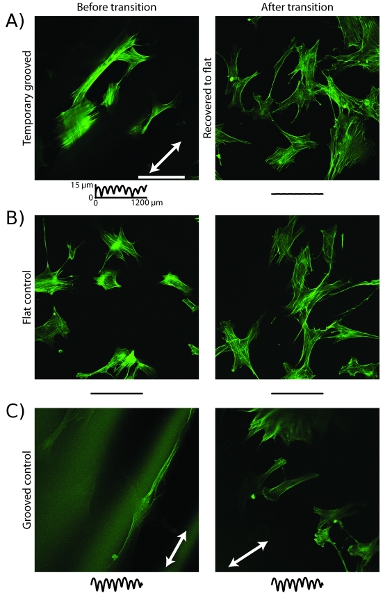
Figura 5: citoesqueleto de actina celular se reorganiza después de la transición topográfica una imagen, confocal de células teñidas con phalloidin sobre soportes grabados muestran microfilamentos línea con la dirección ranura (flecha blanca) antes de la transición y el aumento de la temperatura.. Después de la transición, los microfilamentos han reorganizado están orientadas al azar. B, las células en sustratos de control de piso piloto microfilamentos orientadas al azar antes y después del aumento de la temperatura. C, las células en sustratos de control ranurado mostrar microfilamentos línea con la dirección ranura antes y después del aumento de la temperatura. Barra de escala es de 100 micras. Las huellas son como en la Figura 4.
Discusión
La Tg de NOA63 se puede controlar fácilmente a través de la temperatura de curado. Se utilizó esto para generar sustratos SMP que puede ser activado en un rango compatible con celulares. NOA63 se plastifica por el agua que baja la T g seco, por lo que el aumento de la Tg seca por secado a 125 º C para mover el rango de Tg húmeda entre 30 y 37 ° C.
Los sustratos de células de cultivo activo demostrado son capaces de controlar el comportamiento celular. ...
Divulgaciones
Agradecimientos
Los autores desean agradecer a Kelly A. Burke de asistencia técnica con la preparación del sustrato ACC. Con base en el artículo publicado en Biomateriales, Davis KA, et al, el comportamiento de células con memoria de forma dinámica en sustratos de polímeros, biomateriales, doi:. 10.1016/j.biomaterials.2010.12.006, Copyright Elsevier (2011). Este material está basado en trabajo apoyado por la NSF con la beca No. DMR-0907578.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo o instrumento | Empresa | Número de catálogo | Comentarios (opcional) |
| NOA63 | Norland Products Inc. | NOA63 | Número de lote 111 |
| Ponche de hueso de perro | TestResource, Inc. Bloomington, MN | A escala reducida de tipo IV de hueso de perro (ASTM D638-03) | |
| Prensa Hidráulica de sobremesa | Tallista | 3851 | |
| C3H10T1 / 2 ratón fibroblastos embrionarios | ATCC | CCL-226 | |
| Gabinete de Seguridad Biológica | Thermo Fisher | 1357 | |
| Lámpara UV | Spectroline | SB-100PC | |
| Analizador dinámico mecánico (DMA) | TA Instruments, Inc. | Q800 | |
| Microscopio de fluorescencia invertido | Leica | Leica DMI 4000B | |
| Confocal Laser Scanning Microscope | Zeiss | LSM 710 | 20x/0.8 NA aire o un objetivo 40x/1.30 NA petróleo |
Referencias
- Liu, C., Qin, H., Mather, P. T. Review of progress in shape-memory polymers. J. Mater. Chem. 17, 1543-1543 (2007).
- Mather, P. T., Luo, X. F., Rousseau, I. A. Shape Memory Polymer Research. Annu. Rev. Mater. Res. 39, 445-445 (2009).
- Lendlein, A., Kelch, S. Shape Memory Polymers. Angew. Chem. Int. Edit. 41, 2034-2034 (2002).
- Ratna, D., Karger-Kocsis, J. Recent advances in shape memory polymers and composites: a review. J. Mater. Sci. 43, 254-254 (2008).
- Rousseau, I. A. Challenges of shape memory polymers: A review of the progress toward overcoming SMP's limitations. Polym. Eng. Sci. 48, 2075-2075 (2008).
- Pelham, R. J., Wang, Y. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad. Sci. U. S. A. 94, 13661-13661 (1997).
- Addae-Mensah, K. A., Kassebaum, N. J., Bowers, M. J., Reiserer, R. S., Rosenthal, S. J., Moore, P. E., Wikswo, J. P. A flexible, quantum dot-labeled cantilever post array for studying cellular microforces. Sensor Actuat. a-Phys. 136, 385-385 (2007).
- du Roure, O., Saez, A., Buguin, A., Austin, R. H., Chavrier, P., Siberzan, P., Ladoux, B. Force mapping in epithelial cell migration. Proc. Natl. Acad. Sci. U. S. A. 102, 2390-2390 (2005).
- Lam, T., Clem, W. C., Takayama, S. Reversible on-demand cell alignment using reconfigurable microtopography. Biomaterials. 29, 1705-1705 (2008).
- Stevens, M. M., George, J. H. Exploring and engineering the cell surface interface. Science. 310, 1135-1135 (2005).
- Tan, L., Tien, J., Pirone, D. M., Gray, D. S., Bhadriraju, K., Chen, C. S. Cells lying on a bed of microneedles: an approach to isolate mechanical. 100, 1484-1484 (2003).
- Teixeira, A. I., Nealey, P. F., Murphy, C. J. Responses of human keratocytes to micro- and nanostructured substrates. J. Biomed. Mater. Res. A. 71A, 369-369 (2004).
- Yang, M., Sniadecki, N., Chen, C. Geometric Considerations of Micro- to Nanoscale Elastomeric Post Arrays to Study Cellular Traction Forces. Adv. Mater. 19, 3119-3119 (2007).
- Zhao, Y., Zhang, X. Cellular Mechanics Study in Cardiac Myocytes Using PDMS Pillars Array. Sensor Actuat. a-Phys. 125, 398-398 (2006).
- DiOrio, A. M., Luo, X., Lee, K. M., Mather, P. T. A Functionally Graded Shape Memory Polymer. Soft Matter. 7, 68-68 (2011).
- Davis, K. A., Burke, K. A., Mather, P. T., Henderson, J. H. Dynamic cell behavior on shape memory polymer substrates. Biomaterials. 32, 2285-2285 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados