È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Shape Memory Polymers per la Cultura cella attiva
In questo articolo
Riepilogo
Un metodo per lo sviluppo di substrati di coltura cellulare con la possibilità di cambiare topografia durante cultura è descritto. Il metodo si avvale di materiali intelligenti conosciute come i polimeri a memoria di forma che hanno la capacità di memorizzare una forma permanente. Questo concetto è adattabile ad una vasta gamma di materiali e applicazioni.
Abstract
Polimeri a memoria di forma (SMP) sono una classe di materiali "intelligenti" che hanno la capacità di passare da un fisso, la forma temporanea di un pre-determinata forma permanente dopo l'applicazione di uno stimolo come il calore 1-5. In un tipico ciclo di memoria di forma, la SMP è prima deformato a temperatura elevata che è superiore alla temperatura di transizione, T trans [sia la temperatura di fusione (T m) o la temperatura di transizione vetrosa (Tg)]. La deformazione è elastica in natura e porta principalmente ad una riduzione di entropia conformazionale delle catene rete costituente (seguendo la teoria di elasticità della gomma). La deformata SMP è poi raffreddato ad una temperatura inferiore al T trans, mantenendo la tensione esterno o costante stress. Durante il raffreddamento, le transizioni materiale ad uno stato più rigido (semi-cristallina o vetrosa), che cineticamente trappole o "congela" il materiale in questo stato di bassa entropia che porta a fissare la forma macroscopica. Recupero della forma è innescata da continuamente il riscaldamento del materiale attraverso T trans sotto uno stress-free (senza vincoli) condizione. Permettendo che le catene di rete (con mobilità riacquistato) per rilassarsi alla loro termodinamicamente favorito, massima entropia dello stato, i cambiamenti materiale dalla forma temporanea alla forma permanente.
Le cellule sono in grado di rilevare le proprietà meccaniche del loro ambiente circostante 6. I meccanismi attraverso i quali interazioni meccaniche tra le cellule e il loro ambiente fisico controllare il comportamento delle cellule sono aree di ricerca attiva. Substrati di topografia definite sono emersi come potenti strumenti nelle indagini di questi meccanismi. Mesoscala, microscala, e modelli su scala nanometrica della topografia del substrato è stato dimostrato per dirigere l'allineamento delle cellule, adesione cellulare, e le forze di trazione delle cellule 7-14. Questi risultati hanno sottolineato il potenziale per topografia del substrato per il controllo e il dosaggio delle interazioni meccaniche tra le cellule e il loro ambiente fisico durante colture cellulari, ma i substrati utilizzati fino ad oggi sono state in genere passivo e non potrebbe essere programmato per cambiare in modo significativo durante cultura. Questa stasi fisica ha limitato le potenzialità di supporti topografici per il controllo delle cellule in coltura.
Qui, coltura cellulare attivo (ACC) sono introdotti substrati SMP che impiegano a memoria di forma della superficie per fornire un controllo programmato della topografia del substrato e deformazioni. Questi substrati dimostrare la capacità di passare da una topografia temporanea scanalata per un secondo, topografia quasi piatta memorizzato. Questo cambiamento di topografia può essere utilizzato per controllare il comportamento delle cellule in condizioni standard di coltura cellulare.
Protocollo
1. Isotermico UV di NOA63
- Una camera di cura personalizzati è stato sviluppato utilizzando una lastra di vetro (75 mm x 25 mm x 1 mm), un 1 distanziatore mm di spessore in teflon, e di una piastra di alluminio (75 mm x 25 mm x 3 mm), come mostrato nella Figura 1. La camera è tenuto insieme con clip legante di piccole dimensioni.
- Iniettare il NOA63 nella camera attraverso un buco nel distanziatore in teflon con un 18 gauge. Il NOA63 può essere riscaldata leggermente per facilitare l'iniezione.
- Posizionare la camera su una piastra riscaldante fissato a 125 ° C e permettono di riscaldare ad una temperatura uniforme per 5 min.
- Pre-curare la NOA63 in una camera lampada UV (λ max = 365 nm, vedi tabella) per 20 minuti con la lampada 6,5 centimetri dalla superficie del vetro.
- Rimuovere il NOA63 dalla camera a caldo con una lama di rasoio.
- Post-cura la NOA63 sotto la luce UV per 3 h 40 m sulla piastra riscaldante a 125 ° C.
- Conservare il NOA63 essiccato a -20 ° C.
2. Caratterizzazione forma di memoria di NOA63
- Preparare un campione manubrio da caldo la pressione di un curato NOA63 film con un pugno personalizzato (vedi tabella), le cui dimensioni sono riportate nella Figura 2.
- Caricare il campione in un analizzatore dinamico meccanico (DMA, vedi tabella) con il dispositivo di trazione. Impostare lo strumento per "forza controllata" modalità, quindi programmare la procedura di test come segue:
- Equilibrare a 95,00 ° C
- Isotermici per 10,00 min
- Rampa di forza di 0,300 N / min a 2.500 N
- Isotermici per 5,00 min
- Rampa di 2,00 ° C / min a 20,00 ° C
- Isotermici per 10,00 min
- Rampa di forza di 0,300 N / min a 0.015 N
- Isotermici per 5,00 min
- Rampa di 2,00 ° C / min a 95,00 ° C
- Ripetere i passaggi 2-9 altre due volte
3. Preparazione dei supporti attivi coltura cellulare
- I singoli campioni possono essere preparati dal film curata isotermicamente SMP. Tagliare la pellicola SMP con un rasoio per dimensione del campione desiderato. Posizionare il SMP su un piatto caldo ad una temperatura superiore a quella g T per ridurre il modulo e la facilità di taglio.
- La forma temporanea può essere fissato in un certo numero di modi diversi. Qui usiamo un top pressa idraulica da banco con riscaldamento / raffreddamento a piastre in rilievo una topografia temporanea. Impostare la temperatura della piastre ad una temperatura al di sopra della T g.
- Un goffratore è stata fatta da epossidico su un disco in vinile. Questo produrrà una forma temporanea di scanalature parallele. Qui, il goffratore avuto picchi triangolare 35-40 micron e 60 micron di alta gamma, distanziati 80 micron di distanza. Il goffratore può essere fatto da altri materiali e con diverse topografie, ma deve essere più rigido NOA63 alla temperatura goffratura. Posizionare i campioni SMP faccia in giù sul goffratore e posto i campioni e goffratore sulla stampa.
- Applicare un precarico ~ 100 kPa di stabilire un contatto tra le piastre di riscaldamento e dei campioni e tenere premuto per ~ 5 minuti per permettere i campioni di raggiungere una temperatura uniforme.
- Applicare 1-6 MPa ai campioni e tenere premuto per 1 minuto. Una tensione di 4,7 MPa porta alla replicazione incompleta della topografia goffratore. La topografia temporanea prodotta ha picchi arrotondati 25-35 micron di altezza e 150 micron di larghezza. La SMP si frattura se uno stress maggiore viene applicata. Applicare piccole sollecitazioni di introdurre topografie con piccole ampiezze.
- Ridurre la temperatura al di sotto del g T. Qui usiamo la capacità di raffreddamento ad acqua della piastre stampa.
- Quando la temperatura è inferiore al g T, rimuovere la forza applicata.
- I campioni possono essere conservati essiccati a -20 ° C. Se conservato in queste condizioni, abbiamo osservato una diminuzione meno di 1 micron di ampiezza di recupero dopo due mesi per i campioni in rilievo con la goffratore disco in vinile.
4. Attivo cella Esperimento Cultura
- La luce UV di una cappa di sicurezza biologica (BSC) è usato per sterilizzare i campioni. Disporre i campioni a faccia in giù in piatti sterile senza coperchi e accendere la luce UV BSC per 6 h.
- Campioni flip per nuovi piatti sterile a faccia in su. Accendere la luce UV BSC per 6 h.
- I campioni ora devono essere equilibrati a uno stato relativamente stabile prima di placcatura con le cellule. Mettere i campioni in una piastra da 96 pozzetti e aggiungere 150 ml di mezzo di crescita completa.
- Mettete la placca in un incubatore a 30 ° C con 5% di CO 2 fino a raggiungere la desiderata ripresa parziale. Qui usiamo 30 h per la produzione di campioni con grande ampiezza sufficiente per allineare le cellule.
- I campioni possono essere placcati con le cellule. Mettere i campioni in una nuova piastra da 96 pozzetti.
- Aggiungere 150 ml di soluzione delle cellule ai campioni. Qui usiamo C3H/10T1/2 fibroblasti embrionali di topo a 20.000 cellule / ml per ottenere cellule isolate (in genere non in contatto con altre cellule).
- Per consentire alle cellule di fissare e diffondere sulla topografia temporaneo, posto in un incubatore a 30 ° C per 9,5 h.
- Per morfologia saggio cellularegia prima di transizione, rimuovere campioni e procedere alla colorazione e di imaging di fluorescenza dei campioni. Questo materiale presenta autofluorescenza attraverso la maggior parte della gamma UV e visibile. Fluorofori in fondo rossa dello spettro, come Alexa Fluor 647 sono raccomandati per ridurre il fondo.
- Per attivare i campioni di recuperare, spostare la piastra a 37 ° C in incubatore e continuare la cultura per 19 h per permettere il materiale da recuperare e permettono alle cellule di adattare la loro morfologia alla nuova topografia.
- Rimuovere i campioni e applicare appropriati macchia (falloidina per filamentosa actina imaging) e le procedure di imaging.
5. Rappresentante dei risultati:
Curato NOA63 è un sistema trasparente, solido vetroso che ha eccellenti proprietà di memoria di forma come mostrato nella Figura 3. In questo caso il materiale è stato curato come nel protocollo n. 1 e mostra una uniforme T g di 51,1 ° C (determinato dalla comparsa di caduta E '). Si osserva da quella forma di cicli modo memoria (riscaldamento, deformare, raffreddamento, recupero, figura 3) che, una grande percentuale di ceppo è stato fissato dopo lo scarico a 20 ° C, corrispondenti a un rapporto di fissaggio 15 (R f) di 89,3 % (media su tre cicli: il sottostante stesso per R r). Il ceppo fisso recuperato con un rapporto di recupero (R r) del 84,4% in un range di temperatura relativamente piccola durante il riscaldamento. Inoltre, le prestazioni a memoria di forma non ha mostrato alcun peggioramento sino a tre cicli, nel senso che tutte le curve seguono quasi esattamente con l'altro.
NOA63 è stato utilizzato in questo protocollo in quanto è facilmente reperibile dal produttore e fornito come facilmente curata senza solventi prepolimero con fotoiniziatore. Tuttavia, la sua composizione non è indicato dal fornitore. E 'stato trovato per consentire l'attaccamento e la vitalità delle cellule alte. Infine, la temperatura di transizione potrebbe essere sintonizzato per consentire una grandezza significativa di recupero tra due temperature cellulari compatibili. Un certo numero di altri sistemi polimerici potrebbe essere utilizzato anche con questo protocollo se la temperatura di transizione è compatibile con le colture cellulari e se promuovono l'adesione cellulare e la vitalità.
L'ampiezza della topografia temporanea (scanalature) diminuisce nel tempo a 30 ° C. Da 30 ore a 30 ° C, l'ampiezza è stata ridotta di circa il 50% (Figura 4, tempo 0) 16. Riduce un altro 10% nei prossimi 9,5 h. Quando la ripresa viene attivato aumentando la temperatura a 37 ° C, l'ampiezza si riduce a 0,5% dell'ampiezza iniziale entro 9,5 h. Per la goffratore utilizzati e uno stress goffratura di 4,9 MPa, ciò corrisponde a un cambiamento funzionale di 13 micron scanalature ad una superficie quasi piana.
Un esempio di comportamento cellulare controllato attraverso l'utilizzo di substrati attivi coltura cellulare è un cambiamento nella organizzazione del citoscheletro. Su supporti temporanei scanalato prima del recupero è attivato, i microfilamenti di actina allinearsi lungo la direzione delle scanalature (Figura 5a) 16. Dopo il recupero di aumento della temperatura, i microfilamenti sono riorganizzati e sono orientate in modo casuale. I campioni di controllo che hanno scanalature statica o di una superficie piana statico non riorganizzarsi dopo l'aumento di temperatura (Figura 5b, c).
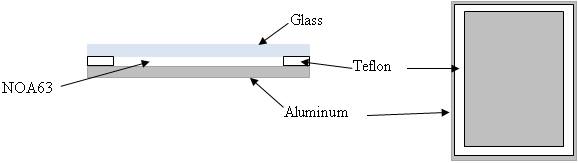
Figura 1: Schema per NOA63 camera di stagionatura. Sezione trasversale (a sinistra) e vista dall'alto senza coperchio in vetro (a destra).
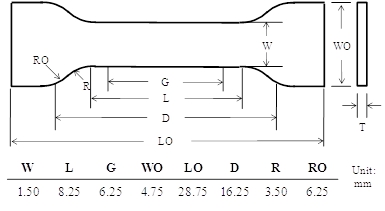
Figura 2: La geometria manubri utilizzati per la caratterizzazione di massa a memoria di forma W:. Larghezza della sezione ristretta, L: lunghezza della sezione ristretta, G: lunghezza gage, WO: larghezza complessiva, LO: lunghezza fuori tutto, D: distanza tra le impugnature, R: raggio di raccordo e RO: raggio esterno.
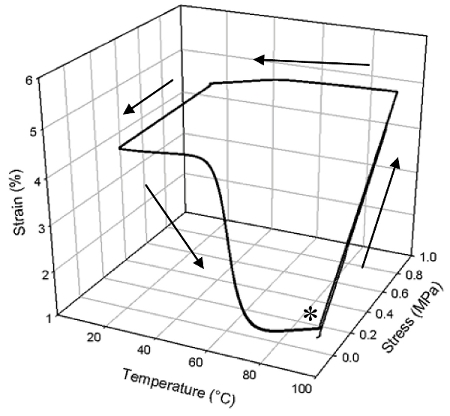
Figura 3: Il senso unico memoria di massa la forma di un singolo NOA63 cura, ripetuta 3 volte (l'asterisco indica insorgenza sperimentale). Al punto indicato con un asterisco, il polimero è stato riscaldato e poi viene deformato mediante l'applicazione di uno sforzo per definire la sua forma temporanea. Questo ceppo è mantenuta costante, e la temperatura è scesa a fissare la forma temporanea di sotto della T g del polimero. La temperatura viene poi aumentata, e il materiale recupera la sua forma permanente come la deformazione temporanea è ridotta.
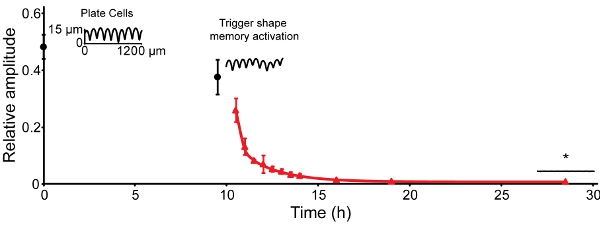
Figura 4: recupero SMP può essere attivato in coltura cellulare compatibile temperature. L'ampiezza di 25,6 ± 0,8 micron presenti i seguenti rec goffraturaovered a 12,6 ± 1,5 micron dopo 30 equilibratura ore a 30 ° C (tempo 0, cerchi neri). Dopo che i campioni sono stati spostati in un incubatore a 37 ° C (9,5 h), l'ampiezza recuperato a 1,1 ± 0,2 micron entro 3,5 h. L'ampiezza recuperato a ~ 0,3 ± 0,1 micron entro 9,5 ore e non diminuire rilevabile nelle ultime 9,5 h è stato osservato (triangoli rossi). Le barre di errore rappresentano una deviazione standard (n = 4-6). Le tracce sono scansioni contatto profilometria di campioni rappresentativi.
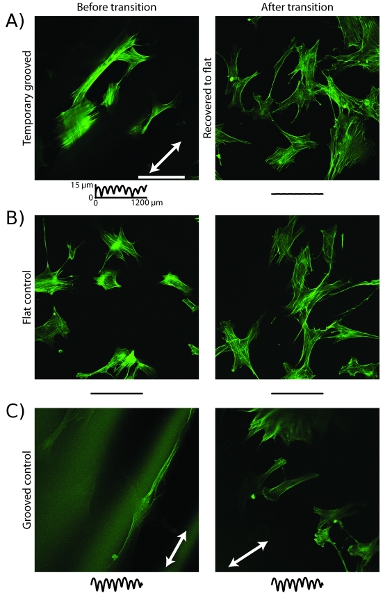
Figura 5: actina del citoscheletro cellulare riorganizza dopo uno transizione topografiche, le immagini confocale di cellule colorate con falloidina su supporti in rilievo mostrano microfilamenti allineata con la direzione scanalatura (freccia bianca) prima di transizione e di aumento della temperatura.. Dopo la transizione, microfilamenti sono riorganizzate sono orientate in modo casuale. B, cellule su substrati di controllo piatto mostrare microfilamenti orientati a caso, prima e dopo l'aumento della temperatura. C, cellule su substrati di controllo scanalati spettacolo microfilamenti allineata con la direzione solco prima e dopo l'aumento della temperatura. Barra di scala è di 100 micron. Le tracce sono come in Figura 4.
Discussione
G T di NOA63 può essere facilmente controllato tramite la temperatura di polimerizzazione. Abbiamo usato questo per generare supporti SMP che può essere attivato in un intervallo di celle compatibile. NOA63 è plastificato con l'acqua che abbassa il secco T g, così abbiamo aumentato il secco T g da una cottura a 125 ° C per spostare il campo bagnato Tg tra i 30 ei 37 ° C.
L'attivo substrati di coltura cellulare hanno dimostrato in grado di contro...
Divulgazioni
Riconoscimenti
Gli autori desiderano ringraziare Kelly A. Burke per l'assistenza tecnica con la preparazione dei supporti ACC. Sulla base l'articolo pubblicato in Biomateriali, Davis KA et al, il comportamento dinamico delle cellule a memoria di forma su substrati polimerici, biomateriali, doi:. 10.1016/j.biomaterials.2010.12.006, Copyright Elsevier (2011). Questo materiale si basa su lavoro supportato da NSF sotto Grant No. DMR-0907578.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente o strumento | Azienda | Numero di catalogo | Commenti (opzionale) |
| NOA63 | Norland Products Inc. | NOA63 | Lotto numero 111 |
| Dogbone Punch | TestResource, Inc. Shakopee, MN | Ridotta Tipo IV Dogbone (ASTM D638-03) | |
| Pressa da banco | Intagliatore | 3851 | |
| C3H10T1 / 2 Mouse fibroblasti embrionali | ATCC | CCL-226 | |
| Cappa di sicurezza biologica | Thermo Fisher | 1357 | |
| Lampada UV | Spectroline | SB-100PC | |
| Analizzatore dinamico meccanico (DMA) | TA Instruments, Inc. | Q800 | |
| Invertito microscopio a fluorescenza | Leica | Leica DMI 4000B | |
| Microscopio confocale a scansione laser | Zeiss | LSM 710 | 20x/0.8 NA aria o un olio 40x/1.30 NA obiettivo |
Riferimenti
- Liu, C., Qin, H., Mather, P. T. Review of progress in shape-memory polymers. J. Mater. Chem. 17, 1543-1543 (2007).
- Mather, P. T., Luo, X. F., Rousseau, I. A. Shape Memory Polymer Research. Annu. Rev. Mater. Res. 39, 445-445 (2009).
- Lendlein, A., Kelch, S. Shape Memory Polymers. Angew. Chem. Int. Edit. 41, 2034-2034 (2002).
- Ratna, D., Karger-Kocsis, J. Recent advances in shape memory polymers and composites: a review. J. Mater. Sci. 43, 254-254 (2008).
- Rousseau, I. A. Challenges of shape memory polymers: A review of the progress toward overcoming SMP's limitations. Polym. Eng. Sci. 48, 2075-2075 (2008).
- Pelham, R. J., Wang, Y. L. Cell locomotion and focal adhesions are regulated by substrate flexibility. Proc. Natl. Acad. Sci. U. S. A. 94, 13661-13661 (1997).
- Addae-Mensah, K. A., Kassebaum, N. J., Bowers, M. J., Reiserer, R. S., Rosenthal, S. J., Moore, P. E., Wikswo, J. P. A flexible, quantum dot-labeled cantilever post array for studying cellular microforces. Sensor Actuat. a-Phys. 136, 385-385 (2007).
- du Roure, O., Saez, A., Buguin, A., Austin, R. H., Chavrier, P., Siberzan, P., Ladoux, B. Force mapping in epithelial cell migration. Proc. Natl. Acad. Sci. U. S. A. 102, 2390-2390 (2005).
- Lam, T., Clem, W. C., Takayama, S. Reversible on-demand cell alignment using reconfigurable microtopography. Biomaterials. 29, 1705-1705 (2008).
- Stevens, M. M., George, J. H. Exploring and engineering the cell surface interface. Science. 310, 1135-1135 (2005).
- Tan, L., Tien, J., Pirone, D. M., Gray, D. S., Bhadriraju, K., Chen, C. S. Cells lying on a bed of microneedles: an approach to isolate mechanical. 100, 1484-1484 (2003).
- Teixeira, A. I., Nealey, P. F., Murphy, C. J. Responses of human keratocytes to micro- and nanostructured substrates. J. Biomed. Mater. Res. A. 71A, 369-369 (2004).
- Yang, M., Sniadecki, N., Chen, C. Geometric Considerations of Micro- to Nanoscale Elastomeric Post Arrays to Study Cellular Traction Forces. Adv. Mater. 19, 3119-3119 (2007).
- Zhao, Y., Zhang, X. Cellular Mechanics Study in Cardiac Myocytes Using PDMS Pillars Array. Sensor Actuat. a-Phys. 125, 398-398 (2006).
- DiOrio, A. M., Luo, X., Lee, K. M., Mather, P. T. A Functionally Graded Shape Memory Polymer. Soft Matter. 7, 68-68 (2011).
- Davis, K. A., Burke, K. A., Mather, P. T., Henderson, J. H. Dynamic cell behavior on shape memory polymer substrates. Biomaterials. 32, 2285-2285 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon