Method Article
Multi-fotón imágenes de invasión de células tumorales en un modelo de ratón ortotópico de carcinoma oral de células escamosas
En este artículo
Resumen
Una visión global de las técnicas involucradas en la generación de un modelo de ratón de cáncer oral y el control cuantitativo de la invasión del tumor dentro de la lengua a través de multi-fotón microscopio de las células marcadas se presenta. Este sistema puede servir como una plataforma útil para la evaluación molecular y la eficacia de los medicamentos de compuestos anti-invasiva.
Resumen
Loco-regional invasión de cáncer de cabeza y cuello, está vinculado al riesgo de metástasis y presenta un reto difícil en el diseño e implementación de estrategias de gestión de pacientes. Ortotópico modelos de ratón de cáncer oral se han desarrollado para facilitar el estudio de los factores que la invasión de impacto y servir como sistema modelo para evaluar la terapéutica anti-tumoral. En estos sistemas, la visualización de las células del tumor diseminado dentro de los tejidos cavidad oral generalmente ha llevado a cabo por cualquiera de histología convencional o con métodos in vivo bioluminiscente. Un inconveniente principal de estas técnicas es la incapacidad inherente para visualizar y cuantificar con precisión la invasión temprana de células tumorales derivadas de la localización primaria en tres dimensiones. Aquí se describe un protocolo que combina un modelo establecido para el carcinoma de células escamosas de la lengua (SCOT), con imágenes de dos fotones para permitir la visualización multi-vectorial de propagación del tumor lingual. La OSC-19 de cabeza y cuello, la línea de células tumorales se ha diseñado de forma estable para expresar la LifeAct F-actina péptido de unión fusionada con la proteína fluorescente mCherry (LifeAct-mCherry). Fox1 nu / nu ratones inyectados con estas células de forma fiable forman tumores que permiten que la lengua para ser visualizados por el ex-vivo de aplicación de la microscopía de dos fotones. Esta técnica permite la visualización ortotópico de la masa tumoral y la invasión de las células a nivel local en lenguas extirpadas sin interrupción del microambiente tumoral regional. Además, este sistema permite la cuantificación de la invasión de células tumorales mediante el cálculo de las distancias que invadió a que las células de la localización del tumor primario. En general este procedimiento proporciona un modelo de sistema mejorado para el análisis de los factores que contribuyen a la invasión SCOT y los tratamientos terapéuticos diseñados para prevenir la invasión local y metástasis distantes. Este método también tiene el potencial de ser en última instancia, en combinación con otras modalidades de imágenes en un entorno en vivo.
Protocolo
1. Líneas Celulares, Construcción de vectores y Producción lentivirales
- Cabeza humana y las células tumorales del cuello líneas (o OSC19 UMSCC1) se cultivaron en medio completo que consta de DMEM (gato Cellgro # 50-003-PB), complementado con fetal bovino al 10% FBS suero (cat # SH30070.03 Hyclone), 1% de penicilina / estreptomicina (gato Cellgro º 30-002-CI), y el 1% no aminoácidos esenciales (gato Cellgro º 25-025-CI).
- Para transferir la secuencia de codificación LifeAct-mCherry en el vector lentiviral pLL7.0, el sitio de reconocimiento en el Sbf1 mCherry padres cDNA se vio alterada por la introducción de tres mutaciones silenciosas en la secuencia de reconocimiento mediante mutagénesis dirigida (gato Stratagene # 200518-5). El resultado modificado LifeAct-mCherry secuencia fue amplificado por PCR luego de que flanquean EcoR1/Sbf1 sitios y se subclonó en pLL7.0 para generar la construcción pLL7.0-LifeAct-mCherry.
2. pLL7.0-LifeAct-mCherry Virus de producción
- La producción viral se llevó a cabo de acuerdo con la expresión lentivirales sistemas manuales (versión del sistema Bioscience 2-051018).
- La línea celular de empaquetamiento 293T/17 células (ATCC # cat CRL-11268) fue aumentado a 40% de confluencia en el mismo medio completa que se utiliza para las líneas de CECC.
- Las células fueron transfectadas con el pLL7.0-LifeAct-mCherry, psPAX2 y pVSV-G vectores en una proporción de 3:2:1, respectivamente, utilizando CalPhos (cat # 631312 Clontech).
- Después de 24 horas, los medios de comunicación inicial de la transfección fue reemplazado por medio fresco.
- Los medios de comunicación fue recogido y se repone cada 12 horas durante 72 horas y se almacenan a 4 ° C.
3. La producción de Cabeza y Cuello líneas celulares con LifeAct estable-mCherry Expresión
- Los medios de comunicación recogidos se escindió en 2000 rpm durante 10 minutos a 4 ° C.
- Un ml de los medios de comunicación aclaró que contiene el virus se añade directamente a OSC19 o UMSCC1 las células durante 12 horas. Las células fueron lavadas, y un adicional de un ml de virus fue introducido por otro período de 12 horas.
- Las células fueron tratadas con los medios de comunicación que contiene 200mg/ml puromicina durante dos semanas para seleccionar las colonias resistentes.
- Clones supervivientes fueron examinados visualmente para LifeAct-mCherry expresión por microscopía de fluorescencia. Individual colonias positivas fueron typsinized utilizando discos estériles clonación 3mm (gato Fisher # 0790710A).
- Células positivas se mantuvieron en los medios de comunicación que contiene puromicina 200mg/ml hasta que se congele de nuevo o usado para la inyección ortotópico.
4. Formación ortotópico xenoinjerto tumoral
- Todos los procedimientos con animales se realizaron de acuerdo con un protocolo (09-0821) aprobado por el Cuidado Animal de la Universidad de Virginia Occidental y el empleo.
- LifeAct-mCherry células tumorales que expresan se tripsinizaron, se centrifuga y 2,5 x 10 4 células se resuspendieron en 50 medios de comunicación completa mL.
- Las células tumorales fueron cargadas en una jeringa que está conectada a una aguja de calibre 27 ½.
- Mujer Fox1 atímicos nu / nu ratones de 8 semanas de edad (Harlan Laboratories), fueron anestesiados con una combinación de ketamina y xilazina 80mg/kg 10mg/kg. Ratones anestesiados se mantuvieron entre 37-40 ° C en una manta eléctrica.
- Usando una pinza estéril, la punta de la lengua se agarró suavemente y con cuidado sacó de la cavidad oral.
- Las células se inyectaron lentamente a un lado de cada lengua para crear una masa bulbosa en el centro de la lengua, evitando las arterias linguales.
- Los ratones fueron inyectados con la yohimbina 2.1mg/kg y regresó a la almohadilla, donde fueron monitoreados durante 2-3 horas durante la recuperación de la anestesia.
- Una vez restablecido, los ratones fueron colocados en jaulas estéril que contiene una dieta blanda masa de transgénicos (gato Bioserve # S3472).
- Los ratones se pesaron cada 2-3 días y control visual de la aparición del tumor.
5. Preparación de las lenguas del ratón para ex-vivo de imágenes
- Los ratones albergar los tumores en diferentes puntos temporales (normalmente 2-4 semanas después de la inyección) fueron sacrificados por inhalación de dióxido de carbono.
- Las lenguas fueron extraídos, lavados con PBS 1X y unido a un lado de un casete de inclusión en parafina convencional de tejidos (Cat. # StatLab H104), con hilo de monofilamento de coser en una tienda local de la manía y un tamaño de 8 aguja de coser.
- Una vez que las lenguas fueron inmovilizados, el conjunto de toda la cinta se coloca en un plato de cultivo de tejidos de 30 mm y se sumergieron en PBS 1X.
- Lenguas procesados fueron utilizados inmediatamente para microscopia de excitación de dos fotones.
6. Imágenes de los tumores de la lengua con dos fotones Microscopía
- Cintas de la lengua se sumergieron en una placa de 60 mm que contiene 1X PBS asegurado en un soporte diseñado en un brazo voladizo retráctil (Sala Shuttle, Siskiyou instrumentos) situado bajo el objetivo de un microscopio vertical (microscopio móvil (MOM); Instrumentos Sutter).
- Una inmersión de agua 40X/0.8NA lente del objetivo se coloca directamente sobre o más allá tum visibleo lesiones. Las lenguas fueron fotografiadas por microscopía de dos fotones con el Ti: zafiro láser (Mira, coherente) la intensidad de 60 mW y la longitud de onda de entrada de 755 nm para optimizar la señal mCherry.
- Serie de imágenes de 1 mm de escaneo láser se recogieron en una profundidad de 1 m incremental sobre una profundidad total del tejido de entre 15 y 100 micras (dependiendo del volumen del tumor). Las imágenes fueron capturadas utilizando scanimage, un programa de código abierto basado en la plataforma de MATLAB que fue desarrollado por el laboratorio de Karel Svoboda (Janelia Farms, HHMI). Scanimage genera una salida de dos canales de la trama patrones de análisis para el control de la x / y galvanómetros de espejo de escaneo, y al mismo tiempo captura un máximo de cuatro canales de entrada de señal de forma simultánea desde los tubos fotomultiplicadores (PMT) a través de una placa de adquisición de datos (PCI-6610S , National Instruments). El PMT señales son amplificadas por los preamplificadores de bajo ruido actuales (SR570, Sistema de Investigación de Stanford) antes de la alimentación en la placa NI-DAQ para su visualización en la pantalla del monitor. Scanimage recoge z-stack imágenes mediante el control del eje z del objetivo y recoge lapso de tiempo las imágenes en un solo modo o en bicicleta. Las imágenes se guardan en un archivo TIFF con una profundidad de 16 bits.
7. Análisis de Imágenes con Amira Software
- Amira imagen para la cuantificación del tumor: En el software Aimra, abra el archivo TIFF que contiene el conjunto de los z-stack imágenes.
- Resalte el nombre del archivo, seleccionar y aplicar la función de Voltex para generar una representación tridimensional. Una imagen de gran tamaño del tumor primario con varios grupos más pequeños y disociados invasiva (IG) de las células invadidas colectiva suele ser evidente en la imagen renderizada (ver Figura 6).
- Para seleccionar la masa del tumor primario, seleccione "Open Data", luego "Etiquetado", entonces "campo de etiquetas".
- Umbral del tumor primario, seleccionar todas las imágenes z-stack y desplazarse por las imágenes en el plano z para asegurar la inclusión de sólo la masa del tumor primario en tres dimensiones. Este suele ser el más grande de imagen de tamaño en el campo y, a menudo aparece desglosado en el fotografiado es atravesado por el plano z.
- Use la varita mágica / umbral de la función de corregir la fluorescencia de fondo y eliminarlo de la imagen sin descartar ninguna de la señal de tumor. Resalta el "archivo dentro de" la etiqueta y haga clic en el botón ⊕. Seleccione la opción "Todos los sectores" casilla de verificación. Esto produce un borde de color alrededor de la zona del tumor primario en un umbral cada incremento de z-stack.
- Para seleccionar IG, elegir la "nueva" función. Seleccione un solo IG y asegurarse de que no se asocia con el tumor primario desplazándose por el plano z.
- Seleccione "Todos los sectores" y haga clic en el botón ⊕. Cambie el nombre del archivo (por ejemplo: IG 1)
- Repita el procedimiento de umbral en el 7,4 y el paso de destacar en el apartado 7.5 de la determinada IG. Seleccione un color de contorno diferente al color que se utiliza para denotar la masa del tumor primario.
- Repita según sea necesario para cada IG adicionales en toda la imagen, al escanear el plano z para asegurar que todos IG se indican. El uso de colores diferentes para cada uno identificado ayudas IG en la identificación de futuros en la imagen.
- Una vez que el tumor primario y las IG son seleccionados, seleccione "segmentación" en el menú desplegable, seleccione "Estadísticas de material". Esto proporciona la medida del volumen, así como el X, Y y X núcleo del tumor coordenadas para el tumor primario con el fin de calcular las distancias de IG desde el punto central del tumor.
- Con los volúmenes calculados, determinar la distancia de cada IG desde el núcleo central del tumor primario. Seleccione "segmentación", luego "Estadísticas de material". Este paso calcula todas las medidas en píxeles. Convertir píxeles micrómetros sobre la base de la calibración de los objetivo de microscopio y cualquier aumento adicional en la ampliación (es decir, funciones de zoom). Para el microscopio y los ajustes utilizados en estos experimentos, el objetivo de 40X se utilizó sin zoom, dando una calibración de 1 píxel = 0,298 micras. Importar datos en una hoja de cálculo Excel, lo que da los parámetros para el tumor primario en tres dimensiones (X1, Y1, Z1) y para cada IG (por ejemplo: X2, Y2, Z2 para el primer IG).
- La distancia invadido en micrones para cada IG desde el centro del tumor primario se calcula utilizando la fórmula √ ((X2-X1) 2 + (Y2-Y1) 2 + (Z2-Z1) 2).
- El índice de invasión tumoral (T I) se calcula mediante la fórmula T = I N T x V T x D T, donde T = N el número total de IG en la imagen, V T = el volumen total de todas las IG, D T = distancia total recorrida de todos los grupos de invasores en el centro del tumor primario.
8. Tres representaciones tridimensionales con Nikon NIS-Elements Software
- Tres representaciones tridimensionales con mayor detalle topográfico puede ser generado por la importación de los originales de 16 bits monocromo archivos TIFF de la imagen de tumor en su totalidad en la Nikon NIS-Elementspaquete (Nikon, Melville, NY). Seleccione "Archivo", luego "ND", luego "Crear archivo ND de secuencia de archivo". Seleccione el TIFF z-series pila de imágenes y especificar el tamaño de paso adecuado.
- Calibrar el documento de ND en el plano xy. Especificar el tamaño de un píxel con una calibración manual.
- Elija la opción "Ver Volumen". Utilice la opción "HQ" función para calcular cortes adicionales en el plano z de una mayor calidad. En la sección "Configuración 3D Renderer", utilice el "Advanced Renderer" con una calidad de "Detalles de Ultra High" y "con la máxima resolución". Seleccione la opción "Alpha Blending" para acentuar la superficie del tumor.
- Optimizar la imagen en tres dimensiones para su presentación. Zoom sobre el tumor y el IG y los cultivos asociados según sea necesario. Rotar la imagen en los planos xyz y ajustar la LUT.
- Capturar la imagen de presentación. Seleccione "Edit-Crear vista instantánea (8 bit RGB)". Nombre y guardar el archivo en consecuencia.
9. Resultados representante
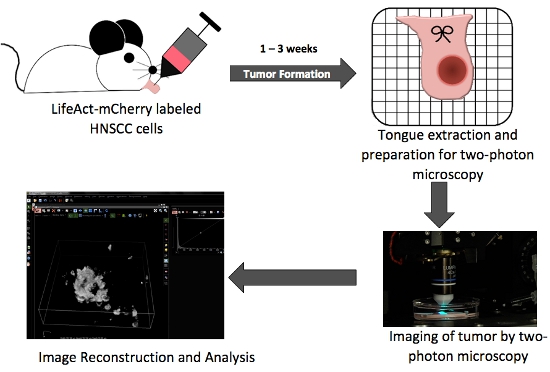
Figura 1. Esquema general que ilustra los pasos clave en la producción ortotópico tumor in situ la lengua y dos imágenes de fotones.
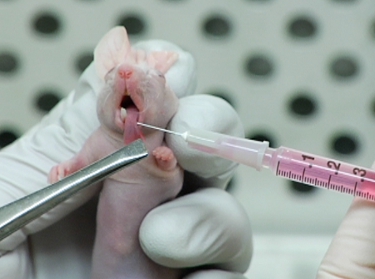
Figura 2. Inyección de LifeAct-mCherry expresar OSC19 células en la lengua el ratón.
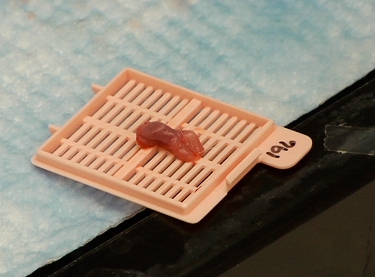
Figura 3 resecado el tumor que contiene la lengua del ratón preparado para dos imágenes de fotones.

Figura 4. Orientación de la lengua de tumor que contiene en su posición en un microscopio de dos fotones listos para la imagen.
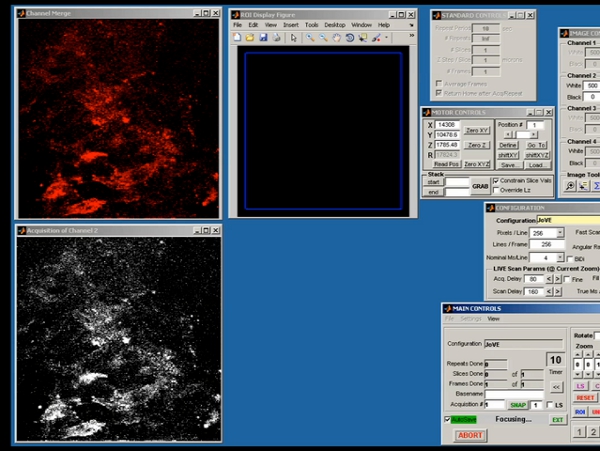
Figura 5. Pantalla Representante disparo de scanimage demostrar la adquisición de datos en bruto de la inicial de dos fotones de la imagen.
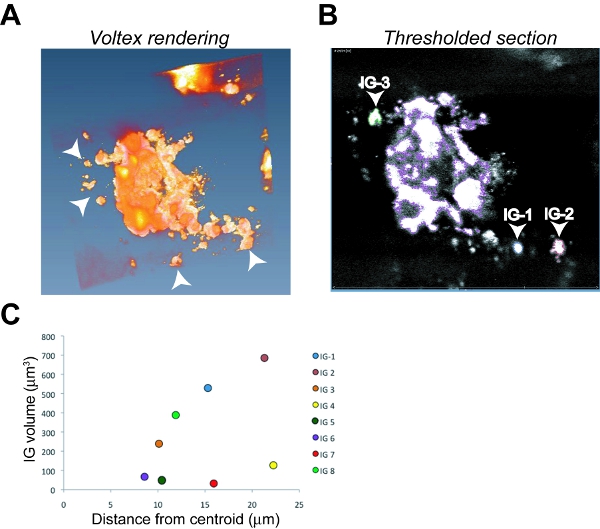
Figura 6. Análisis de imágenes y la cuantificación de la invasión del tumor en un tumor OSC19 ortotópico. Representante imágenes captura de pantalla de Amira prestación Voltex (A) y una sola sección de un umbral z-(B) con el tumor primario primarios descritos en el grupo de color púrpura, que invada 1 (IG-1) con un contorno azul, IG-2 se indica en rojo y el IG -3 con un contorno verde como un ejemplo del procedimiento de identificación. Puntas de flecha indican IG en (A) y (B). Parcelas C. de volumen en comparación con invadido distancia de ocho IG individuales que se utilizan para calcular el índice de invasión del tumor (Ti).
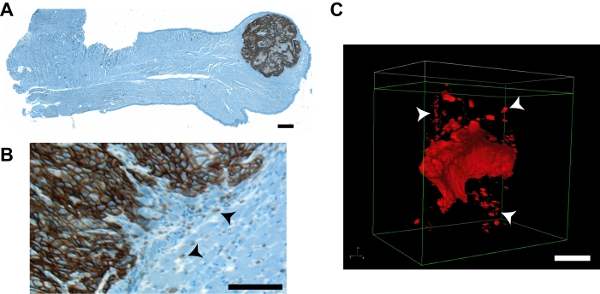
Imágenes de la Figura 7. Representante de los tumores e invadió los grupos de tumores de este protocolo en comparación con las imágenes de un enfoque convencional IHC. Sección A. parafina de una lengua ratón toda albergar un tumor UMSCC1 ortotópico. La tinción inmunohistoquímica se llevó a cabo utilizando procedimientos convencionales con un anticuerpo primario contra el marcador EMMPRIN CECC células específicas (Zymed, cat # 34 a 5600) en la dilución 1:1000 y se visualizan mediante el uso de la OmniMap DAB anti-Rb kit de detección (Ventana cat # 760 -149), seguido de tinción con hematoxilina de hierro. Imágenes que abarcan el área total de la lengua se recogieron de forma individual con un aumento de 4 veces en un microscopio Olympus Provis ZX70 con una cámara CCD Optronics MicroFire y reconstruida con el paquete de imágenes StereoINvestigator (Bioscience MBF). El tumor se hace evidente en la punta de la lengua. Una región ampliada que muestra el frente invasivo y los distintos grupos de células tumorales (puntas de flecha) se muestra en (B). C. Nikon NIS-Elements prestación de un tumor OSC19 representante. Detalle del contorno mejorada y una visualización clara de IG (puntas de flecha) es evidente. Barras en todas las imágenes = 100 micras.
Discusión
Modelos de ratón ortotópico han demostrado ser útiles para el estudio de muchos aspectos de la cabeza y cuello 1,2. Hemos combinado un sistema bien establecido ortotópico de SCOT 3 con imágenes de microscopía de dos fotones de las células mCherry marcado como un sistema para estudiar los primeros eventos de la cabeza y el cuello invasión de células tumorales. En este procedimiento, hemos observado que las células pueden tener fugas en el sitio de la inyección del tumor, especialmente en los ratones de seis semanas o más jóvenes debido al tamaño de la lengua es insuficiente. Nosotros usamos ratones más viejos para evitar este problema. El tamaño de la lengua más grande con los ratones más viejos también ayuda a evitar la ruptura de una arteria lingual y hemorragia excesiva de la lengua. Tomar tumor es mucho mayor cuando la lengua se hincha dramáticamente en el sitio de la inyección inicial. Esto disminuye la inflamación en una o dos horas como el fluido que se inyecta es absorbido. El crecimiento del tumor parece evidente una-dos semanas después de la inyección con el número de células inyectadas se indica como una pequeña protuberancia blanca en la superficie de la lengua. También observamos que en el objetivo de 40X utilizados en nuestros estudios que aquí se presenta, no podemos distinguir las células tumorales individuales, pero se identifican IG como grupos de células invasoras que recapitular el modo típico de invasión CECC.
Hasta la fecha este modelo ha sido ampliamente utilizada para las pruebas de la función de moléculas específicas, así como varios fármacos antitumorales en el crecimiento SCOT una invasión, la eficacia se medía por la metástasis de los ganglios linfáticos del cuello uterino determinan con métodos de IHC o bioluminiscentes 4-7. Tumores formados en este sistema de manifestar cerca de la superficie de la lengua (Figura 7), lo que permite la aplicación de la microscopía de dos fotones a los tumores in situ toda la imagen como invasoras multicelulares grupos. El procedimiento también puede utilizarse para visualizar la invasión del tumor con una resolución de celulares. Microscopía de dos fotones ha sido previamente utilizado para el estudio de tratamientos experimentales para cáncer de cabeza y cuello en ortotópico 8,9 y modelos de xenoinjerto 8,10. Sin embargo, hay dos diferencias importantes entre estos informes y el protocolo. En primer lugar, estos estudios utilizan etiquetas extracelular al objetivo / identificar la cabeza y el cuello las células del tumor, posiblemente limitando la detección sólo a las células tumorales con un amplio acceso a la circulación. La segunda invasión de células tumorales cerca del sitio principal que resume probablemente metastásico de las primeras actividades que no se evaluó como un parámetro experimental. El protocolo ofrece la posibilidad de cuantificar directamente invasión de células tumorales en cualquier momento durante la progresión del tumor en la lengua el ratón. Mientras que el método descrito aquí se describe el procedimiento utilizando la lengua disecada, actualmente estamos en el proceso de adaptación de este método a la invasión de la imagen del tumor en ratones vivos para su uso en combinación con la bioluminiscencia para monitorear simultáneamente la invasión temprana, la participación local de los ganglios linfáticos y metástasis a distancia en el mismo animal. Modificaciones en el protocolo de imágenes in vivo requiere el diseño de una etapa apropiada para la colocación y el mantenimiento de los ratones durante la exploración, así como un sistema práctico para regar adecuadamente la cavidad oral de ratones anestesiados durante la elaboración. Una vez optimizado, estas adaptaciones se ofrecen la posibilidad de estudiar el papel potencial de las moléculas pro-invasivas y las pruebas anti-invasiva compuestos en la invasión local y afectación metastásica más distantes de los animales durante períodos prolongados.
Divulgaciones
Agradecimientos
Con el apoyo de un subproyecto de NIH P20 RR16440 y una subvención del puente de la Oficina de la West Virginia University de Investigación y Estudios de Posgrado de malezas S.. La asistencia técnica de L. López-Skinner durante las primeras fases del desarrollo del proyecto se agradece. Los autores también están agradecidos por la asistencia técnica y OSC19 células de J. Myers y Younes M. (Departamento de Cirugía de Cabeza y Cuello, MD Anderson Cancer Center, Houston, TX), P. Turner y Secrest K. (Universidad de Virginia Occidental del Departamento de Patología Banco de Tejidos) para el procesamiento histológico y procedimientos, R. Wysolmerski (West Virginia University, Departamento de Neurobiología y Anatomía) para la construcción de LifeAct-mCherry y J. Bear (Universidad de Carolina del Norte) para el vector de pLL7.0 lentiviral. El uso del Fondo para la Universidad de West Virginia Imagen de Microscopía (apoyado por el NIH subvención P20 RR16440 y María Babb Randolph Cancer Center) y sus no-lineal laboratorio de microscopía óptica (NLOM, con el apoyo de una colaboración conjunta entre la Universidad de Virginia Occidental del Centro de Neurociencias y la Universidad de Virginia Occidental del Departamento de Física / West Virginia Nanociencia Initiative) es también agradece. El NLOM es apoyado en parte por el NIH subvención P30 RR031155 al Centro para la Neurociencia.
Referencias
- Sano, D., Myers, J. N. Xenograft models of head and neck cancers. Head Neck Oncol. 1, 32-32 (2009).
- Kim, S. Animal models of cancer in the head and neck region. Clin Exp Otorhinolaryngol. 2, 55-60 (2009).
- Myers, J. N., Holsinger, F. C., Jasser, S. A., Bekele, B. N., Fidler, I. J. An orthotopic nude mouse model of oral tongue squamous cell carcinoma. Clin Cancer Res. 8, 293-298 (2002).
- Sano, D., Myers, J. N. Metastasis of squamous cell carcinoma of the oral tongue. Cancer Metastasis Rev. 26, 645-662 (2007).
- Sano, D. The effect of combination anti-endothelial growth factor receptor and anti-vascular endothelial growth factor receptor 2 targeted therapy on lymph node metastasis: a study in an orthotopic nude mouse model of squamous cell carcinoma of the oral tongue. Arch Otolaryngol Head Neck Surg. 135, 411-420 (2009).
- Kupferman, M. E. TrkB induces EMT and has a key role in invasion of head and neck squamous cell carcinoma. Oncogene. 29, 2047-2059 (2010).
- Ammer, A. G. Saracatinib Impairs Head and Neck Squamous Cell Carcinoma Invasion by Disrupting Invadopodia Function. J Cancer Sci Ther. 1, 52-61 (2009).
- Rosenthal, E. L., Kulbersh, B. D., King, T., Chaudhuri, T. R., Zinn, K. R. Use of fluorescent labeled anti-epidermal growth factor receptor antibody to image head and neck squamous cell carcinoma xenografts. Mol Cancer Ther. 6, 1230-1238 (2007).
- Gleysteen, J. P. Fluorescent labeled anti-EGFR antibody for identification of regional and distant metastasis in a preclinical xenograft model. Head Neck. 30, 782-789 (2008).
- Bhirde, A. A. Targeted killing of cancer cells in vivo and in vitro with EGF-directed carbon nanotube-based drug delivery. ACS Nano. 3, 307-316 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados