Method Article
Multi-photon imagerie de l'invasion des cellules tumorales dans un modèle de souris orthotopique du carcinome épidermoïde oral
Dans cet article
Résumé
Un aperçu complet des techniques impliquées dans la génération d'un modèle murin de cancer de la bouche et le suivi quantitatif de l'invasion tumorale au sein de la langue grâce à la microscopie multi-photons de cellules marquées est présenté. Ce système peut servir de plate-forme utile pour l'évaluation de l'efficacité des médicaments moléculaires et des composés anti-invasive.
Résumé
Loco-régionale invasion de la tête et du cou est liée à un risque métastatique et présente un défi difficile à relever dans la conception et la mise en œuvre des stratégies de gestion des patients. Des modèles de souris orthotopique de cancer par voie orale ont été développés pour faciliter l'étude des facteurs que l'invasion de l'impact et de servir comme système modèle pour évaluer la thérapeutique anti-tumorale. Dans ces systèmes, la visualisation des cellules tumorales disséminées dans les tissus cavité buccale a généralement été menée soit par histologie conventionnelle ou avec des méthodes bioluminescentes vivo. Un inconvénient majeur de ces techniques est l'incapacité inhérente à visualiser et de quantifier précisément au début d'invasion des cellules tumorales provenant du site primaire en trois dimensions. Nous décrivons ici un protocole qui associe un modèle établi pour carcinome épidermoïde de la langue (SCOT) avec l'imagerie à deux photons pour permettre multi-vectorielle de visualisation de la propagation des tumeurs linguales. La CVMO-19 la tête et du cou lignée cellulaire tumorale a été stable pour exprimer l'LifeAct F-actine de liaison peptidique fusionnée à la protéine fluorescente mCherry (LifeAct-mCherry). Fox1 souris nu / nu injecté ces cellules de manière fiable former des tumeurs qui permettent la langue pour être visualisé par l'ex-vivo application de microscopie à deux photons. Cette technique permet la visualisation orthotopique de la masse tumorale et localement envahir les cellules en langues excisée sans perturbation du microenvironnement tumoral régional. En outre, ce système permet la quantification de l'invasion des cellules tumorales par le calcul de distances qui ont envahi déplacer des cellules à partir du site primaire tumeur. Globalement, cette procédure prévoit un système modèle amélioré d'analyse des facteurs qui contribuent à l'invasion SCOT et des traitements thérapeutiques adaptés pour prévenir l'invasion locale et distante dissémination métastatique. Cette méthode a également le potentiel pour être couplée éventuellement à d'autres modalités d'imagerie dans un dans la mise en vivo.
Protocole
1. Lignées cellulaires, Vector Construction et Production lentiviraux
- La tête et le cou de l'homme les cellules tumorales lignes (ou OSC19 UMSCC1) ont été cultivées en milieu complet constitué de DMEM (chat Cellgro # 50-003-PB) complété avec 10% de FBS sérum bovin foetal (Hyclone chat # SH30070.03), 1% de pénicilline / streptomycine (chat Cellgro N ° 30-002-CI), et 1% de non-acides aminés essentiels (chat Cellgro n ° 25-025-CI).
- Pour transférer la séquence de codage LifeAct-mCherry dans le vecteur lentiviral pLL7.0, le site de reconnaissance dans le Sbf1 mCherry parent d'ADNc a été modifié en introduisant trois mutations silencieuses dans la séquence de reconnaissance en utilisant la mutagenèse dirigée (chat Stratagene # 200518-5). Le résultant modifiés LifeAct-mCherry séquence a ensuite été amplifié par PCR flanquant EcoR1/Sbf1 sites et sous-cloné dans pLL7.0 de générer la construction pLL7.0-LifeAct-mCherry.
2. La production de virus pLL7.0-LifeAct-mCherry
- Production virale a été réalisée selon l'expression lentiviraux systèmes manuels (version du système Bioscience 2-051018).
- La lignée cellulaire d'emballage 293T/17 cellules (chat ATCC # CRL-11268) a été cultivées jusqu'à confluence de 40% dans le même support complet utilisé pour les lignes CETC.
- Les cellules ont été transfectées avec le pLL7.0-LifeAct-mCherry, psPAX2 et pVSV-G des vecteurs dans un rapport 3:2:1, respectivement en utilisant Calphos (cat # 631312 Clontech).
- Après 24 heures, les médias initial de la transfection a été remplacé par du milieu frais.
- Médias a ensuite été recueilli et reconstitué tous les 12 heures pendant 72 heures et conservés à 4 ° C.
3. Production de la tête et du cou avec des lignées cellulaires stables LifeAct-mCherry Expression
- Les médias collectées a été centrifugé à 2000 rpm pendant 10 minutes à 4 ° C.
- Un ml de milieu contenant le virus a été clarifiée directement ajouté au OSC19 ou UMSCC1 cellules pendant 12 heures. Les cellules ont ensuite été rincés, et ajoutant un ml de virus a été ajouté pour une autre période de 12 heures.
- Les cellules ont été traitées avec un milieu contenant 200mg/ml puromycine pendant deux semaines pour sélectionner les colonies résistantes.
- Clones survivants ont été examinés visuellement pour LifeAct-mCherry expression par microscopie à fluorescence. Individuels colonies positives ont été typsinized utilisant le clonage de disques stériles 3mm (chat Fisher # 0790710A).
- Cellules positives ont été maintenues dans les milieux contenant la puromycine 200mg/ml jusqu'au congelés dos ou utilisés pour l'injection orthotopique.
4. Orthotopique formation de xénogreffes de tumeurs
- Toutes les procédures d'animaux ont été menées conformément à un protocole (09-0821) approuvé par les soins de West Virginia University et animale Comité utilisation.
- LifeAct-mCherry cellules tumorales exprimant ont été trypsinées, centrifugé et 2,5 x 10 4 cellules ont été remises en suspension dans 50 pl média complet.
- Les cellules tumorales ont été chargés dans une seringue d'un ml attaché à une aiguille de calibre 27 ½.
- Femme athymiques fox1 souris nu / nu 8 semaines d'âge (Harlan Laboratories) ont été anesthésiés avec combinaison de kétamine et de xylazine 80mg/kg 10mg/kg. Souris anesthésiées ont été maintenus entre 37-40 ° C sur un coussin chauffant.
- En utilisant une pince stérile, le bout de la langue a été doucement et soigneusement compris sorti de la cavité buccale.
- Les cellules ont été injecté lentement dans un côté de chaque langue pour créer une masse bulbeuse dans le centre de langue, en évitant les artères linguales.
- Les souris ont été injectées à la yohimbine 2.1mg/kg et retourné au coussin chauffant, où ils ont été suivis pendant 2-3 heures pendant la récupération de l'anesthésie.
- Une fois relancé, les souris ont été placées dans des cages stériles contenant une alimentation transgénique pâte molle (chat Bioserve # S3472).
- Les souris ont été pesés tous les 2-3 jours et surveillés visuellement pour l'apparition de tumeurs.
5. Préparation de la souris pour Tongues Ex-imagerie in vivo
- Souris hébergeant des tumeurs à différents moments (habituellement 2-4 semaines après l'injection) ont été euthanasiés par inhalation de dioxyde de carbone.
- Tongues ont été extraits, rincés avec du PBS 1X et attaché à un côté d'une cassette inclusion dans la paraffine des tissus classiques (Cat # StatLab H104), en utilisant les fils à coudre à partir d'un monofilament de magasin de modélisme local et une aiguille à coudre de taille 8.
- Une fois que les langues ont été immobilisés, l'assemblée entière était placée cassettes dans une boîte de culture tissulaire de 30 mm et plongés dans du PBS 1X.
- Langues ont été immédiatement transformés utilisés pour la microscopie à deux photons d'excitation.
6. Imagerie des tumeurs Langue avec microscopie à deux photons
- Langue cassettes ont été submergés dans un plat contenant du PBS 1X 60mm fixée dans un support sur mesure conçus sur un bras cantilever rétractable (Chambre navette, Siskiyou instruments) placé sous l'objectif d'un microscope droit (Microscope mobiles (MOM); Instruments Sutter).
- Une eau 40X/0.8NA lentille d'objectif trempage a été placé directement sur ou au-dessus de Tum visiblesou des lésions. Tongues ont été imagées par microscopie à deux photons avec le Ti: saphir laser (Mira, cohérent) d'intensité à 60 mW et longueur d'onde de 755 nm d'entrée pour optimiser le signal mCherry.
- Serial images 1mm balayage laser ont été recueillies à une profondeur um incrémentale sur une profondeur totale de tissu entre 15 et 100 um (selon le volume de la tumeur). Les images ont été capturées à l'aide scanimage, un programme open source basé sur la plateforme de MATLAB qui a été développé par le laboratoire Karel Svoboda (Janelia Farms, HHMI). Scanimage génère une sortie à deux canaux de modèles balayage de trame pour contrôler le X / Y galvanométrique des miroirs de balayage, et en même temps, capte un signal d'entrée maximale de quatre canaux simultanément à partir de tubes photomultiplicateurs (PMT) à travers un conseil d'administration d'acquisition de données (PCI-6610S , National Instruments). Le PMT signaux sont amplifiés par des préamplificateurs à faible bruit courant (SR570, Stanford Research System) avant d'alimenter la carte NI-DAQ pour l'affichage sur l'écran du moniteur. Scanimage recueille z-stack images en contrôlant l'axe z de l'objectif et recueille time-lapse images dans un mode unique ou à vélo. Les images ont été enregistrées dans un seul fichier TIFF avec une profondeur de 16 bits.
7. Analyse d'images à l'aide du logiciel Amira
- Amira imagerie pour la quantification des tumeurs: Dans le logiciel Aimra, ouvrez le fichier TIFF contenant l'ensemble des z-stack images.
- Sélectionnez le nom du fichier, sélectionner et appliquer la fonction Voltex pour générer un rendu en trois dimensions. Une grande image principale tumeur avec plusieurs petits groupes dissociés invasives (IG) des cellules envahies collectivement est généralement apparente dans l'image rendue (voir figure 6A).
- Pour sélectionner la masse tumorale primaire, sélectionnez «Open Data», puis «Etiquetage», puis «Champ Label".
- Seuillage des primaires de tumeurs sélectionner toutes les images Z-stack et faire défiler les images dans le plan z pour assurer l'inclusion de seulement la masse tumorale primaire dans les trois dimensions. Cela est généralement le plus grand image de taille dans le domaine et apparaît souvent comme la segmentation imagé est traversée par le plan z.
- Utilisez la baguette magique / seuil fonction pour corriger la fluorescence de fond et l'éliminer de l'image sans jeter tout du signal tumeur. Mettez en surbrillance le "fichier à l'intérieur" étiquette et cliquez sur le bouton ⊕. Cochez la case "Toutes les tranches« chèque. Cela produit une bordure de couleur autour de la zone de la tumeur primaire seuillée chaque incrément z-stack.
- Pour sélectionner les GI, choisissez "Nouveau" fonction. Sélectionnez une seule IG et s'assurer qu'il n'est pas associé à la tumeur primaire en faisant défiler le plan z.
- Sélectionnez "Toutes les tranches" et cliquez sur le bouton ⊕. Renommez le fichier (ex: IG 1)
- Répétez la procédure de seuillage en 7.4 et l'étape en soulignant en 7.5 pour l'IG déterminée. Sélectionnez une couleur de contour différent de la couleur utilisée pour désigner la masse tumorale primaire.
- Répéter au besoin pour chaque tranche supplémentaire IG à travers l'image, la numérisation à travers le plan z pour s'assurer que tous les GI sont notées. En utilisant des couleurs différentes pour chacune identifiée aides IG dans l'identification des futures sur l'image.
- Une fois la tumeur primaire et tous les GIs sont sélectionnées, choisissez «segmentation» dans le menu déroulant, puis sélectionnez "Statistiques des matériaux". Cela donne la mesure du volume ainsi que les X, Y et le noyau tumoral coordonnées X de la tumeur primaire afin de calculer les distances des GIs à partir du point central de la tumeur.
- Avec les volumes calculés, déterminer la distance pour chaque IG à partir du noyau central de la tumeur primaire. Sélectionnez "segmentation", puis "Statistiques matériel». Cette étape calcule toutes les mesures en pixels. Convertir pixels en micromètres basée sur l'étalonnage de l'objectif du microscope et de toute augmentation supplémentaire de grossissement (ie, les fonctions de zoom). Pour le microscope et les paramètres utilisés dans ces expériences, l'objectif 40X a été utilisé sans zoom, donnant un étalonnage de 1 pixel = 0,298 um. Importer des données dans un tableur Excel, ce qui donne des paramètres pour la tumeur primaire en trois dimensions (X1, Y1, Z1) et pour chaque IG (ex: X2, Y2, Z2 pour la première IG).
- La distance a envahi en microns pour chaque IG du centre de la tumeur primaire est calculé selon la formule √ ((X2-X1) 2 + (Y2-Y1) 2 + (Z2-Z1) 2).
- L'indice des tumeurs invasives (T I) est calculé selon la formule T = I N T x V T x D T, où T = N le nombre total de GI dans l'image, V T = le volume total de tous les GI, D T = distance totale parcourue de tous les groupes invasif du centre de la tumeur primaire.
8. Trois dimensions des rendus avec Nikon NIS-Elements Software
- Trois dimensions avec des rendus plus détails topographiques peuvent être générés par l'importation de l'original 16-bit monochrome fichiers TIFF de l'image dans la tumeur entière Nikon NIS-Elementspaquet (Nikon, Melville, NY). Choisissez "Fichier", puis "ND", puis "Créer un fichier ND de la séquence de fichier". Sélectionnez la pile image TIFF série Z et spécifier la taille étape appropriée.
- Calibrer le document ND dans le plan xy. Indiquez la taille d'un pixel à l'aide d'un calibrage manuel.
- Choisissez l'option "Afficher Volume". Utilisez le "QG" de fonction pour calculer les tranches supplémentaires dans le plan z pour une qualité supérieure. Dans les "Paramètres de rendu 3D", utilisez le bouton "Avancé Renderer" avec une qualité de "Ultra high details" et "pleine résolution". Choisissez "Alpha Blending" pour accentuer les surfaces tumeur.
- Optimiser l'image en trois dimensions pour la présentation. Zoom sur la tumeur et l'IGS et des cultures associées en tant que de besoin. Faites pivoter l'image dans les plans xyz et ajuster la LUT.
- Capturer l'image pour la présentation. Sélectionnez "Edition-Créer Snapshot View (8 bits RVB)". Nommez et enregistrez le fichier en conséquence.
9. Les résultats représentatifs
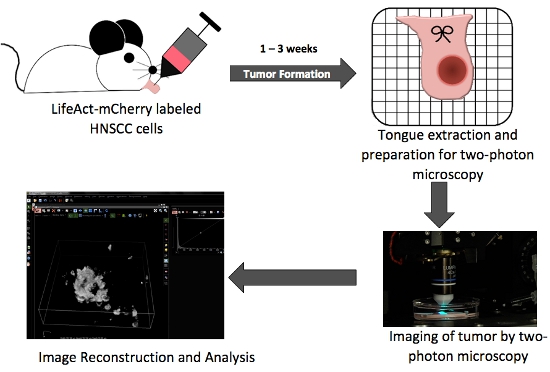
Figure 1. Schématique globale illustrant des étapes clé dans la production de tumeurs langue orthotopique et in situ deux imagerie photonique.
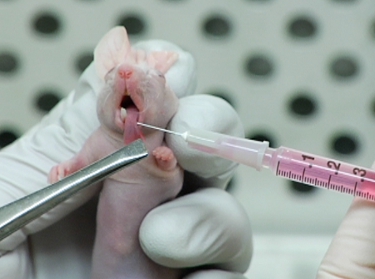
Figure 2. Injection de LifeAct-mCherry exprimer OSC19 cellules dans la langue de la souris.
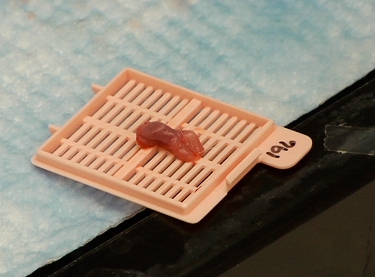
Figure 3 Langue résection tumorale de souris contenant préparés pour deux d'imagerie photonique.

Figure 4. Orientation d'une languette de tumeurs contenant en position sur un microscope à deux photons prêt pour l'imagerie.
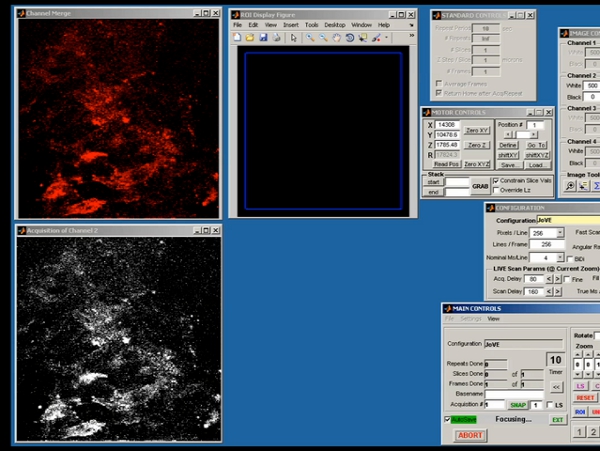
Figure 5. Écran représentant tir de scanimage démontrant l'acquisition des données brutes de l'initiale de deux photons de l'image.
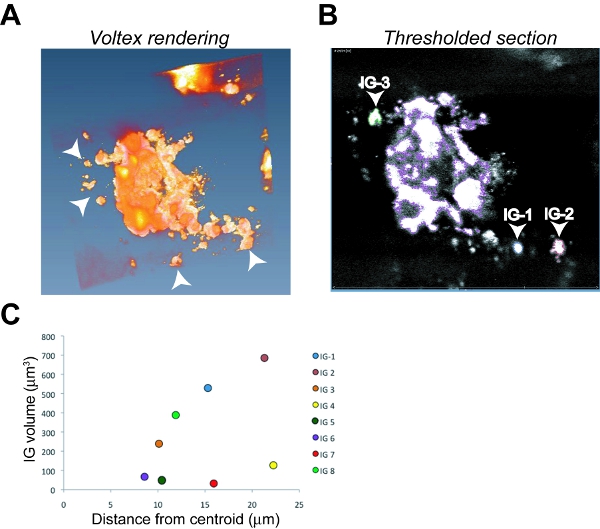
Figure 6. L'analyse d'image et de quantification de l'invasion tumorale dans une tumeur OSC19 orthotopique. Représentant des images capture d'écran de Amira Voltex rendu (A) et un seul seuillée z-section (B) avec la tumeur primaire primaires décrits dans le pourpre, le groupe invasif 1 (IG-1) en bleu, IG-2 décrites dans le rouge et l'IG -3 contour vert comme un exemple de la procédure d'identification. Pointes de flèches dénotent LDI en (A) et (B). Parcelles C du volume par rapport a envahi la distance de huit GI individuels utilisés pour calculer l'indice de l'invasion tumorale (Ti).
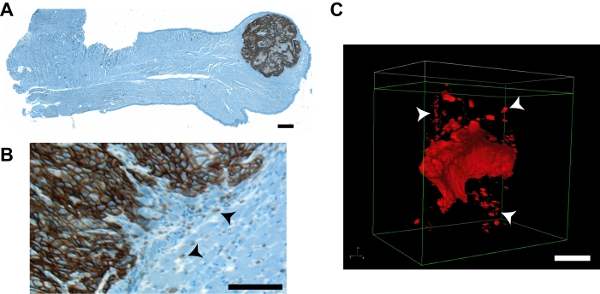
Images représentant la figure 7. Des tumeurs et des groupes de tumeurs ont envahi à partir de ce protocole par rapport aux images d'une approche conventionnelle IHC. Paraffine section A. d'une languette de souris toute hébergeant une tumeur UMSCC1 orthotopique. La coloration immunohistochimique a été réalisée en utilisant des procédures classiques avec un anticorps primaire contre les CETC marqueur spécifique des cellules EMMPRIN (Zymed; cat # 34-5600) à 1:1000 dilution et visualisé en utilisant le DAB OmniMap anti-Rb kit de détection (Ventana cat # 760 -149), suivi par le fer hématoxyline coloration. Images de la zone englobant la langue total ont été recueillis individuellement à un grossissement de 4x sur un microscope Olympus ZX70 Provis avec une caméra CCD Optronics MicroFire et reconstruite en utilisant le paquet d'imagerie StereoINvestigator (Bioscience MBF). La tumeur est évident à la pointe de la langue. Une région agrandie montrant l'avant invasive et individuels des groupes de cellules tumorales (flèches) est montré dans (B). C. Nikon NIS-Elements de rendu d'une tumeur OSC19 représentant. Détails contours améliorée et la visualisation claire des IGS (flèches) est évidente. Bars à toutes les images = 100 um.
Discussion
Des modèles de souris orthotopique sont révélés utiles pour étudier de nombreux aspects de la tête et du cou 1,2. Nous avons combiné un système bien établi orthotopique du SCOT 3 avec imagerie par microscopie à deux photons de cellules mCherry-étiqueté comme un système pour étudier les événements précoces de la tête et l'invasion des cellules tumorales du cou. Dans cette procédure, nous avons noté que les cellules peuvent s'échapper du site de l'injection de tumeurs, en particulier dans des souris de six semaines ou plus jeune en raison de la taille insuffisante la langue. Nous utilisons des souris plus âgées afin d'éviter ce problème. La grande taille de la langue avec les souris plus âgées contribue également à éviter la rupture d'une artère linguale et l'hémorragie excessive de la langue. Prendre la tumeur est grandement améliorée quand la langue enfle considérablement sur le site de l'injection initiale. Ce gonflement disparaît dans les une à deux heures que le fluide injecté est absorbé. La croissance tumorale semble évident de une à deux semaines après l'injection avec le nombre de cellules injectées indiqué comme une petite bosse blanche sur la surface de la langue. Nous notons également que l'objectif 40X utilisés dans nos études présentées ici, nous ne pouvons pas distinguer les cellules tumorales individuelles mais ne identifier les GIs que des amas de cellules envahissantes qui récapitulent le mode typique de l'invasion CETC.
À ce jour, ce modèle a été largement utilisée pour tester le rôle de molécules spécifiques, ainsi que plusieurs médicaments anti-tumoraux sur la croissance SCOT une invasion, avec une efficacité mesurée par métastases ganglionnaires cervicales surveillée en utilisant des méthodes IHC ou bioluminescentes 4-7. Tumeurs formées dans ce système de se manifester à proximité de la surface de la langue (Figure 7), permettant l'application de la microscopie à deux photons pour les tumeurs in situ image entière comme envahissantes multi-cellulaires grappes. La procédure peut également être utilisé pour visualiser l'invasion tumorale avec une résolution cellulaire. Microscopie à deux photons a déjà été utilisé pour étudier les traitements expérimentaux pour cancer tête et cou dans 8,9 orthotopique et xénogreffe 8,10 modèles. Cependant, il ya deux différences majeures entre ces rapports et notre protocole. Premièrement, ces études utilisent des étiquettes extracellulaire de cibler / identifier la tête et du cou cellules tumorales, éventuellement en limitant uniquement à la détection des cellules tumorales avec un large accès à la circulation. Deuxièmement, l'invasion des cellules tumorales à proximité du site principal qui récapitule l'activité susceptible début métastatique n'a pas été évalué comme un paramètre expérimental. Notre protocole permet de quantifier directement l'invasion des cellules tumorales à tout moment pendant la progression tumorale dans les langues de la souris. Alors que la méthode décrite ici décrit la procédure à l'aide langues disséqués, nous sommes actuellement en train d'adapter cette méthode à l'invasion tumorale chez la souris l'image en direct pour une utilisation en combinaison avec la bioluminescence de surveiller simultanément l'invasion précoce locale des ganglions lymphatiques et métastases à distance dans le même animal. Modifications du protocole pour l'imagerie in vivo nécessitent la conception d'un stade approprié pour le positionnement et le maintien des souris lors de l'imagerie, ainsi que d'un système pratique pour bien irriguer la cavité buccale des souris anesthésiées pendant la procédure d'imagerie. Une fois optimisé, ces adaptations offrira la possibilité d'étudier le rôle du potentiel pro-invasif molécules et les tests anti-invasive composés sur l'invasion locale et plus éloignés des métastases chez des animaux sur de longues périodes.
Déclarations de divulgation
Remerciements
Soutenu par un sous-projet du NIH P20 RR16440 et une subvention du pont de l'Office West Virginia University de la recherche et aux études supérieures aux mauvaises herbes S.. L'assistance technique de L. Lopez-Skinner pendant les premières phases de développement du projet est grandement appréciée. Les auteurs sont également reconnaissants pour l'assistance technique et OSC19 cellules de J. Myers et M. Younes (département de chirurgie de la tête et du cou, du MD Anderson Cancer Center, Houston, TX); P. Turner et K. Secrest (West Virginia University Département de Banque de tissus de pathologie) pour le traitement histologique et des procédures, R. Wysolmerski (West Virginia University, département de neurobiologie et d'anatomie) pour la construction LifeAct-mCherry et J. Bear (Université de Caroline du Nord) pour le vecteur lentiviral pLL7.0. L'utilisation de la facilité de la West Virginia University Imaging Microscopy (soutenu par NIH et le P20 RR16440 Mary Babb Randolph Cancer Center) et ses non-linéaire laboratoire de microscopie optique (NLOM; soutenu par une collaboration entre le Centre West Virginia University for Neuroscience et l'Université West Virginia Department of Physics / West Virginia Nanoscience Initiative) est également appréciée. Le NLOM est soutenu en partie par NIH P30 RR031155 le Center for Neuroscience.
Références
- Sano, D., Myers, J. N. Xenograft models of head and neck cancers. Head Neck Oncol. 1, 32-32 (2009).
- Kim, S. Animal models of cancer in the head and neck region. Clin Exp Otorhinolaryngol. 2, 55-60 (2009).
- Myers, J. N., Holsinger, F. C., Jasser, S. A., Bekele, B. N., Fidler, I. J. An orthotopic nude mouse model of oral tongue squamous cell carcinoma. Clin Cancer Res. 8, 293-298 (2002).
- Sano, D., Myers, J. N. Metastasis of squamous cell carcinoma of the oral tongue. Cancer Metastasis Rev. 26, 645-662 (2007).
- Sano, D. The effect of combination anti-endothelial growth factor receptor and anti-vascular endothelial growth factor receptor 2 targeted therapy on lymph node metastasis: a study in an orthotopic nude mouse model of squamous cell carcinoma of the oral tongue. Arch Otolaryngol Head Neck Surg. 135, 411-420 (2009).
- Kupferman, M. E. TrkB induces EMT and has a key role in invasion of head and neck squamous cell carcinoma. Oncogene. 29, 2047-2059 (2010).
- Ammer, A. G. Saracatinib Impairs Head and Neck Squamous Cell Carcinoma Invasion by Disrupting Invadopodia Function. J Cancer Sci Ther. 1, 52-61 (2009).
- Rosenthal, E. L., Kulbersh, B. D., King, T., Chaudhuri, T. R., Zinn, K. R. Use of fluorescent labeled anti-epidermal growth factor receptor antibody to image head and neck squamous cell carcinoma xenografts. Mol Cancer Ther. 6, 1230-1238 (2007).
- Gleysteen, J. P. Fluorescent labeled anti-EGFR antibody for identification of regional and distant metastasis in a preclinical xenograft model. Head Neck. 30, 782-789 (2008).
- Bhirde, A. A. Targeted killing of cancer cells in vivo and in vitro with EGF-directed carbon nanotube-based drug delivery. ACS Nano. 3, 307-316 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon