Method Article
Multi-Photonen-Imaging der Tumorzellinvasion in einem orthotopen Mausmodell des oralen Plattenepithelkarzinoms
In diesem Artikel
Zusammenfassung
Einen umfassenden Überblick über die Techniken bei der Erzeugung von einem Maus-Modell von Mundkrebs und quantitative Überwachung der Tumorinvasion in die Zunge durch Multi-Photonen-Mikroskopie markierter Zellen beteiligt wird vorgestellt. Dieses System kann als eine nützliche Plattform für die molekulare Beurteilung und Wirksamkeit von Medikamenten von anti-invasive Verbindungen dienen.
Zusammenfassung
Loco-regionale Invasion von Kopf-Hals-Krebs ist es, metastasiertem Risiko verbunden und stellt eine schwierige Herausforderung in der Gestaltung und Umsetzung Patienten-Management-Strategien. Orthotopen Mausmodell von Mundkrebs wurden entwickelt, um die Untersuchung der Faktoren, die Erleichterung der Auswirkungen Invasion und dienen als Modellsystem für die Beurteilung Anti-Tumor-Therapeutika. In diesen Systemen wurde die Visualisierung von disseminierten Tumorzellen im Mundraum Gewebe in der Regel entweder durch konventionelle Histologie oder mit in vivo Biolumineszenz Methoden durchgeführt worden. Ein Hauptnachteil dieser Techniken ist die inhärente Unfähigkeit, genau zu visualisieren und zu quantifizieren frühen Tumorzellinvasion aus dem primären Standort in drei Dimensionen. Hier beschreiben wir ein Protokoll, das ein etabliertes Modell für Plattenepithelkarzinom der Zunge (SCOT) mit Zwei-Photonen-Imaging zu Multi-Vektor-Visualisierung von mehrsprachigen Tumorausbreitung ermöglichen verbindet. Die OSC-19 Kopf-Hals-Tumor-Zelllinie wurde stabil entwickelt, um die F-Aktin-bindende Peptid LifeAct fusioniert mit dem mCherry fluoreszierende Protein (LifeAct-mCherry) auszudrücken. Fox1 nu / nu-Mäuse mit diesen Zellen injiziert zuverlässig Tumoren bilden, dass die Zunge sichtbar gemacht werden durch ex-vivo Anwendung der Zwei-Photonen-Mikroskopie ermöglichen. Diese Technik ermöglicht die Visualisierung orthotopen der Tumormasse und lokal eindringenden Zellen in ausgeschnittenen Zungen ohne Unterbrechung der regionalen Tumor-Mikroumgebung. Darüber hinaus ermöglicht dieses System für die Quantifizierung von Tumorzellinvasion durch Berechnung Entfernungen, die Zellen bewegen sich vom Primärtumor Ort eingedrungen. Insgesamt ist dieses Verfahren bietet eine erweiterte Modellsystem zur Analyse der Faktoren, die zu SCOT Invasion und therapeutische Behandlungen zugeschnitten auf lokaler Invasion und fernen Metastasierung zu verhindern beitragen. Auch diese Methode hat das Potenzial, um letztendlich mit anderen bildgebenden Verfahren in einem In-vivo-Einstellung kombiniert werden.
Protokoll
1. Zell-Linien, Vector Bau und Lentivirale Produktion
- Menschlicher Kopf und Hals Tumorzellinien (OSC19 oder UMSCC1) wurden in komplettem Medium, bestehend aus DMEM (CellGro cat # 50-003-PB) ergänzt mit 10% fötalem Rinderserum FBS (Hyclone cat # SH30070.03), 1% Penicillin / Streptomycin (CellGro cat # 30-002-CI) und 1% nicht-essentiellen Aminosäuren (CellGro cat # 25-025-CI).
- Zur Übertragung der LifeAct-mCherry kodierende Sequenz in den pLL7.0 lentiviralen Vektors wurde das Sbf1 Erkennungsstelle in der übergeordneten mCherry cDNA durch die Einführung von drei stille Mutationen in der Erkennungssequenz mit Mutagenese (Stratagene cat # 200518-5) verändert. Die daraus resultierenden veränderten LifeAct-mCherry Sequenz wurde anschließend PCR mit flankierenden EcoR1/Sbf1 Seiten verstärkt und subkloniert in pLL7.0 die pLL7.0-LifeAct-mCherry Konstrukt zu erzeugen.
2. pLL7.0-LifeAct-mCherry Virus Produktion
- Viral Produktion wurde nach dem Lentivirale Expression Systeme manuelle (System Bioscience Version 2-051018) durchgeführt.
- Die Verpackungs-Zelllinie 293T/17 Zellen (ATCC cat # CRL-11268) wurde auf 40% Konfluenz in der gleichen komplette Medien für HNSCC Linien verwendet gewachsen.
- Die Zellen wurden mit dem pLL7.0-LifeAct-mCherry, psPAX2 und pVSV-G-Vektoren in einem Verhältnis transfizierten 03.02.01, jeweils unter Verwendung CalPhos (Clontech cat # 631312).
- Nach 24 Stunden war die erste Medien aus der Transfektion mit frischem Medium ersetzt.
- Medien wurde dann gesammelt und alle 12 Stunden erneuert für 72 Stunden und bei 4 ° C.
3. Produktion von Kopf-Hals-Zelllinie mit stabilen LifeAct-mCherry Expression
- Die gesammelten Medien wurden bei 2000 rpm für 10 Minuten bei 4 ° C abzentrifugiert
- Ein ml geklärt Medien mit Virus wurde direkt an OSC19 oder UMSCC1 Zellen für 12 Stunden aufgenommen. Die Zellen wurden dann gewaschen, und um einen zusätzlichen ml Virus wurde für weitere 12 Stunden aufgenommen.
- Die Zellen wurden mit Medium mit 200mg/ml Puromycin für zwei Wochen nach resistenten Kolonien wählen behandelt.
- Surviving Klone wurden visuell auf LifeAct-mCherry Ausdruck durch Fluoreszenz-Mikroskopie untersucht. Individuelle positive Kolonien wurden typsinized mit sterilen 3mm Klonen Discs (Fisher cat # 0790710A).
- Positive Zellen wurden in Medium mit 200mg/ml Puromycin bis zurück oder gefroren verwendet für orthotoper Injektion erhalten.
4. Orthotopen Tumor Xenograft Formation
- Alle tierischen Verfahren wurden in Übereinstimmung mit einem Protokoll (09-0821) von der West Virginia University Animal Care und Verwenden Ausschusses zugelassen wurden.
- LifeAct-mCherry exprimierenden Tumorzellen wurden trypsiniert, zentrifugiert und 2,5 x 10 4 Zellen wurden in 50 ul komplette Medien resuspendiert.
- Tumorzellen wurden in einem ml Spritze an einem 27 ½-Gauge-Nadel geladen.
- Weibliche athymischen Fox1 nu / nu Mäusen Alter von 8 Wochen (Harlan Laboratories) wurden betäubt mit einer Kombination von 80mg/kg Ketamin und Xylazin 10mg/kg. Narkotisierten Mäusen wurden zwischen 37-40 ° C auf einem Heizkissen aufrechterhalten.
- Mit einer sterilen Pinzette wurde die Spitze der Zunge sanft gegriffen und vorsichtig aus der Mundhöhle gezogen.
- Die Zellen wurden langsam in eine Seite jeder Zunge injiziert, um eine bauchige Masse in die Zunge Zentrum zu schaffen, die Vermeidung der lingualen Arterien.
- Die Mäuse wurden mit 2.1mg/kg Yohimbin injiziert und kehrte in die Heizkissen, wo sie für 2-3 Stunden, während aus der Narkose überwacht wurden.
- Einmal wiederbelebt wurden die Mäuse in sterile Käfige mit einem weichen Teig transgenen Ernährung (BioServe cat # S3472) platziert.
- Die Mäuse wurden gewogen alle 2-3 Tage und optisch für die Tumor-Entstehung überwacht.
5. Vorbereitung der Maus Tongues für Ex-vivo Imaging
- Mäuse beherbergen Tumoren zu verschiedenen Zeitpunkten (in der Regel 2-4 Wochen nach der Injektion) wurden von Kohlendioxid Einatmen eingeschläfert.
- Tongues extrahiert wurden, gespült mit 1X PBS und an einer Seite eines konventionellen Paraffin Gewebe eingebettet Kassette (StatLab Cat # H104,) mit Monofilament Nähfaden aus einer lokalen Hobby-Shop und eine Größe 8 Nähnadel.
- Sobald die Zungen immobilisiert wurden, wurde die gesamte Kassette Montage in einem 30 mm Gewebe-Kulturschale platziert und eingebettet in 1X PBS.
- Verarbeitete Zungen wurden sofort für zwei-Photonen-Anregung Mikroskopie.
6. Imaging of Tongue Tumoren mit Zwei-Photonen-Mikroskopie
- Tongue Kassetten wurden in einer 60mm Schale mit 1X PBS in einer speziell entworfenen Halterung auf einem ausfahrbaren Ausleger (Chamber Shuttle, Siskiyou Instrumente) unter dem Ziel einer aufrechten Mikroskop (; Sutter Instruments Moveable Microscope (MOM)) positioniert gesichert getaucht.
- Ein 40X/0.8NA Wasser getaucht Objektiv wurde direkt auf oder über sichtbar tum gelegtoder Läsionen. Saphir-Laser (Mira, Coherent) Intensität bei 60 mW und Input Wellenlänge von 755 nm auf die mCherry Signal zu optimieren: Tongues wurden durch Zwei-Photonen-Mikroskopie mit dem Ti abgebildet.
- Serielle 1mm Laser-Scanning-Bilder wurden bei 1 um inkrementelle Tiefen über insgesamt Gewebe Tiefe zwischen 15 und 100 um (je nach Tumor-Volumen) gesammelt. Die Bilder wurden aufgenommen mit scanimage, ein Open-Source-Programm auf der MATLAB-Plattform, die durch die Karel Svoboda Labor (Janelia Farms, HHMI) entwickelt wurde. Scanimage erzeugt eine Zwei-Kanal-Ausgabe von Raster-Scan-Muster auf die x / y galvanometrische Scanspiegel Kontrolle und zur gleichen Zeit erfasst maximal Vier-Kanal-Eingang gleichzeitig von Photomultipliern (PMT) durch eine Messkarte (PCI-6610S , National Instruments). Die PMT-Signale werden durch rauscharme Vorverstärker aktuellen (SR570, Stanford Research System) vor dem Einspeisen in die NI-DAQ-Karte für die Anzeige auf dem Bildschirm verstärkt. Scanimage sammelt z-Stapel-Bildern durch die Steuerung der z-Achse des Objektivs und sammelt Zeitraffer-Bilder in einem Einzel-oder Cycle-Modus. Die Bilder wurden in einer einzigen TIFF-Datei mit 16-Bit-Farbtiefe gespeichert.
7. Bildanalyse mit Amira Software
- Amira Bildgebung für die Tumor-Quantifizierung: In Aimra Software, öffnen Sie das TIFF-Datei mit dem Satz von Z-Stapel-Bildern.
- Markieren Sie den Dateinamen ein, wählen und anwenden Voltex Funktion, um eine dreidimensionale Darstellung zu erzeugen. Ein großer Primärtumor Bild mit mehreren kleineren, distanzierte invasive Gruppen (IG) kollektiv befallenen Zellen ist in der Regel deutlich im gerenderten Bild (siehe Abbildung 6A).
- Zur Auswahl der primären Tumormasse, wählen Sie "Open Data", dann "Labeling", dann "Label Field".
- Thresholding der Primärtumor-select all z-Stapel-Bildern und blättern Sie durch die Bilder in der z-Ebene zur Förderung der Integration nur die primären Tumormasse in drei Dimensionen zu gewährleisten. Dies ist normalerweise der größte großes Bild in das Feld und erscheint oft segmentiert wie das abgebildete durch die z-Ebene durchlaufen wird.
- Verwenden Sie den Zauberstab / Schwellenwert-Funktion, um die Hintergrundfluoreszenz zu korrigieren und zu beseitigen es aus dem Bild ohne Verwerfen eines der Tumor-Signal. Markieren Sie die "Inside File"-Label und klicken Sie auf die Schaltfläche ⊕. Wählen Sie das "Alle Slices" das Kontrollkästchen. Dies erzeugt einen farbigen Rahmen um den Schwellenwert Primärtumor Bereich in jeder z-Stack zu erhöhen.
- Zur Auswahl IGS, wählen Sie die Funktion "Neu". Wählen Sie einen einzelnen IG und sicherzustellen, dass es nicht mit dem primären Tumor durch Scrollen durch die z-Ebene verbunden.
- Wählen Sie "Alle Slices" und klicken Sie auf die Schaltfläche ⊕. Benennen Sie die Datei (ex: IG 1)
- Wiederholen Sie den Schwellenwert Verfahren in 7,4 und die Hervorhebung Schritt in 7,5 für die ermittelten IG. Wählen Sie eine Übersicht farblich als die Farbe verwendet, um den primären Tumor zu bezeichnen.
- Bei Bedarf wiederholen, für jede weitere IG gesamten Bild-, Scan durch die z-Ebene, um sicherzustellen, dass alle IG bezeichnet werden. Mit verschiedenen Farben für jede identifizierte IG Hilfsmittel in Zukunft Identifikation auf das Bild.
- Sobald der primäre Tumor und alle IG ausgewählt sind, wählen Sie "Segmentation" aus dem Pulldown-Menü, und wählen Sie dann "Material Statistics". Dies bietet die Volumen-Messung sowie die X-, Y-und X Tumor Kern-Koordinaten für den Primärtumor, um Entfernungen von IG von der zentralen Tumor Punkt zu berechnen.
- Mit den Bänden berechnet die Entfernung für jede IG aus dem zentralen Kern des Primärtumors. Wählen Sie "Segmentation", dann "Material Statistics". Dieser Schritt berechnet alle Messungen in Pixel. Convert Pixel Mikrometer auf die Kalibrierung des Mikroskop-Objektivs und alle weiteren Anstieg der Vergrößerung (dh, Zoom-Funktionen) basieren. Für das Mikroskop und Einstellungen in diesen Experimenten verwendet wurde, wurde der 40X-Objektiv ohne Zoom verwendet, was eine Kalibrierung von 1 Pixel = 0,298 um. Importieren von Daten in eine Excel-Tabelle, welche Parameter gibt für den Primärtumor in drei Dimensionen (X1, Y1, Z1) und für jede IG (ex: X2, Y2, Z2 zum ersten IG).
- Die befallenen Abstand in Mikrometer für jede IG von der Mitte des Primärtumors wird nach folgender Formel berechnet √ ((X2-X1) 2 + (Y2-Y1) 2 + (Z2-Z1) 2).
- Der Tumor invasive Index (T I) wird mit folgender Formel berechnet T I = N T x V x T D T, wobei T = N die Gesamtzahl der IGS in das Bild, V T = Gesamtvolumen aller IGS, D T = insgesamt zurückgelegte Strecke aller invasiven Gruppen aus der Mitte des Primärtumors.
8. Dreidimensionale Darstellungen mit Nikon NIS-Elements Software
- Dreidimensionale Darstellungen mit einer größeren topografischen Details können durch den Import der ursprünglichen 16-Bit-Monochrom-TIFF-Dateien des gesamten Tumors Bild in das Nikon NIS-Elements-Software erzeugt werdenPaket (Nikon, Melville, NY). Wählen Sie "Datei" und dann "ND", dann "Create ND Datei aus Datei Sequence". Wählen Sie das TIFF z-Serie Bildstapel und geben Sie den entsprechenden Schritt Größe.
- Kalibrieren Sie den ND-Dokument in der xy-Ebene. Geben Sie die Größe eines Pixels mit einer manuellen Kalibrierung.
- Wählen Sie den "Volume View". Verwenden Sie das "HQ"-Funktion, um zusätzliche Schnitte in der z-Ebene für eine höhere Qualität zu berechnen. In der "3D-Renderer-Einstellungen", verwenden Sie den "Advanced Renderer" mit einer Qualität von "Ultra High Details" und "Full Resolution". Wählen Sie "Alpha Blending" zu akzentuieren den Tumor Oberflächen.
- Optimieren Sie die dreidimensionale Grafik für eine Präsentation. Zoom in auf den Tumor und die damit verbundenen IGS und Ernte nach Bedarf. Drehen Sie das Bild in der xyz Flugzeuge und stellen Sie die LUTs.
- Nehmen Sie das Bild für die Präsentation. Wählen Sie "Bearbeiten-Ansicht erstellen Snapshot (8 bit RGB)". Benennen und speichern Sie Datei entsprechend.
9. Repräsentative Ergebnisse
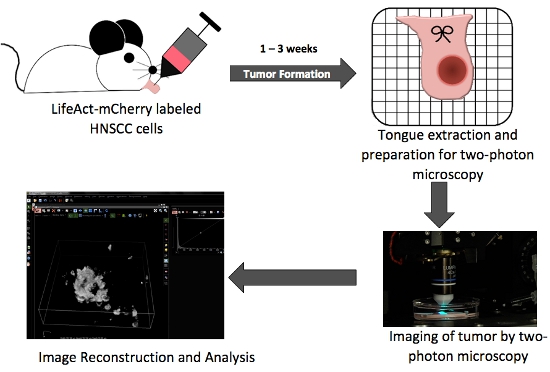
Abbildung 1. Insgesamt schematische Darstellung, wichtige Schritte in orthotopen Zunge Tumor Produktions-und in situ Zwei-Photonen-Imaging.
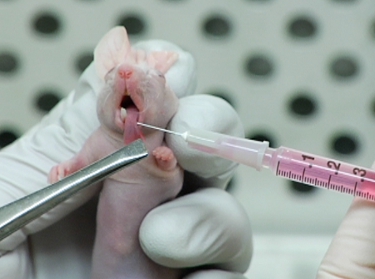
Abbildung 2. Injektion von LifeAct-mCherry Ausdruck OSC19 Zellen in der Maus Zunge.
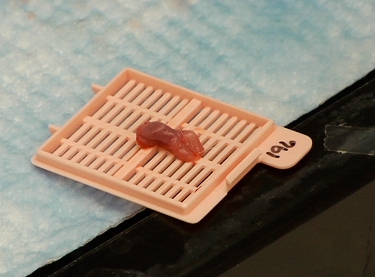
Abbildung 3 resezierten Tumor-haltigen Maus Zunge für Zwei-Photonen-Imaging erstellt.

Abbildung 4. Orientierung eines Tumor-mit der Zunge in Position auf einer Zwei-Photonen-Mikroskopie bereit für die Bildgebung.
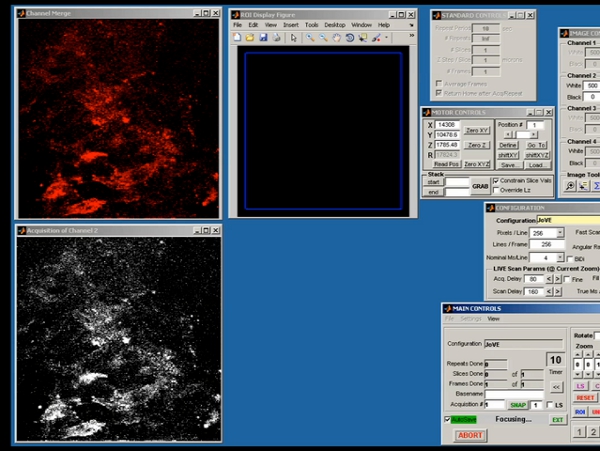
Abbildung 5. Representative Bildschirm aus scanimage demonstrieren Rohdaten Erwerb der anfänglichen Zwei-Photonen-Bild geschossen.
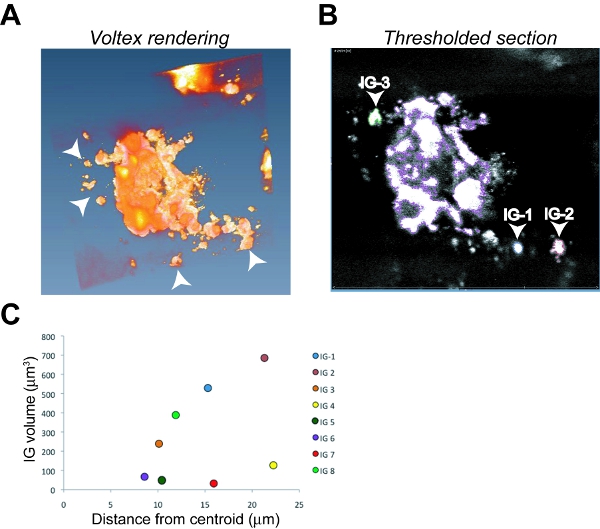
Abbildung 6. Bildanalyse und Quantifizierung der Tumorinvasion in einem orthotopen OSC19 Tumor. Vertreter Screenshot Bilder von Amira Voltex Rendering (A) und einem Schwellenwert z-Bereich (B) mit dem primären Primärtumor in lila, invasive Gruppe 1 (IG-1) in blau umrandete umrissen, IG-2 in rot und IG skizzierten -3 in grün als ein Beispiel für die Identifizierung Verfahren skizziert. Pfeilspitzen bezeichnen IGs in (A) und (B). C. Grundstücke des Volumens im Vergleich zu überfallen Abstand für acht einzelne IG verwendet, um die Tumorinvasion (TI) zu berechnen.
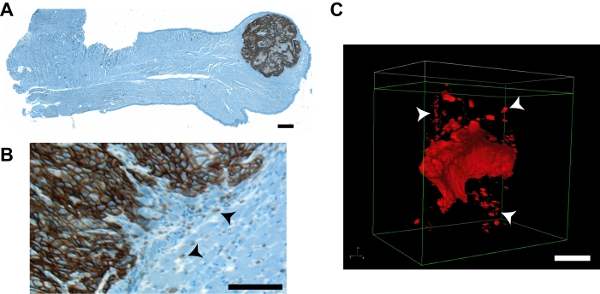
Abbildung 7. Repräsentative Bilder von Tumoren und drangen Tumor Gruppen aus diesem Protokoll im Vergleich mit Bildern aus einer konventionellen IHC-Ansatz. A. Paraffin Abschnitt einer ganzen Maus Zunge enthaltend ein UMSCC1 orthotopen Tumor. Immunhistochemische Färbung wurde durchgeführt unter Verwendung herkömmlicher Verfahren mit einem primären Antikörper gegen die HNSCC-spezifischen Zell-Marker EMMPRIN (Zymed; cat # 34-5600) bei 1:1000 Verdünnung und visualisiert mit Hilfe der OmniMap DAB anti-Rb-Nachweis-Kit (Ventana Kat. Nr. 760 -149), gefolgt von Eisenhämatoxylin Färbung. Bilder umfasst die gesamte Zunge Bereich wurden einzeln mit 4x Vergrößerung auf einem Olympus ZX70 Provis Mikroskop mit einem Optronics Microfire CCD-Kamera erfasst und rekonstruiert mit dem StereoINvestigator Imaging-Paket (MBF Bioscience). Der Tumor ist an der Zungenspitze evident. Eine vergrößerte Region zeigt der invasiven Front und individuelle Tumorzelle Gruppen (Pfeilspitzen) ist in (B). C. Nikon NIS-Elements-Rendering eines Vertreters OSC19 Tumor gezeigt. Verbesserte Kontur Detail und eine klare Darstellung der IGS (Pfeilspitzen) ist evident. Bars in allen Bildern = 100 um.
Diskussion
Orthotopen Mausmodell haben sich für das Studium viele Aspekte der Kopf-und Halstumoren 1,2 nützlich. Wir haben ein gut etabliertes System der orthotopen SCOT 3 mit Zwei-Photonen-Mikroskopie von mCherry-markierten Zellen als System bis in die frühen Ereignisse des Kopfes und Halses Tumorzellinvasion Studie zusammengefasst. In diesem Verfahren haben wir festgestellt, dass Zellen können von der Website des Tumorinjektion Leck, vor allem bei Mäusen sechs Wochen oder jünger aufgrund unzureichender Zunge Größe. Wir verwenden älteren Mäusen, um dieses Problem zu vermeiden. Je größer der Zunge Größe mit älteren Mäusen hilft auch bei der Vermeidung von Bruch einer Arteria lingualis und übermäßige Blutungen aus der Zunge. Tumor zu nehmen, wird entscheidend gestärkt, wenn die Zunge schwillt dramatisch an der Stelle der ersten Injektion. Diese Schwellung innerhalb von 1-2 Stunden, da die injizierte Flüssigkeit aufgesogen ist. Das Tumorwachstum scheint evident 1-2 Wochen nach der Injektion mit dem angegebenen injiziert Zellzahl wie eine kleine weiße Beule auf der Zungenoberfläche. Wir stellen ferner fest, dass bei der 40X-Objektiv in unserem hier vorgestellten Studien verwendet werden, können wir nicht unterscheiden, einzelne Tumorzellen aber IGs als invasive Zellhaufen, dass die typische Form der HNSCC Invasion rekapitulieren zu identifizieren.
Bis heute hat dieses Modell wurde ausgiebig zum Testen der Rolle von spezifischen Molekülen sowie mehrere Anti-Tumor-Medikamente auf SCOT Wachstum einer Invasion, mit der Wirksamkeit von zervikalen Lymphknotenmetastasen überwacht mittels IHC-oder Biolumineszenz-Verfahren 4-7 gemessen werden. Tumoren in diesem System manifestieren in der Nähe der Zungenoberfläche (Abbildung 7) gebildet, so dass die Anwendung der Zwei-Photonen-Mikroskopie Bild gesamten Tumoren in situ als invasive mehrzelligen Cluster. Das Verfahren kann auch genutzt werden, um Tumorinvasion mit zellulärer Auflösung sichtbar zu machen. Zwei-Photonen-Mikroskopie wurde bereits genutzt, um experimentelle Behandlungen für Kopf-und Hals-Krebs in orthotopen 8,9 und 8,10 Xenograft-Modellen zu studieren. Es gibt jedoch zwei wesentliche Unterschiede zwischen diesen Berichten und unser Protokoll. Erstens verwenden diese Studien extrazellulären Etiketten zum Ziel / identify Kopf und Hals Tumorzellen, möglicherweise begrenzen Erkennung nur auf Tumorzellen mit reichlich Zugang zu den Umlauf. Zweitens Invasion von Tumorzellen in der Nähe der primären Standort, die wahrscheinlich rekapituliert frühen metastatischen Aktivität nicht als eine experimentelle Parameter beurteilt. Unser Protokoll bietet die Möglichkeit, direkt zu quantifizieren Tumorzellinvasion zu irgendeinem Zeitpunkt während der Tumorprogression in Maus Zungen. Während die hier beschriebene Methode beschreibt das Verfahren, mit seziert Zungen sind wir derzeit in den Prozess der Anpassung dieser Methode an image Tumorinvasion in lebenden Mäusen für den Einsatz in Kombination mit Biolumineszenz gleichzeitig überwachen frühen Invasion lokalen Lymphknotenbefall und Fernmetastasen in der dasselbe Tier. Änderungen des Protokolls für in-vivo-Bildgebung erfordern eine angemessene Bühne für die Positionierung der Gestaltung und Pflege von Mäusen während der Bildgebung, sowie ein praktisches System, um richtig zu bewässern die Mundhöhle von narkotisierten Mäusen während der bildgebenden Verfahren. Einmal optimiert, so werden diese Anpassungen bieten die Möglichkeit, die Rolle des potenziellen Pro-invasive Moleküle und die Prüfung anti-invasive Verbindungen auf lokaler Invasion und Fernmetastasen Beteiligung an Tieren über einen längeren Zeitraum zu untersuchen.
Offenlegungen
Danksagungen
Unterstützt durch ein Teilprojekt des NIH P20 RR16440 und eine Brücke Zuschuss von der West Virginia University Office of Research und Graduate Education auf S. Weed. Technische Unterstützung von L. Lopez-Skinner in den frühen Phasen der Projektentwicklung wird dankbar anerkannt. Die Autoren sind auch dankbar für technische Hilfe und OSC19 Zellen von J. Myers und M. Younes (Department of Head and Neck Surgery, MD Anderson Cancer Center, Houston, TX), P. Turner und K. Secrest (West Virginia University Department of Pathology Tissue Bank) für die histologische Verarbeitung und Verfahren, R. Wysolmerski (West Virginia University, Department für Neurobiologie und Anatomie) für die LifeAct-mCherry konstruieren und J. Bär (University of North Carolina) für die pLL7.0 lentiviralen Vektor. Die Nutzung der West Virginia University Microscopy Imaging Facility (unterstützt durch NIH P20 RR16440 und Mary Babb Randolph Cancer Center) und seine nicht-lineare optische Mikroskopie-Labor (NLOM, unterstützt durch eine Zusammenarbeit zwischen der West Virginia University Center for Neuroscience und der West Virginia University Department of Physics / West Virginia Nanoscience Initiative) ist ebenfalls herzlich gedankt. Die NLOM wird zum Teil durch NIH P30 RR031155 dem Center for Neuroscience unterstützt.
Referenzen
- Sano, D., Myers, J. N. Xenograft models of head and neck cancers. Head Neck Oncol. 1, 32-32 (2009).
- Kim, S. Animal models of cancer in the head and neck region. Clin Exp Otorhinolaryngol. 2, 55-60 (2009).
- Myers, J. N., Holsinger, F. C., Jasser, S. A., Bekele, B. N., Fidler, I. J. An orthotopic nude mouse model of oral tongue squamous cell carcinoma. Clin Cancer Res. 8, 293-298 (2002).
- Sano, D., Myers, J. N. Metastasis of squamous cell carcinoma of the oral tongue. Cancer Metastasis Rev. 26, 645-662 (2007).
- Sano, D. The effect of combination anti-endothelial growth factor receptor and anti-vascular endothelial growth factor receptor 2 targeted therapy on lymph node metastasis: a study in an orthotopic nude mouse model of squamous cell carcinoma of the oral tongue. Arch Otolaryngol Head Neck Surg. 135, 411-420 (2009).
- Kupferman, M. E. TrkB induces EMT and has a key role in invasion of head and neck squamous cell carcinoma. Oncogene. 29, 2047-2059 (2010).
- Ammer, A. G. Saracatinib Impairs Head and Neck Squamous Cell Carcinoma Invasion by Disrupting Invadopodia Function. J Cancer Sci Ther. 1, 52-61 (2009).
- Rosenthal, E. L., Kulbersh, B. D., King, T., Chaudhuri, T. R., Zinn, K. R. Use of fluorescent labeled anti-epidermal growth factor receptor antibody to image head and neck squamous cell carcinoma xenografts. Mol Cancer Ther. 6, 1230-1238 (2007).
- Gleysteen, J. P. Fluorescent labeled anti-EGFR antibody for identification of regional and distant metastasis in a preclinical xenograft model. Head Neck. 30, 782-789 (2008).
- Bhirde, A. A. Targeted killing of cancer cells in vivo and in vitro with EGF-directed carbon nanotube-based drug delivery. ACS Nano. 3, 307-316 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten