Method Article
Evaluación longitudinal de ratón posteriores pérdida de masa ósea del miembro después de una lesión de la médula espinal utilizando Novel, En vivo Metodología
En este artículo
Resumen
Un examen longitudinal de la pérdida ósea en los fémures y tibias de ratones adultos se llevó a cabo después de una lesión de la médula espinal utilizando secuencial de dosis baja de rayos X de los análisis. La pérdida de hueso tibia se detectó durante todo el estudio, mientras que la pérdida ósea en el fémur no se detectó hasta 40 días después de la lesión.
Resumen
Lesión de la médula espinal (SCI) es a menudo acompañada por la osteoporosis en las regiones sublesional de la pelvis y las extremidades inferiores, dando lugar a una mayor frecuencia de fracturas 1. Como estas fracturas suelen ocurrir en las regiones que han perdido la función sensorial normal, el paciente está en un mayor riesgo de fractura de patologías dependientes, incluyendo la muerte. SCI-dependiente de la pérdida en la densidad mineral ósea (DMO, g / cm 2) y contenido mineral óseo (BMC, g) se ha atribuido a la falta de uso mecánico 2, aberrante señalización neuronal 3 y 4 los cambios hormonales. El uso de modelos de roedores de la osteoporosis inducida por SCI pueden proporcionar valiosa información sobre los mecanismos que subyacen al desarrollo de la osteoporosis después de SCI, así como un entorno de prueba para la generación de nuevas terapias 5-7 (y revisado en 8). Modelos de ratón de la médula espinal son de gran interés ya que permiten una aproximación reduccionista a los mecanismos de ba-sed de evaluación mediante el uso de ratones transgénicos y nula. Aunque estos modelos han aportado datos importantes, todavía hay una necesidad de invasión mínima, métodos confiables, reproducibles y cuantificables para determinar el grado de pérdida ósea después de SCI, en particular en el tiempo y dentro del mismo grupo de animales de experimentación, para mejorar el diagnóstico , los métodos de tratamiento, y / o la prevención de la osteoporosis inducida por SCI.
Un método ideal para medir la densidad ósea en los roedores permitiría exposiciones múltiples, secuenciales (el tiempo) a bajos niveles de radiación de rayos X. Este estudio describe el uso de un nuevo conjunto de animales del escáner, el IVIS Lumina XR (Caliper Instruments) que se pueden utilizar para proporcionar energía de bajo (1-3 miligray (mGy)) de alta resolución, de gran aumento imágenes de rayos X de los huesos de las extremidades posteriores del ratón en el tiempo después de SCI. Pérdida significativa de densidad ósea se ha visto en las tibias de los ratones en 10 días después de la transección espinal en comparación con los no lesionados, pareados por edad de control (ingenuo) de los ratones (13% de disminución, p <0,0005). Pérdida de densidad ósea en el fémur distal también fue detectable a los 10 días post-SCI, mientras que una pérdida de densidad en el fémur proximal no fue detectable hasta 40 días después de la lesión (7% de disminución, p <0,05). SCI-dependiente de la pérdida de densidad del ratón fémur fue confirmada post-mortem a través del uso de energía dual de rayos X absorciometría (DXA), el "patrón oro" actual para mediciones de densidad ósea. Se detecta una pérdida del 12% de BMC en los fémures de los ratones a los 40 días post-SCI con el IVIS Lumina XR. Esto se compara favorablemente con una pérdida de BMC ya se ha informado de un 13,5% por Picard y colegas que utilizan el análisis de DXA en los fémures de ratón post-mortem 30 días post-SCI 9. Nuestros resultados sugieren que el IVIS Lumina XR ofrece una novela, el método de high-resolution/high-magnification para llevar a cabo a largo plazo, las mediciones longitudinales de la densidad de los huesos posteriores de las extremidades en el ratón después de SCI.
Protocolo
1. Espinal de ratón modelo de corte transversal
- Adulto, hombre, C57BL6 ratones (aproximadamente 20-25 g) son anestesiados utilizando una combinación de ketamina (200 mg / kg) y xilazina (10 mg / kg). Todos los procedimientos quirúrgicos se realizan en un entorno institucional, IACUC aprobado por quirófano bajo condiciones estériles.
- Una vez que profundamente anestesiados, la piel de la espalda se recorta el uso de podadoras eléctricas. La parte trasera es la primera afeitada limpia con una solución de yodo seguida de etanol al 70%.
- Antes de la incisión inicial, el área de la parte de atrás de una incisión por primera vez se infiltraron con un anestésico local (bupivacaína) a una concentración de (0,25%, <1ml/kg) para minimizar el dolor post-quirúrgico.
- Utilizando unas tijeras pequeñas, una pequeña abertura en la piel alrededor de la zona de L2. Esta apertura se amplía con el mismo conjunto de tijeras, que se extiende longitudinalmente a la zona de T2. Los bordes de la piel luego se mantienen separadas mediante el uso de bulldogs.
- Micro-tijeras se utilizanpara eliminar el tejido muscular de la lámina dorsal vertebral a nivel torácico 8 (T8). T8 se puede identificar como se describe en Kuh y Wrathall (1998) 10. En pocas palabras, T13 se pueden identificar por su apófisis espinosa dorsal. Con un par de pinzas Dumont n º 5, de la última costilla se puede palpar / identificados y contados de nuevo a T8. Una vez aprobados, gubias hueso se utiliza para realizar una laminectomía dorsal en T8.
- Lesión completa transección espinal: Una vez que la médula espinal está expuesta a T8, un conjunto adicional de esterilizar micro-tijeras se usan para cortar la médula espinal en el plano perpendicular al eje longitudinal de la médula con un microscopio quirúrgico. Usamos # 5 pinzas Dumont para levantar suavemente uno de los polos de la médula espinal para confirmar la integridad de la lesión.
- Después de la transección espinal, un pequeño pedazo de espuma de gel estéril, empapada en solución salina estéril (0,9%) se coloca cuidadosamente en la cavidad de la lesión para favorecer la hemostasia.
- Una pieza adicional de espuma de gel se coloca sobre el giro expuestosal cable. La piel se cierra con estéril, de acero inoxidable con grapas quirúrgicas. Los sujetos se regresan a sus jaulas, colocado sobre una toalla de papel para evitar la aspiración de material de cama y se calienta con una almohadilla eléctrica por un período de aproximadamente 12 horas. Los sujetos también se les proporciona paquetes de hidrogel (ClearH2O) y pellets de comida en el piso de sus jaulas durante la recuperación temprana. Sujetos perjudicados son capaces de acceder a los alimentos / agua en sus jaulas, una vez recuperado de la anestesia.
- Todos los sujetos lesionados reciban evacuación manual de dos veces al día la vejiga (aproximadamente a intervalos de 12 horas) mediante una modificación del método manual de Crede para la duración del estudio (40 días).
- Los ratones lesionados también reciben inyecciones dos veces al día por vía intraperitoneal de 0,9% durante tres días (0,5 cc) para ayudar a mantener la hidratación, y dos inyecciones diarias de la buprenorfina opiáceos (0,05 mg / kg) para controlar el dolor post-quirúrgico por un período de 5 días. Si los animales presentan signos of dolor después del período inicial de cinco, que iban a recibir buprenorfina adicionales (0,05 mg / kg) al día hasta que los signos de dolor (movilidad reducida, la estatura encorvada, la falta de novio, la vocalización, cuando se manipula) han resuelto.
2. La evaluación longitudinal de la densidad ósea mediante el IVIS Lumina XR en la misma cohorte de ratones medular seccionado-
- A partir del día 10 post-SCI y continuando a intervalos de 10 días hasta el día 40, se evaluó el fémur derecho e izquierdo y tibia en la vida, los sujetos anestesiados (SCI transección y la sana controles emparejados por edad).
- En el día de la exploración, los sujetos fueron trasladados en sus jaulas de la zona de Vivero de la Institución a la sala en la que el Caliper IVIS Lumina XR se encuentra. Todos los sujetos se anestesiaron con el mismo ketamina / xilazina cóctel utilizado anteriormente en la entrega de SCI. Este cóctel asegura un estado de anestesia durante un periodo de 1 a 1.5 horas, suficiente para la duración de la scannción del procedimiento.
- El investigador inicia el dispositivo de Lumina XR y permite que la cámara interna para alcanzar la temperatura de funcionamiento (-90 ° C) (~ 10 minutos).
- Una vez anestesiado, el sujeto (transección o control) se coloca suavemente en la plataforma de los animales en la XR Lumina. Una lente de gran aumento se inserta en el dispositivo para permitir que se centran tanto en el fémur y la tibia regiones (Campo de visión 2.4X2.4cm con lente de gran aumento). Si el sujeto no está bien colocado fuera del campo de vista, la puerta se abre y el tema volverá a colocar hasta la extremidad posterior derecha o izquierda se centra (ver Figura 2a para su correcta colocación de la extremidad posterior).
- Una vez colocado correctamente, la función de rayos X puede ser ejecutado. Hacer una selección de la Energía en la lista desplegable adecuado de los animales (sujeto vivo, 35 Kv 100uA, filtra los rayos X)
- Una vez que el animal se encuentra en la posición correcta, active la función de rayos X por medio de cheque, marca X-Ray en elpanel de control. Adquirir la imagen de rayos-X. Asegúrese de que todo el fémur y la tibia son visibles (ver Figura 2b). Los datos brutos de imagen se guarda automáticamente en el disco duro. Representante. TIFF también se guardan. El ratón es devuelto a su jaula y se les permite recuperarse bajo la observación del investigador. El proceso se repite con el ratón al lado.
Nota: El software de imagen viva muestra transformado imágenes de rayos X por defecto. Para mostrar la cruda imágenes de rayos X, quite la marca de verificación junto a absorción de rayos X en las correcciones / Las herramientas de filtrado. Cuando los datos de rayos-X ha sido corregido en la absorción, se puede evaluar la densidad ósea relativa mediante la comparación de la intensidad de la señal de medición de ROI. La intensidad de retorno de la inversión aumenta con la densidad de los tejidos aumentando.
3. Análisis de imágenes de IVIS de rayos X escanea
- Abra el software haciendo doble clic sobre el icono de imagen de vida.
- Cargar una imagen de rayos X, haga clic en el en el botón Examinar. En el cuadro de diálogo que aparece, seleccione la carpeta de interés y haga clic en Aceptar. El navegador de viva imagen muestra los datos seleccionados, junto con el ID de usuario, información de la etiqueta y la información de configuración de la cámara. Para abrir los datos, realice una de las siguientes: Haga doble clic en la fila de datos, haga clic en el nombre de carga de datos y seleccionar en el menú contextual, seleccione la fila de datos y haga clic en Cargar, o doble clic en la miniatura. La paleta de la imagen y la herramienta se muestran. Datos abiertos se resalta en verde en el navegador.
- Haga clic en Herramientas de retorno de la inversión en la paleta de herramientas. En las herramientas de ROI, retorno de la inversión seleccione el tipo de medición de la lista desplegable. Para cargar el ROI 3 se utiliza en este experimento, haga clic en el icono de la plaza y la carga de 3 casillas.
- Con una regla, medir la longitud del fémur. Ajustar la longitud de dos de las plazas que se ª 1 / 8 de la longitud del fémur total de. Ajustar el ancho de estas dos plazas que se 1/24th la longitud del fémur total. Con la regla, medir 1 / 8 de la distancia desde el extremo proximal del fémur, y situar a la plaza para que se centra en el fémur. Situar a la segunda plaza para que quede 1/4o de la longitud del fémur total del extremo distal del fémur (Fig. 3). Estos de retorno de la inversión se puede utilizar para medir las regiones del fémur proximal y distal.
- Con la regla, medir la longitud de la tibia. Ajustar la longitud de la tercera plaza a ª 1 / 8 de la longitud de la tibia total. Ajustar el ancho y 1 / 30 ª de la longitud de la tibia total. Situar a la plaza para que esté centrado y 1 / 8 de la longitud total de la distancia de la tibia desde el extremo proximal de la tibia (ver Figura 3).
- Haga clic en el icono de la medida (un lápiz y una regla). Las mediciones de la intensidad de retorno de la inversión aparecen en la imagen de rayos X y aparece la tabla de mediciones de rendimiento de la inversión. Exportar esta tabla to la ubicación deseada en un archivo. csv. Esto le permitirá abrir la tabla con Excel.
- Repita este proceso con todas las de las imágenes guardadas.
- Consolidar todos los datos en una hoja Excel. La significación estadística se determinó a través de la t de Student prueba utilizando Microsoft Excel o SigmaPlot 11.0 de software (Software Systat).
4. Análisis post-mortem de la densidad ósea:
- Tras la adquisición de la final longitudinal de rayos X de exploración dentro de la XR IVIS Lumina, los ratones son posteriormente profundamente anestesiados con Beuthanasia (75 mg pentobarbital / kg). Una vez que la anestesia profunda se ha logrado, los ratones son transcardially perfundidos con helado frío tampón fosfato salino con heparain (40 mg / litro) a exsanguinate.
- Una vez desangrado, los impuestos especiales ambos fémures. Pagar un cuidado especial para eliminar los tejidos blandos tanto como sea posible, para ello se ha demostrado que afecta a 11 mediciones de la densidad. Envuelva los fémures con una gasa empapados en agua y almacenar en-20C hasta que esté listo para su análisis.
5. DXA Análisis utilizando un Hologic QDR 4000 Densitómetro Óseo
- Una gasa empapada en descongelar el fémur y la transferencia a la habitación ósea densitómetro.
- Calibrar el aparato de acuerdo con el protocolo del fabricante; asegurar que los valores de BMC y BMD dentro de los límites aceptables.
- Colocar un colimador de bronce en la máquina. Esto permite al usuario limitar el tamaño y el ángulo del haz de rayos X para centrarse en un objetivo específico.
- Sumerja el fémur descongelado en un plato de Petri llenas de agua (cóndilos a la izquierda, con el paralelo del fémur a la cama), y la posición justo a la derecha del láser.
- Escriba una biografía (un título descriptivo que incluye información de identificación de animales, tratamiento, etc) para el fémur que va a escanear.
- Entrar en el menú de exploración de las selecciones, a continuación, seleccione regiona alta resolución. Indique sus parámetros de análisis: Una exploración de la región 2 x 0,7489 pulgadas, con 0,01 interlineado pulgadas y resolución de punto 0,00499 pulgadas.
Nota: Monitor de la exploración mientras está en curso. A medida que el haz de rayos X trama explora la muestra, el monitor para asegurarse de que hay suficiente agua en la cámara para cubrir completamente la muestra de hueso. - Analizar entrar en el menú de selección de análisis. Siga las instrucciones para poner de relieve el fémur completo como un retorno de la inversión. Una página del informe se van a plantear con la calculada BMC (gramos) y la DMO (g / cm 2).
- Repita estos pasos para analizar los fémures restantes.
- Consolidar todos los datos en una hoja de Excel y el análisis estadístico (t-test).
6. Los resultados representativos:
La pérdida de densidad ósea relativa de la tibia y el fémur de ratón después de una lesión de la médula espinal en comparación con los ratones ingenuo es detectable con el método anterior. Hay una disminución detectable significativamente la densidad ósea despuéssólo 10 días (12%, p <0,0005), con un máximo de 15% de pérdida de densidad ósea a los 40 días (p <0,0005, Figura 4). Pérdida de densidad ósea en el fémur se observó a 40 días después de la lesión (7% de disminución, p <0,05, Figura 5). Estos resultados proporcionan evidencias para el uso de no-invasivo imágenes de rayos X para la observación longitudinal de los cambios de la densidad ósea después de una lesión de la médula espinal.
Con el fin de comparar la eficacia de este método a lo que es en la actualidad; se analizaron los fémures extirpado de estos ratones 40 días después de la lesión usando DXA imágenes. Una representación de la salida de datos se puede observar en la Figura 6. Hemos encontrado que hay una pérdida significativa de contenido mineral óseo en los ratones SCI en comparación con ingenua (12% de disminución, p <0,05, Figura 7). La densidad mineral ósea no cambió significativamente, pero siguió una tendencia similar (Figura 8). Estos resultados son similares a los encontrados en la literatura; Picard et al observaron una disminución del 13,5% (p <0,001) en la revista BMC, pero no significativa decrfacilidad en la DMO (Picard 2008).
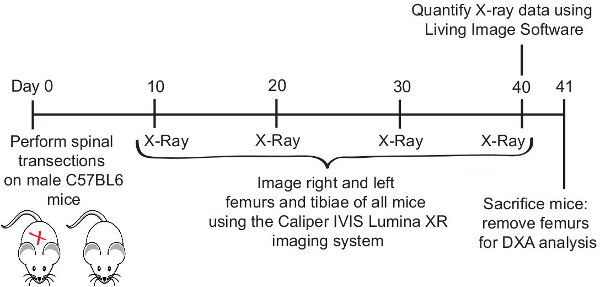
Figura 1. Cronología Experimental.
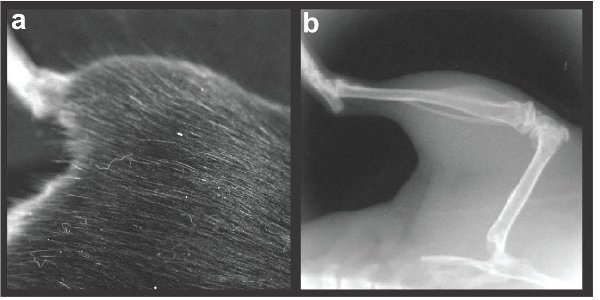
Figura 2 orientación Representante de la izquierda patas traseras:. Una fotografía) y b) x-ray.
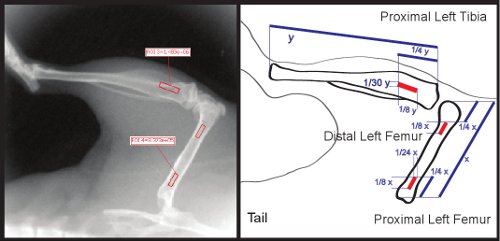
Figura 3. Dimensiones retorno de la inversión y la orientación dentro de las regiones de la porción proximal del fémur y la tibia.
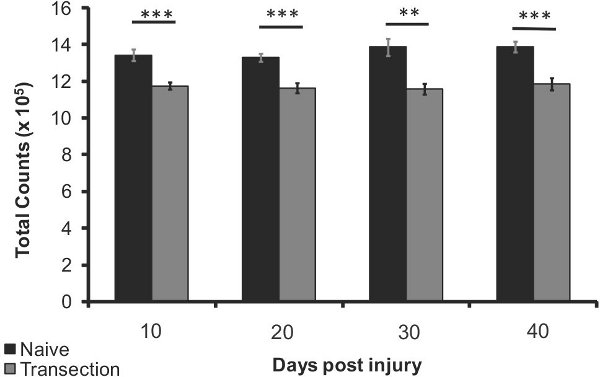
Figura 4. La pérdida de densidad ósea después de la lesión en la tibia proximal 10, 20, 30 y 40 días después de la lesión (n = 5) en comparación con la misma edad ingenuos (n = 5). Las barras de error representan el SEM; ** p <0.005, *** p <0,0005.
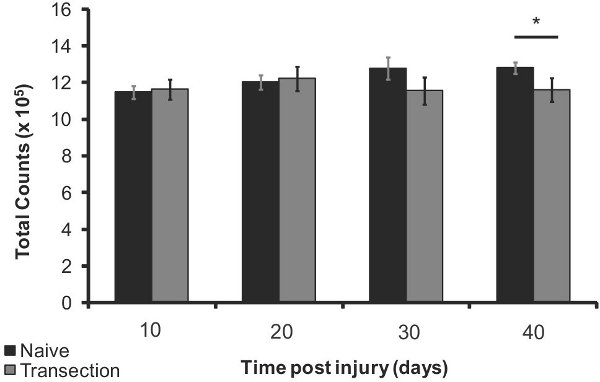
Figura 5. La pérdida de hueso densidad después de la lesión en el fémur proximal 10, 20, 30 y 40 días después de la lesión (n = 5) en comparación con la misma edad ingenuos (n = 5). Las barras de error representan el SEM, * p <0,05.
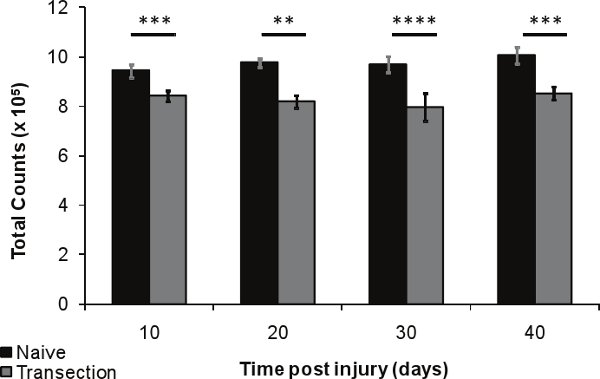
Figura 6. La pérdida de densidad ósea después de la lesión en el fémur distal días 10, 20, 30 y 40 después de la lesión (n = 5) en comparación con controles pareados por edad ingenua (n = 5). Las barras de error representan el SEM, * p <.01 a .05, ** p <0,001-0,01; *** p <0.0001-0.001, **** p <0,0001.
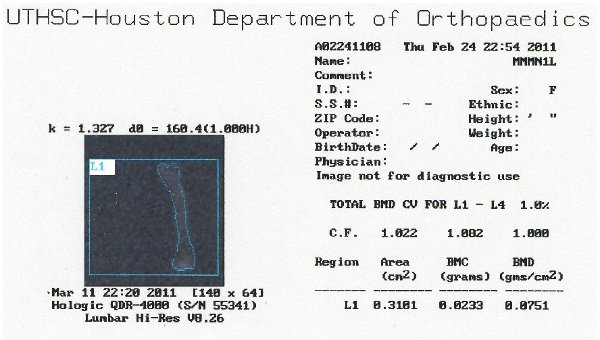
Figura 7. Imagen representativa de los datos de DXA muestra BMC y la salida de DMO.
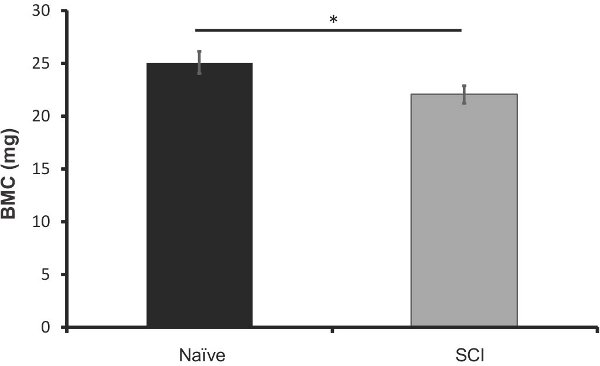
Figura 8. DXA análisis de contenido mineral óseo (gramos) en los fémures de los ratones SCI 40 días después de la lesión (n = 5) vs la misma edad ingenuos (n = 5).Las barras de error representan el SEM, * p <0,05.
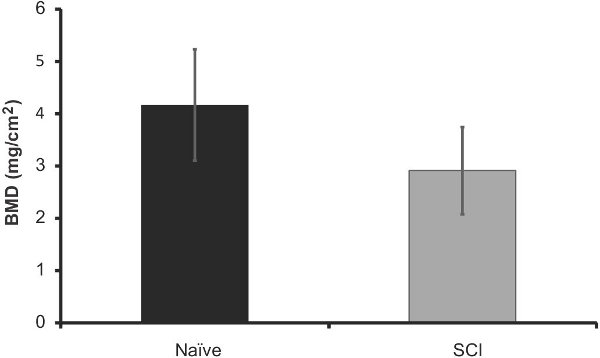
Figura 9. DXA análisis de la densidad mineral ósea (mg / cm 2) en los fémures de los ratones después de la lesión SCI 40 días (n = 5) vs la misma edad ingenuos (n = 5). Las barras de error representan el SEM, no hubo diferencias significativas.
Discusión
Este estudio presenta una novela, método no invasivo para evaluar los cambios de densidad en los huesos individuales (tibia y fémur) en sentido longitudinal, en una única cohorte de ratones, utilizando la pinza IVIS Lumina XR sistema de imágenes. SCI produce una disminución en la densidad ósea en ambos fémures y tibias cuando se estudió en una única cohorte de medular seccionado-ratones durante un periodo de prueba de 40 días en comparación con la misma edad, los ratones de control no lesionado,. Nuestros resultados en el fémur fueron confirmados, post-mortem, a través de la utilización de DXA, lo que sugiere que la aplicación de la pinza Instrumentos IVIS Lumina XR puede servir como una herramienta de medición sensibles para evaluar los efectos a largo plazo y progresivo de la lesión medular en la pérdida de hueso .
Uno de los beneficios potenciales a los investigadores que utilizan este sistema es la capacidad de seguir el desarrollo longitudinal de los cambios patológicos en los huesos de las extremidades posteriores de los animales después de SCI. La capacidad de evaluar una única cohorte largos períodos de tiempo proporciona stRong ventajas para el investigador en términos de: 1) los costos asociados con la compra y cuidado de animales a largo plazo. En lugar de un estudio que requiere un gran número de animales que deben ser sacrificados en momentos específicos a fin de evaluar cambios dependientes del tiempo, estos resultados patológicos se puede seguir en la misma cohorte durante ese mismo período de tiempo, 2) la variabilidad: además de comparación con las cohortes de control, los resultados generados en la cohorte de sujetos perjudicados puedan ser evaluados y comparados entre los puntos de tiempo para los mismos animales en toda la extensión del estudio, una vez más, la reducción de la variabilidad intra-animal, así como la necesidad de una mayor cohortes de sujetos experimentales.
Mientras que la pinza IVIS Lumina XR nos ha proporcionado importante información longitudinal sobre el desarrollo de la osteoporosis inducida por SCI, existen limitaciones que deben considerarse: 1) mientras que esta plataforma nos ha permitido generar de alta resolución de rayos X de datuno en los huesos de las extremidades posteriores de los ratones después de SCI, su utilidad puede ser limitada a pequeños roedores como ratones. La altura máxima permitida tema dentro de la XR Lumina es de 2,8 cm. Cualquier cosa por encima de esa altura no puede ser fotografiada con éxito mediante el componente de rayos X de la XR Lumina. En nuestras manos, esto ha impedido nuestra capacidad de estudiar las ratas en el 200-250 gramos de peso. Si bien puede ser posible que las ratas de imagen en este rango de peso u otros roedores como hamsters o jerbos, esto requiere pruebas adicionales de la PI. 2) la orientación conjunta. Es fundamental que el investigador cuidadosamente los arreglos de las extremidades en una orientación de fácil reproducción que permitirá la comparación con éxito entre las sesiones de formación de imágenes. Normalización de la colocación de las extremidades le permitirá al investigador para generar y aplicar estandarizados retorno de la inversión que se puede guardar y aplicar a través de ambos temas y el tiempo.
En general, creemos que el IVIS Lumina XR ofrece una excelente plataforma con la que el modeloel desarrollo de la lesión medular dependiente de la osteoporosis en ratones. La capacidad para estudiar la pérdida de hueso dentro de la cohorte longitudinal mismo ratón nos permitirá: 1) comprender mejor la naturaleza temporal de la pérdida de masa ósea y la desmineralización después de la lesión, 2) determinar si estos cambios estabilizar en el tiempo, 3) explorar, con la disponibilidad de transgénicas y las líneas de ratón nulo, la capacidad de estudiar los mecanismos moleculares que subyacen a estos cambios patológicos de una manera reduccionista, y 4) muy posiblemente la ventaja más importante, empezar a probar nuevas intervenciones diseñadas para evitar tanto la aparición de osteoporosis en las primeras etapas de la lesión, o, para revertir estos cambios una vez que la osteoporosis ya ha desarrollado. Por último, el XR Lumina, además de proporcionar un excelente potencial de rayos X de imagen, también puede ser utilizado para estudiar tanto las señales luminiscentes y fluorescentes en animales vivos. Uno podría imaginar fácilmente la incorporación de las otras modalidades que ofrece dentro de este sistema para buscar a una multitude de los factores que determinan la dinámica del hueso de manera mecánica los siguientes SCI o cualquier otra enfermedad que produce la osteoporosis.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Nos gustaría dar las gracias a la Misión Connect y la Fundación Gillson-Longenbaugh por proporcionar los fondos para este proyecto. También nos gustaría agradecer a la Dra. Catherine Ambrosio por su asesoramiento crítico y el uso de sus equipos de DXA. Por último, nos gustaría agradecer a la Dra. Kaori Ono, Departamento de Biología Integrativa y Farmacología, por sus sugerencias en el análisis de DXA fémur.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Beuthanasia | Mayordomo Schein Animal Salud | 001848 | |
| Ketathesia (ketamina Clorhidrato) | Mayordomo Schein Animal Salud | 023061 | |
| Xilazina | Mayordomo Schein Animal Salud | 037849 | |
| Bupivicaína | Mayordomo Schein Animal Salud | 021801 | |
| Gelfoam; 7MM | Fisher Scientific | NC0085178 | Para promover la hemostasia en cirugía |
| IVIS Lumina XR | Caliper Life Sciences | 135400 | |
| ZFOV, 2,5 cm de campo punto de vista del objetivo | Caliper Life Sciences | 127285 | Que sea absolutamente necesario ageneran un alto ampliación de rayos X imágenes de los huesos estructura |
| QDR ósea Densitómetro | Hologic | Modelo ya no se usan en la producción |
Referencias
- Jiang, S. D., Jiang, L. S., Dai, L. Y. Mechanisms of osteoporosis in spinal cord injury. Clin. Endocrinol. (Oxford). 65, 555-565 (2006).
- Uebelhart, D., Demiaux-Domenech, B., Roth, M., Chantraine, A. Bone metabolism in spinal cord injured individuals and in others who have prolonged immobilisation. A review. Paraplegia. 33, 669-673 (1995).
- Elefteriou, F. Neuronal signaling and the regulation of bone remodeling. Cell. Mol. Life. Sci. 62, 2339-2349 (2005).
- Finsen, V., Indredavik, B., Fougner, K. J. Bone mineral and hormone status in paraplegics. Paraplegia. 30, 343-347 (1992).
- Sugawara, H., Linsenmeyer, T. A., Beam, H., Parsons, J. R. Mechanical properties of bone in a paraplegic rat model. J. Spinal. Cord. Med. 21, 302-308 (1998).
- Kiratli, B. J., Smith, A. E., Nauenberg, T., Kallfelz, C. F., Perkash, I. Bone mineral and geometric changes through the femur with immobilization due to spinal cord injury. J. Rehabil. Res. Dev. 37, 225-233 (2000).
- Shen, J., Fan, L., Yang, J., Shen, A. G., Hu, J. M. A longitudinal Raman microspectroscopic study of osteoporosis induced by spinal cord injury. Osteoporos. Int. 21, 81-87 (2010).
- Guertin, P. A. A technological platform to optimize combinatorial treatment design and discovery for chronic spinal cord injury. J. Neurosci. Res. 86, 3039-3051 (2008).
- Picard, S., Lapointe, N. P., Brown, J. P., Guertin, P. A. Histomorphometric and densitometric changes in the femora of spinal cord transected mice. Anat. Rec. (Hoboken). 291, 303-307 (2008).
- Kuhn, P. L., Wrathall, J. R. A mouse model of graded contusive spinal cord injury. J. Neurotrauma. 15, 125-140 (1998).
- Tsujio, M. mineral analysis through dual energy X-ray absorptiometry in laboratory animals. J. Vet. Med. Sci. 71, 1493-1497 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados