Method Article
Продольные Оценка Мышь Задние потери костной массы конечности после Травма спинного мозга с использованием новых, В естественных условиях Методология
В этой статье
Резюме
Продольное исследование потери костной массы в бедра и голени взрослых мышей проводили следующие повреждения спинного мозга использованием последовательного низкой дозы рентгеновского сканирования. Tibia потери костной массы был обнаружен во время исследования, в то время как потеря костной ткани в бедренной кости не был обнаружен до 40 дней после травмы.
Аннотация
Spinal cord injury (SCI) is often accompanied by osteoporosis in the sublesional regions of the pelvis and lower extremities, leading to a higher frequency of fractures 1. As these fractures often occur in regions that have lost normal sensory function, the patient is at a greater risk of fracture-dependent pathologies, including death. SCI-dependent loss in both bone mineral density (BMD, grams/cm2) and bone mineral content (BMC, grams) has been attributed to mechanical disuse 2, aberrant neuronal signaling 3 and hormonal changes 4. The use of rodent models of SCI-induced osteoporosis can provide invaluable information regarding the mechanisms underlying the development of osteoporosis following SCI as well as a test environment for the generation of new therapies 5-7 (and reviewed in 8). Mouse models of SCI are of great interest as they permit a reductionist approach to mechanism-based assessment through the use of null and transgenic mice. While such models have provided important data, there is still a need for minimally-invasive, reliable, reproducible, and quantifiable methods in determining the extent of bone loss following SCI, particularly over time and within the same cohort of experimental animals, to improve diagnosis, treatment methods, and/or prevention of SCI-induced osteoporosis.
An ideal method for measuring bone density in rodents would allow multiple, sequential (over time) exposures to low-levels of X-ray radiation. This study describes the use of a new whole-animal scanner, the IVIS Lumina XR (Caliper Instruments) that can be used to provide low-energy (1-3 milligray (mGy)) high-resolution, high-magnification X-ray images of mouse hind limb bones over time following SCI. Significant bone density loss was seen in the tibiae of mice by 10 days post-spinal transection when compared to uninjured, age-matched control (naïve) mice (13% decrease, p<0.0005). Loss of bone density in the distal femur was also detectable by day 10 post-SCI, while a loss of density in the proximal femur was not detectable until 40 days post injury (7% decrease, p<0.05). SCI-dependent loss of mouse femur density was confirmed post-mortem through the use of Dual-energy X-ray Absorptiometry (DXA), the current "gold standard" for bone density measurements. We detect a 12% loss of BMC in the femurs of mice at 40 days post-SCI using the IVIS Lumina XR. This compares favorably with a previously reported BMC loss of 13.5% by Picard and colleagues who used DXA analysis on mouse femurs post-mortem 30 days post-SCI 9. Our results suggest that the IVIS Lumina XR provides a novel, high-resolution/high-magnification method for performing long-term, longitudinal measurements of hind limb bone density in the mouse following SCI.
протокол
1. Мышь спинного перерезки модель
- Взрослый, мужчина, C57BL6 мышей (примерно 20-25 г) под наркозом с использованием комбинации кетамин (200 мг / кг) и ксилазина (10 мг / кг). Все хирургические процедуры выполняются в Институциональные, IACUC одобренных хирургических набора в стерильных условиях.
- Как только глубоко под наркозом, мех обратно отделан с использованием электрической машинкой. Бритой спиной первого удалено с раствором йода затем 70% этанола.
- До начального разреза, область спины должны быть врезаны сначала проникли под местной анестезией (Marcaine) в концентрации (0,25%, <1ml/kg) свести к минимуму послеоперационные боли.
- Используя небольшие ножницы, небольшие открытия, сделанные в кожу примерно в области L2. Это открытие расширен с тем же набором ножницы, расширение продольном направлении T2 области. Края кожи, затем содержались отдельно через использование зажимов бульдога.
- Микро-ножницы затем используютсяочистить мышечной ткани спинного спинного пластинки на грудном уровне 8 (T8). T8 могут быть идентифицированы, как описано в Кух и Wrathall (1998) 10. Короче говоря, T13 можно определить по ее спинной остистого отростка. Используя пару # 5 щипцы Дюмон, последнего ребра можно пропальпировать / определены и подсчитаны обратно T8. Как только рассеялся, кости Rongeurs которые используются для выполнения спинного ламинэктомии на Т8.
- Полный спинного Поражение Перерезка: После того, спинной мозг подвергается в T8, дополнительный набор стерилизовать микро-ножницы используются для разорвать спинного мозга в плоскости, перпендикулярной продольной оси шнура под хирургический микроскоп. Мы используем # 5 Дюмон пинцетом осторожно поднимите один полюс спинного мозга, чтобы подтвердить полноту поражения.
- После перерезки спинного, небольшой кусочек стерильного gelfoam, пропитанной стерильным физиологическим раствором (0,9%) осторожно помещают в поражении полости содействовать гемостаза.
- Дополнительная часть gelfoam помещается над открытыми для спинадр. мозга. Кожа затем закрывается стерильной, нержавеющей стали, хирургические скобы. Субъекты, затем вернулись в свои клетки дома, расположенные на бумажное полотенце, чтобы предотвратить стремления подстилки и нагревают с грелку в течение примерно 12 часов. Субъекты также предоставляется Гидрогель пакетов (ClearH2O) и пищевой гранулы на полу их клеток на ранних стадиях восстановления. Травмированные субъектов могут получить доступ к пищи / воды в клетках домой раз оправился от наркоза.
- Все субъекты получают ранения два раза в день руководство эвакуации мочевого пузыря (примерно в 12-часовыми интервалами) с помощью модифицированной методики ручного метода Crede в течение всего срока исследования (40 дней).
- Травмированные мыши также предоставляются два раза в день внутрибрюшинного введения 0,9% физиологического раствора в течение трех дней (0,5 см), чтобы помочь сохранить гидратации, и два раза в день инъекции опиатов бупренорфин (0,05 мг / кг) для контроля послеоперационной боли в течение 5 дней. Если животные проявляют признаки ое боли после первых 5 дней, они будут получать дополнительные бупренорфин (0,05 мг / кг) в день, пока признаки боли (уменьшение подвижности, сгорбившись роста, отсутствие жениха, вокализации при работе с ними) решили.
2. Продольные оценки плотности костной ткани использованием ИВИС Lumina XR на той же когорты spinally-перерезана мышей
- Начиная с 10 день после ТСМ и продолжая в 10 дневными перерывами до 40 дня, мы оценивали правого и левого бедра и голени в живых, под наркозом предметов (перерезка SCI и невредимым возраста из контрольной группы).
- В тот день, сканирования, предметы были переданы в своих клетках домой из Виварий области учреждение, чтобы комната, в которой суппорт ИВИС Lumina XR расположен. Все предметы, то под наркозом с использованием тех же кетамин / ксилазина коктейль ранее использовались в доставке ТСМ. Этот коктейль обеспечивает состоянии наркоза в течение от 1 до 1,5 часов; достаточное для продолжительности ScannING процедуры.
- Следователь инициализирует устройства Lumina XR и позволяет внутренней камеры для достижения рабочей температуры (-90 ° C) (~ 10 минут).
- После анестезии, субъект (перерезка или контроля) аккуратно размещены на животных платформы в рамках Lumina XR. Объектив высокого увеличения вставляется в устройство, позволяющее сосредоточиться на оба бедра и голени регионов (Поле зрения 2.4X2.4cm с большим увеличением объектива). Если предмет неправильного расположения вне поля зрения, открывается дверь и субъект повторно позиционируется до левой или правой задней конечности по центру (см. рис 2а для правильного размещения задних конечностей).
- После правильно расположен, рентгеновских функция может быть выполнена. Сделать выбор из энергии выпадающего списка подходят для животных (Жизнь предметом, 35 кВ 100uA, фильтруют рентгеновских лучей)
- Как только животное находится в правильном положении, включите рентгеновского функцию, проверить маркировку X-Ray впанель управления. Приобретать рентгеновского изображения. Убедитесь, что все бедра и голени видны (рис. 2б). Исходные данные изображения автоматически сохраняются на жестком диске. Представителя. TIFF файлы также сохраняются. Мыши, затем возвращается в исходное клетку и позволил восстановить под следователь наблюдения. Затем процесс повторяется со следующим мыши.
Примечание: Программа отображает живой образ трансформируется рентгеновских изображений по умолчанию. Для отображения сырых рентгеновских снимков, удалите галочку рядом с рентгеновской абсорбции Исправления / Фильтрация инструментов. Когда рентгеновские данные были исправлены для поглощения, можно оценить относительную плотность костной ткани путем сравнения интенсивности сигнала измерения ROI. Интенсивность рентабельности возрастает с увеличением плотности ткани.
3. Изображение анализ ИВИС рентгеновского сканирования
- Открытое программное обеспечение с помощью двойного щелчка на значке Living.
- Нагрузка рентгеновское изображение, нажав кнопку Обзор. В появившемся диалоговом окне выберите папку, интересов и нажмите кнопку ОК. Браузер живой образ отображаются выбранные данные вместе с идентификатором пользователя, этикетки информацию, а также информацию конфигурации камеры. Чтобы открыть данные, выполните одно из следующих действий: Дважды щелкните строку данных, щелкните правой кнопкой мыши данных имя и выберите Нагрузка на контекстном меню выберите строку данных и нажмите на кнопку Загрузить, или дважды нажмите на миниатюру. Изображение и Палитра инструментов отображаются на дисплее. Открытые данные выделены зеленым цветом в браузере.
- Нажмите на Инструменты ROI в палитре инструментов. В ROI Сервис выберите Измерение ROI из раскрывающегося списка. Для загрузки 3 ROI используется в этом эксперименте, щелкните значок площади и нагрузки 3 квадратов.
- С помощью линейки, измерение длины бедренной кости. Отрегулируйте длину двух квадратов равной 1 / 8 от общей длины бедренной кости. Отрегулируйте положение этих двух квадратов быть 1/24th общая длина бедра. С вашим правителем, измерения 1 / 8 расстояния от проксимального конца бедренной кости, а расположить квадратные так, чтобы она сосредоточена в бедренной кости. Расположите второй квадрат так, что она лежит 1/4th от общей длины бедренной кости от дистального конца бедренной кости (рис. 3). Эти ROI может быть использован для измерения и проксимальных и дистальных отделах бедренной кости.
- Использование линейки, измерить длину голени. Отрегулируйте длину третий квадрат равной 1 / 8 от общей длины голени. Отрегулируйте до 1 / 30-го от общей длины голени. Размещайте квадратных так, в центре и 1 / 8-го общая длина голени расстояние от проксимального конца большеберцовой кости (см. Рисунок 3).
- Нажмите на иконку Мера (карандаша и линейки). Измерения ROI интенсивности появляются в рентгеновского изображения и таблицы измерения ROI появляется. Экспортировать эту таблицу то нужное место, как. CSV-файл. Это позволит вам открыть таблицу с помощью Excel.
- Повторите это со всеми сохраненных изображений.
- Консолидация всех данных на одном листе Excel. Статистическая значимость была определена с помощью студентов т-тест с использованием либо Microsoft Excel или SigmaPlot 11,0 программное обеспечение (Systat Software).
4. Посмертные анализа плотности костной ткани:
- После приобретения окончательной продольной рентгеновского сканирования в пределах ИВИС Lumina XR, мыши, впоследствии глубоко под наркозом с Beuthanasia (75 мг фенобарбитала / кг). После глубокого наркоза была достигнута, мышей transcardially перфузии с ледяной холодной фосфатном буферном растворе с heparain (40 мг / л), чтобы обескровить.
- После обескровлены, акцизов и бедер. Обратите особое внимание удалить как можно больше мягких тканей насколько это возможно, для этого было показано, что влияет на измерения плотности 11. Оберните бедра водой пропитанной марли и хранить при-20C пока вы не готовы для их анализа.
5. DXA Анализ использования Hologic QDR 4000 Кость денситометр
- Оттепель марлю пропитанные бедренных костей и костей передачи пакета денситометр.
- Калибровка устройства в соответствии с протоколом производителя; обеспечения BMC и БМД значений попадают в пределы допустимых пределах.
- Место латуни коллиматор в машине. Это позволяет пользователю ограничить размер и угол наклона рентгеновского пучка, чтобы сосредоточиться на конкретной цели.
- Погрузитесь талой бедренной кости в чашку Петри с водой (мыщелков налево, с бедро параллельно кровать), и положение это только, чтобы право лазера.
- Введите Биография (описательный заголовок, который включает в себя информацию животных выявление, лечение и т.д.) для бедренной кости, которую вы собираетесь сканировать.
- Введите Сканирование с Пункты меню, затем выберите regionA привет разрешением. Укажите ваши параметры сканирования: Сканирование области 2 х 0,7489 дюйма, с 0,01 дюйма межстрочный интервал и 0,00499 дюйм точки.
Примечание: Монитор сканирования пока он находится в прогрессе. Как рентгеновского пучка растровых сканирует образец, контролировать, чтобы обеспечить наличие достаточного количества воды в камере, чтобы полностью покрыть кости образца. - Введите анализ в меню выбора анализа. Следуйте инструкциям, чтобы выделить всю бедра, как ROI. Страница отчета будет придумать рассчитывается BMC (грамм) и МПК (г / см 2).
- Повторите эти действия для анализа оставшихся бедра.
- Консолидация всех данных на одном листе Excel и выполнить статистический анализ (Т-тест).
6. Представитель Результаты:
Относительная потеря плотности кости голени и бедра мыши после травмы спинного мозга, по сравнению с наивным мышей обнаруживается использованием указанного выше метода. Существует обнаружить значительное снижение плотности костной ткани послевсего за 10 дней (12%, р <0,0005), до 15% потери плотности костной ткани на 40 дней (р <0,0005, рисунок 4). Плотность костной ткани потери в бедренной кости наблюдался в 40 дней после травмы (7% меньше, р <0,05, рисунок 5). Эти результаты свидетельствуют о использовании неинвазивных рентгеновских изображений для продольного наблюдения изменения плотности кости после травмы спинного мозга.
Для того чтобы сравнить эффективность этого метода к тому, что в настоящее время, мы проанализировали вырезали бедра этих мышей через 40 дней после травмы использованием DXA изображений. Представление данных, выход может быть показано на рисунке 6. Мы обнаружили, что существует значительная потеря костной содержание минеральных веществ в SCI мышей по сравнению с наивным (12%-ное снижение, р <0,05, рисунок 7). Минеральной плотности костной ткани существенно не изменилось, но следовать аналогичной тенденции (рис. 8). Эти результаты аналогичны тем, которые встречаются в литературе; Пикара и др. наблюдается снижение на 13,5% (р <0,001) в BMC, но никаких существенных Отдела внешних церковных связейлегкость в МПК (Пикар 2008).
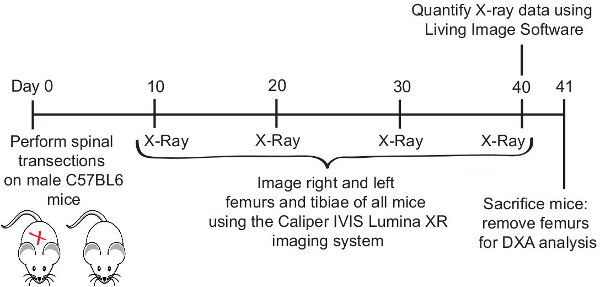
Рисунок 1. Экспериментальная Timeline.
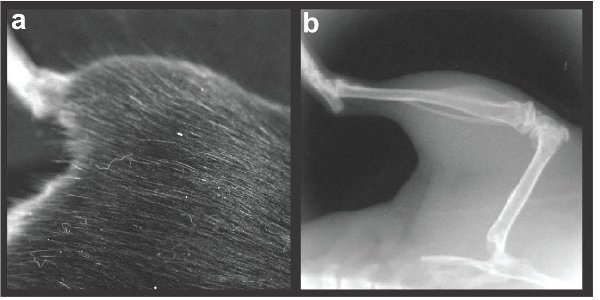
Рисунок 2 представителя ориентации левого задних конечностей.) Фотографию и б) рентген.
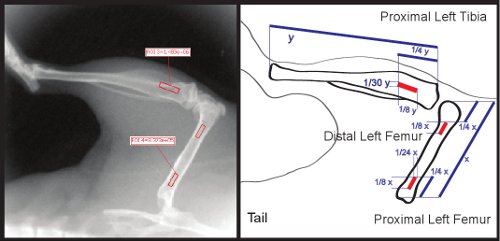
Рисунок 3. ROI размеров и ориентации в области проксимального отдела бедренной кости и голени.
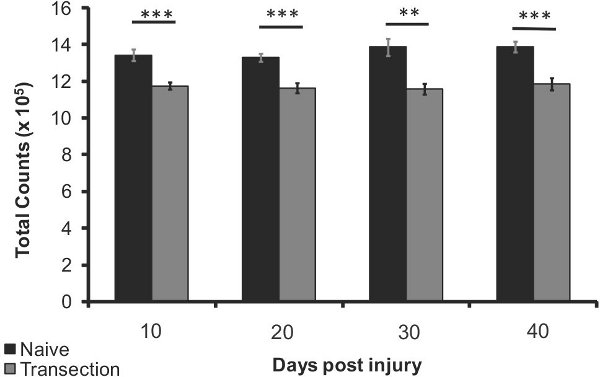
Рисунок 4. Потеря костной массы плотности после ТСМ в проксимальных голени 10, 20, 30 и 40 дней после травмы (п = 5) по сравнению с подобранных по возрасту naives (п = 5). Планки погрешностей представляют SEM, ** р <0,005, *** р <0,0005.
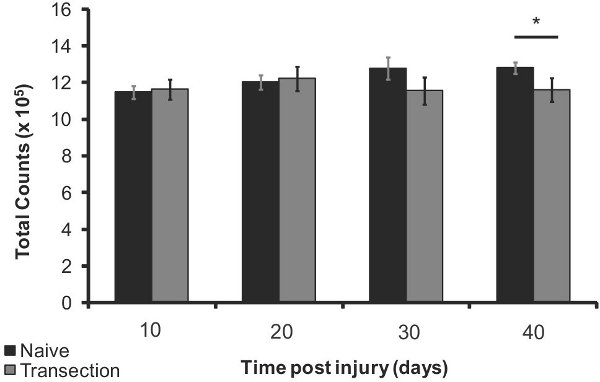
Рисунок 5. Плотность костной ткани потери после ТСМ в проксимального отдела бедренной кости 10, 20, 30 и 40 дней после травмы (п = 5) по сравнению с подобранных по возрасту naives (п = 5). Планки погрешностей представляют СЭМ; * р <0,05.
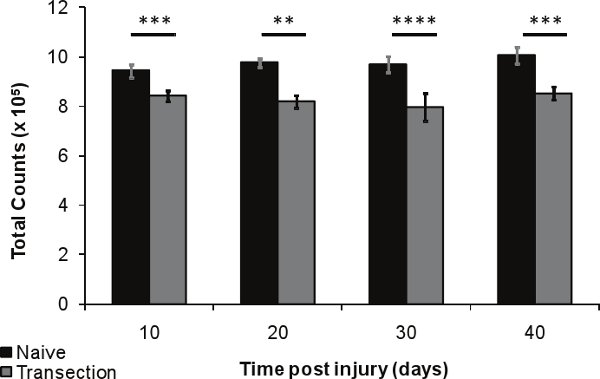
Рисунок 6. Плотность костной ткани потери после ТСМ в дистального отдела бедренной кости 10, 20, 30 и 40 дней после травмы (п = 5) по сравнению с подобранных по возрасту наивным управления (п = 5). Планки погрешностей представляют СЭМ; * р <0,01-0,05; ** р <0,001-0,01; *** р <0.0001-0.001; **** р <0,0001.
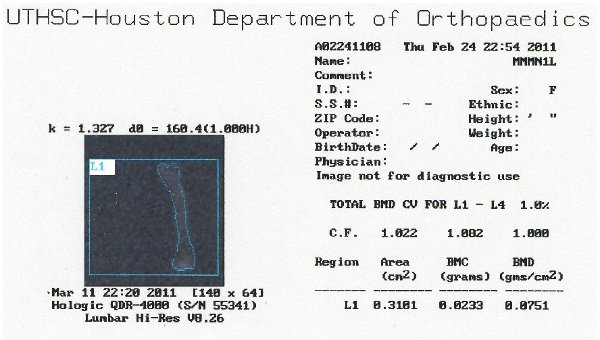
Рисунок 7. Представителю образ данным DXA показывает BMC и БМД выход.
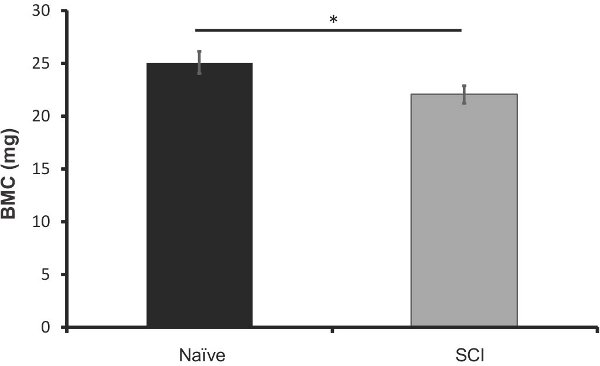
Рисунок 8. DXA анализ костной содержание минеральных веществ (в граммах) в бедренных костей мышей SCI 40 дней после травмы (п = 5) против ровесников из naives (п = 5).Планки погрешностей представляют СЭМ; * р <0,05.
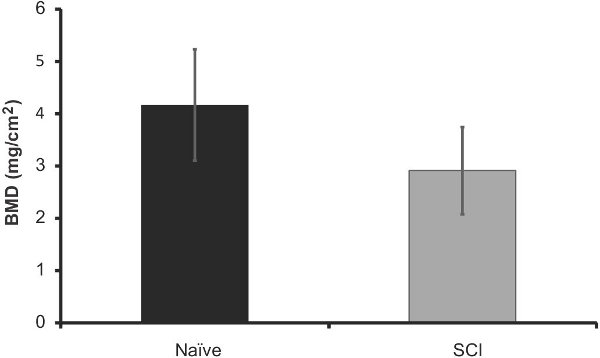
Рисунок 9. DXA анализ минеральной плотности костной ткани (мг / см 2) в бедренных костей мышей SCI 40 дней после травмы (п = 5) против ровесников из naives (п = 5). Планки погрешностей представляют SEM, нет существенной разницы.
Обсуждение
Это исследование представляет роман, неинвазивный метод оценки изменения плотности в пределах отдельных костей (голеней и бедер) продольно, в рамках одной когорты мышей, используя суппорт ИВИС Lumina XR визуализации системы. SCI производится снижение плотности костной ткани в обеих бедренных костей и голени когда учился в одной когорте spinally-перерезана мышей в течение 40 дней анализе период по сравнению с подобранных по возрасту, пострадал, контрольных мышей. Наши результаты в бедренной кости были подтверждены, посмертная, с помощью денситометрии, предполагая, что применение инструментов суппорт ИВИС Lumina XR может служить чувствительным инструментом измерения для оценки долгосрочных и прогрессивные последствия ТСМ на потерю костной массы .
Одним из потенциальных пользу следователей с использованием этой системы является возможность продольно следить за развитием патологических изменений в задних костей конечностей животных следующие ТСМ. Способность оценивать одну когорту в течение длительного периода времени обеспечивает йРонг преимущества следователя в отношении: 1) расходы, связанные с приобретением животных и долгосрочный уход. Вместо того, исследование требует большого количества животных, которые должны быть принесены в жертву в определенные моменты времени, чтобы оценить зависящие от времени изменения, эти патологические результаты могут последовать в пределах одной когорты за тот же период времени, 2) изменчивость: в дополнение к сравнению с контрольной когорты, результаты генерируется в одной когорте ранения предметы могут быть оценены и сопоставлены между временными точками для тех же животных на всем протяжении исследования, еще раз, что снижает как внутри-, изменчивость животных, а также необходимость для увеличения когорты испытуемых.
В то время как суппорт ИВИС Lumina XR предоставили нам важно продольной информацию о развитии SCI-индуцированного остеопороза, Есть ограничения, которые следует учитывать: 1) в то время как эта платформа позволяет нам генерировать высоким разрешением рентгеновской DATв задних костей конечностей мышей следующие SCI, его полезность, может быть ограничена мелких грызунов, таких как мыши. Максимальная высота предмета допускается в пределах Lumina XR составляет 2,8 см. Все, что выше этой высоты не может быть успешно отображаемого использованием рентгеновского компонента Lumina XR. В наших руках, это не позволило нашей способности к обучению крыс в 200-250 грамм веса. Хотя это может быть возможным изображение крысы под этот диапазон веса или других грызунов, таких как хомяки и песчанки, для этого потребуется дополнительное тестирование по ИП. 2) совместное ориентации. Очень важно, чтобы следователь тщательно организовать конечностей легко воспроизводимые ориентации, что позволит успешным сравнение изображений сессий. Стандартизация конечности размещение позволит следователю для создания и применения стандартизированных ROI, который можно сохранить и применять по обеим темам и времени.
В целом, мы считаем, что ИВИС Lumina XR обеспечивает отличную платформу, с которой для моделированияразвитие ТСМ-зависимых остеопороза у мышей. Способность к обучению потери костной массы продольно в пределах одной когорты мыши позволит: 1) лучше понять характер временной потере костной массы и деминерализации после ТСМ, 2) определить, являются ли эти изменения стабилизируются в течение долгого времени, 3) изучить совместно с наличием оба трансгенных и нулевых линий мышей, способность к обучению молекулярные механизмы лежащие в основе этих патологических изменений в редукционистской образом, и 4), вполне возможно, самое важное преимущество, начинают испытание новой меры, направленные на предотвращение либо развитие остеопороза на ранней стадии травмы, или, чтобы обратить вспять такие изменения, как только остеопороз уже развился. Наконец, Lumina XR, в дополнение к отличной рентгеновских изображений потенциал, также можно использовать для изучения как биолюминесцентного и флуоресцентные сигналы в живых животных. Можно легко представить себе, включающий других методов, предлагаемых в рамках этой системы, чтобы смотреть на мулtitude факторов, определяющих динамику кости механистически следующие SCI или любого другого патологического процесса, что приводит к остеопорозу.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы хотели бы поблагодарить и Миссия Connect и Gillson-Longenbaugh фонд для предоставления средств для этого проекта. Мы также хотели бы поблагодарить д-ра Кэтрин Амвросий для нее критические советы и использования ее оборудования DXA. Наконец, мы хотели бы поблагодарить д-ра Каори Оно, департамента интегративной биологии и фармакологии, за ее предложения в DXA анализ костей бедра.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
|---|---|---|---|
| Beuthanasia | Шейн Батлер животных Здоровье | 001848 | |
| Ketathesia (кетамин Гидрохлорид) | Шейн Батлер животных Здоровье | 023061 | |
| Ксилазин | Шейн Батлер животных Здоровье | 037849 | |
| Bupivicaine | Шейн Батлер животных Здоровье | 021801 | |
| Gelfoam; 7мм | Fisher Scientific | NC0085178 | Содействовать гемостаза при хирургия |
| ИВИС Lumina XR | Суппорт наук о жизни | 135400 | |
| ZFOV, 2,5 см области вид линз | Суппорт наук о жизни | 127285 | Абсолютно необходимым кгенерировать высокие увеличение рентгеновского изображения костей структура |
| QDR костей Денситометр | Hologic | Модель использована не в производстве |
Ссылки
- Jiang, S. D., Jiang, L. S., Dai, L. Y. Mechanisms of osteoporosis in spinal cord injury. Clin. Endocrinol. (Oxford). 65, 555-565 (2006).
- Uebelhart, D., Demiaux-Domenech, B., Roth, M., Chantraine, A. Bone metabolism in spinal cord injured individuals and in others who have prolonged immobilisation. A review. Paraplegia. 33, 669-673 (1995).
- Elefteriou, F. Neuronal signaling and the regulation of bone remodeling. Cell. Mol. Life. Sci. 62, 2339-2349 (2005).
- Finsen, V., Indredavik, B., Fougner, K. J. Bone mineral and hormone status in paraplegics. Paraplegia. 30, 343-347 (1992).
- Sugawara, H., Linsenmeyer, T. A., Beam, H., Parsons, J. R. Mechanical properties of bone in a paraplegic rat model. J. Spinal. Cord. Med. 21, 302-308 (1998).
- Kiratli, B. J., Smith, A. E., Nauenberg, T., Kallfelz, C. F., Perkash, I. Bone mineral and geometric changes through the femur with immobilization due to spinal cord injury. J. Rehabil. Res. Dev. 37, 225-233 (2000).
- Shen, J., Fan, L., Yang, J., Shen, A. G., Hu, J. M. A longitudinal Raman microspectroscopic study of osteoporosis induced by spinal cord injury. Osteoporos. Int. 21, 81-87 (2010).
- Guertin, P. A. A technological platform to optimize combinatorial treatment design and discovery for chronic spinal cord injury. J. Neurosci. Res. 86, 3039-3051 (2008).
- Picard, S., Lapointe, N. P., Brown, J. P., Guertin, P. A. Histomorphometric and densitometric changes in the femora of spinal cord transected mice. Anat. Rec. (Hoboken). 291, 303-307 (2008).
- Kuhn, P. L., Wrathall, J. R. A mouse model of graded contusive spinal cord injury. J. Neurotrauma. 15, 125-140 (1998).
- Tsujio, M. mineral analysis through dual energy X-ray absorptiometry in laboratory animals. J. Vet. Med. Sci. 71, 1493-1497 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены