Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La visualización de Caenorhabditis Elegans Estructuras de la cutícula uso del colorante lipofílico Vital, DII
En este artículo
Resumen
Se presenta un método para visualizar la cutícula en vivo C. elegans Con el fluorescente de color rojo lipofílico DII colorante (1,1 '-dioctadecil-3, 3,3', 3'-tetramethylindocarbocyanine perclorato), que se utiliza comúnmente en C. elegans Para visualizar las neuronas el medio ambiente expuestos. Con este protocolo optimizado, las estructuras de alas y de anular la cutícula están manchadas por el DII y observó mediante microscopía de compuesto.
Resumen
La cutícula de la C. elegans es una estructura muy resistente que rodea el exterior del animal 1-4. La cutícula no sólo protege al animal del medio ambiente, sino que también determina la forma del cuerpo y juega un papel en la motilidad 4-6. Varias capas secretada por las células epidérmicas forman la cutícula, que incluye una capa lipídica externa 7.
Crestas circunferenciales en la cutícula del llamado patrón de anillos de la longitud del animal, y están presentes en todas las etapas de desarrollo 8. Las alas son crestas longitudinales que están presentes durante las etapas específicas del desarrollo, incluyendo L1, Dauer, y adulto 2,9. Las mutaciones en los genes que afectan a la organización del colágeno cuticular puede alterar la estructura de la cutícula y la morfología corporal del animal 5,6,10,11. Mientras que imágenes cuticular mediante microscopía óptica compuesto con DIC es posible, métodos actuales que ponen de relieve las estructuras cuticulares son fluorescentesciento de expresión del transgen 12, la tinción de anticuerpos 13, y la microscopía electrónica 1. Etiquetados aglutinina de germen de trigo (WGA) también se ha utilizado para visualizar las glicoproteínas cuticular, pero está limitado en la resolución de las estructuras más finas cuticular 14. Tinción de la superficie de la cutícula con un tinte fluorescente se ha observado, pero nunca caracterizado en detalle 15. Se presenta un método para visualizar la cutícula en vivo C. elegans con el fluorescente de color rojo lipofílico DII colorante (1,1 '-dioctadecil-3, 3,3', 3'-tetramethylindocarbocyanine perclorato), que se utiliza comúnmente en C. elegans para visualizar las neuronas el medio ambiente expuestos. Este protocolo optimizado para la tinción de Dii es un método simple y robusto para la visualización de alta resolución de anillos fluorescentes, las alas, la vulva, la cola masculina, y hermafroditas cola aumento en C. elegans.
Protocolo
1. Preparación de DII mancha
- Prepare una solución stock de 20 mg / ml DII (Biotium, Inc., Hayward, CA) en DMF. Dii es sensible a la luz, así que proteja DII de la luz, envolviendo en papel de aluminio.
- Crear una dilución de trabajo de DII mediante la adición de 0,6 l de valores DII a 399,4 l M9 para cada población. Esto debería dar una dilución final de trabajo de 30 mg / ml en DII M9. Esto puede ser ampliado para la tinción de las poblaciones simultáneamente. Escudo de DII de la luz, envolviendo el tubo (s) en papel de aluminio.
2. Preparación de los nematodos
- Use una placa de 60 mm con una población de nematodos no contaminada. Lavado de los animales de la placa con una solución de 0,5% Triton X-100 en tampón M9 girando suavemente un líquido en un movimiento circular a través de la superficie de la placa para aflojar todos los animales adultos y larvas. Transferencia de lavado en un tubo estéril de 1,5 ml.
- Inmediatamente de girar a los animales a 2000 rpm durante 30 segundos. Retire y deseche lo más apoyoernatant como sea posible sin afectar la masa de los animales en la parte inferior del tubo.
- Para reducir el residual Triton X-100, enjuague con animales buffer M9, girar y retirar el sobrenadante. Repita este paso una vez.
- Añadir 400 l de solución de trabajo de DII en M9 en el tubo y agitar brevemente para volver a suspender los animales en la solución.
- Agite el tubo a 20 ° C horizontalmente durante 3 horas a 350 rpm en un ambiente protegido de la luz. Si lo desea, los animales se pueden incubar hasta 16 horas para la tinción.
- Para reducir la cantidad de colorante no consolidados, la desaceleración de los animales a 2000 rpm durante 20 segundos. Retire y deseche tanto sobrenadante como sea posible sin afectar la masa de los animales.
- Animales Resuspender en 400 l buffer M9 y vierta el líquido en una porción libre de bacterias de una placa de agar NGM sembrado con OP50 E. coli. Que los animales puedan recuperar por lo menos 30 minutos. Durante el tiempo de recuperación de los animales deben arrastrarse lejos del líquido y tinción de DII sobre los alimentos. Este pasoreduce la fluorescencia de fondo de la DII gratuita.
3. Montaje y la observación de muestras
- Derrita 4% de agar en agua usando un autoclave o un horno de microondas.
- Cree separadores reutilizables, que pueden ser utilizados para asegurar un espesor uniforme de la almohadilla de agar, por capas de dos trozos de cinta de laboratorio sobre un portaobjetos de vidrio. Haga dos diapositivas espaciador total.
- Organizar un portaobjetos de vidrio limpio entre dos diapositivas espaciador. Pipeta de unos 150 l (cuatro gotas) de agar fundido al 4% en el centro del portaobjetos de vidrio limpio. Cubrir rápidamente el agar fundido con un carro adicional para formar una plataforma de agar. Retire con cuidado la tapa deslizante, manteniendo la plataforma centrada en la parte superior de la diapositiva de montaje.
- Pipeta de 5 L de nematodos anestesia (100 mM - 1 mM levamisol, por ejemplo) en la almohadilla.
- Monte 8 a 12 animales de la anestesia y se cubre con un cubreobjetos microscopio.
- Observar a los animales utilizando un microscopio confocal compuesto o equipados con al menos un obje 40x ve y DsRed / TRITC (o compatible) del filtro. El máximo de excitación de fluorescencia de 549 nm es DII y de sus máximos de emisión es 565 nm para el tinte obligado (Biotium, Inc., Hayward, CA).
4. Resultados representante
Manchas de DII de la cutícula de tipo salvaje y mutante C. elegans. La superficie cuticular contiene anillos separados por surcos circunferenciales y, en algunas etapas, crestas longitudinales llamadas alas. Cada etapa de desarrollo tiene estructuras cuticulares con composiciones distintas 2. Crestas o surcos de ambas alas y anillos con fluorescencia manchas, dependiendo de la composición de la superficie, a lo largo de las etapas de larva y adulto y permanecen visibles hasta un día después de la recuperación utilizando este método. Manchas de fondo fluorescentes a veces se observa (Figuras 2F, G), pero no de forma rutinaria (Figura 1, Figura 2A-E, H, I). Todas las imágenes fueron tomadas con disco giratorio confocal o, cuando así se indique, de campo amplio (WF) microscopio compuesto.
ent ">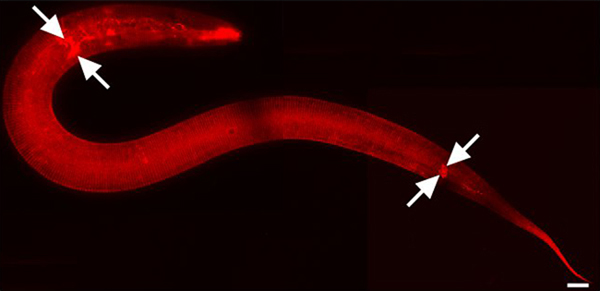
Figura 1. DII manchas de la cutícula y el medio ambiente neuronas expuestas. L2 animal escénico. Ampliación de 630x. Piezas del mosaico de la imagen fueron capturados utilizando iVision Mac-software (Tecnologías de BioVision, Exton, PA). Las imágenes se unieron usando Adobe Photoshop CS3 (Adobe Systems, Inc., San Jose, CA). Barra de escala = 10 micras. Dii también con fluorescencia manchas amphid y fásmido neuronas sensoriales de la cabeza y la cola, respectivamente (flechas indican algunos).
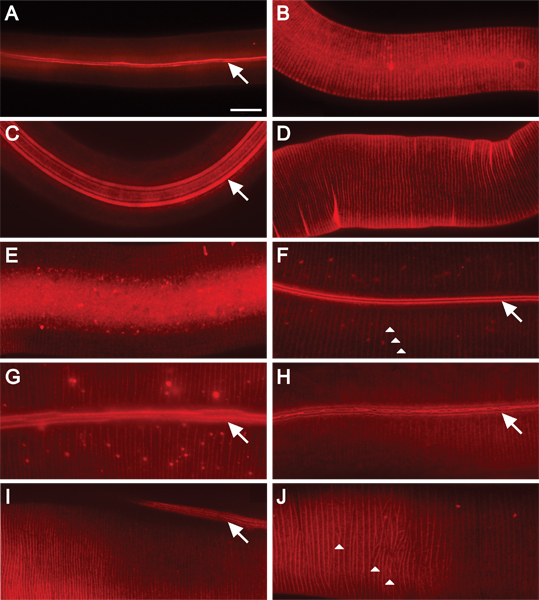
Figura 2. DII fluorescencia manchas C. elegans cutícula en todas las etapas de post-desarrollo embrionario. Ampliación de 630x. Barra de escala = 10 micras. Tinción de animales salvajes en una L1), B) L2; C) Dauer, D) L3; E) L4, y F) en fase adulta. Las crestas de las alas y anulares son teñidas con fluorescencia en los animales L1 y Dauer (A, C). DII manchas dorsales anular en los animales L2(B). Anular surcos mancha en L3 y L4 animales (D, E). Los surcos de las alas y anillos se tiñen en los animales adultos (FH). Alas están compuestas de dos, cinco, o tres crestas (en L1, Dauer, o los animales adultos, respectivamente) que corren a lo largo del animal (flechas) 16. Anillos crear crestas circunferencial alrededor del animal (puntas de flecha, F y J). La cutícula de vacuno mutante pantalla moderada defectos de organización cuticular (GH). G) Las crestas de las alas son discontinuos (WF). H) crestas supernumerarios alas se fusionan y ramificados o bifurcados (WF). Mutantes del gen del colágeno muestran alas y defectos anulares organización (IJ). I) En los animales transgénicos que sobreexpresan pRF4 (rol-6 (su1006)), los cantos de la mentira de las alas en un ángulo a la longitud del animal. J) anillos de transgénicos que sobreexpresan pRF4 animales (rol-6 (su1006)) muestra un patrón irregular.
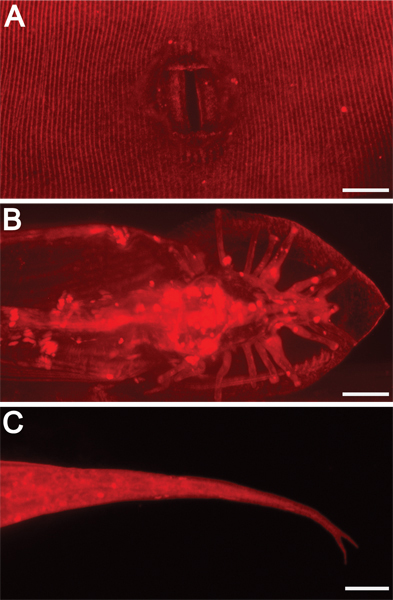
Figura 3. Externoestructuras morfológicas al son iluminadas por tinción DII. magnificación 630x. Las barras de escala = 10 micras. Dii también destaca otras características exteriores, incluyendo A) adulto hermafrodita vulva, B) los rayos de la cola masculina adulta y el ventilador, y C) hermafroditas cola pico (bífida en este contexto mutante).
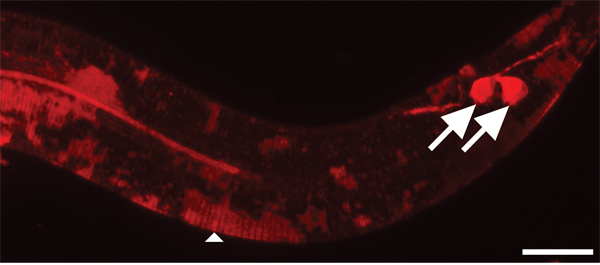
Cutícula la figura 4. Tarda más tiempo en la mancha con DII que las neuronas del medio ambiente expuestos. Ampliación de 630x. Barra de escala = 10 micras. Después de dos horas de tinción, amphid (no mostrado) y fásmido las neuronas sensoriales (flechas) son lo suficientemente manchado. Por el contrario, la cutícula de los animales más jóvenes es sólo parcialmente manchada en parches (cabeza de flecha).
| Lavar | Solución de tinción (+ DII) | Tiempo de incubación | Cutícula teñida |
| M9 + 0,5% TrIton X-100 | M9 + 0,5% Triton X-100 | 2 horas | no |
| M9 + 0,5% Triton X-100 | M9 + 0,5% Triton X-100 | 3 horas | no |
| M9 + 0,5% Triton X-100 | M9 | 2 horas | parcial |
| M9 + 0,5% Triton X-100 | M9 | 3 horas | sí |
| M9 + 0,5% Triton X-100 | H 2 0 | 2 horas | parcial |
| M9 + 0,5% Triton X-100 | H 2 0 | 3 horas | sí |
Tabla 1. Tinción de la cutícula en diferentes condiciones. Varias soluciones de incubación y los tiempos fueron probadas para optimizar tinción cuticular en los animales. H 2 0, agua destilada estéril. Coloración parcial indica manchas irregulares de la cutícula larval (Figura 4), a pesar de las manchas de adultos cutícula consistently.
Discusión
El método de tinción DII que aquí se presenta permite una manera relativamente rápida y conveniente de visualizar la cutícula en C. elegans. Por reutilización y optimización de un método comúnmente utilizado para la imagen del medio ambiente expuestos neuronas sensoriales 15,17, DII puede ser utilizado para teñir con fluorescencia tanto alas y estructuras anulares (Figuras 1 y 2), así como la vulva, la cola masculina, y hermafroditas cola pico (Figura 3). Hemos encontrado que la solución ...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Queremos agradecer a S. Taneja-Bageshwar, Beifuss K., S. Kedroske y HC. Hsiao útil para los debates. Este trabajo fue financiado por la puesta en marcha de los fondos del Departamento TAMHSC de Medicina Molecular y Celular. El alcance compuesto y disco giratorio fueron comprados con fondos aportados por el departamento y la Oficina TAMHSC del Decano. Algunas cepas fueron proporcionados por el Centro de Genética Caenorhabditis, que es financiado por el Centro Nacional para Recursos de Investigación. pRF4 (rol-6 (su1006)) fue un regalo de fuego A..
Materiales
| Name | Company | Catalog Number | Comments | |
| Reactivos | Sinónimos | Empresa | Número de catálogo | Comentarios |
| Dii | 1,1 '-dioctadecil-3, 3,3', 3'-tetramethylindocarbocyanine perclorato | Biotium, Inc. | 60010 | Archivo de dilución: 20 mg / mL de DMF dilución de trabajo: 30 mg / ml |
| DMF | Dimetilformamida | Sigma-Aldrich, Inc. | D4551 | |
| Tritón X-100 | Octylphenoxypolyethoxyethanol | VWR International, LLC. | EM-9410 | |
| M9 | 22mm KH 2 PO 4, 42 mm de Na 2 HPO 4, 86 mm NaCl, 1 mM MgSO 4 | |||
| NGM | Nematodo medio de crecimiento | IPM Scientific, Inc. | 11006-501 | Se pueden preparar según el protocolo de NGM agar 18 |
| Agar agar | EMD Chemicals, Inc. | 1,01614 | 4% en agua | |
| Levamisol | Levamisol clorhidrato | Sigma-Aldrich, Inc. | 31742 | 100 mM - 1 mM levamisol como lo requiere |
| Portaobjetos de microscopio | VWR International, LLC. | 16005-106 | ||
| Gafas microscopio cubrir | VWR International, LLC. | 16004-302 | ||
| Compuesto alcance | Carl Zeiss, Inc. | A1m | Utilice los objetivos para satisfacer las necesidades del experimento | |
| Filtro TRITC compatible u otro | Ynbsp; | Chroma Technology Corp. | 49005 | ET - DsRed (TRITC/Cy3) farfulló conjunto de filtros |
Referencias
- Cox, G. N., Kusch, M., Edgar, R. S. Cuticle of Caenorhabditis elegans: its isolation and partial characterization. The Journal of Cell Biology. 90, 7-17 (1981).
- Cox, G. N., Staprans, S., Edgar, R. S. The cuticle of Caenorhabditis elegans. II. Stage-specific changes in ultrastructure and protein composition during postembryonic development. Dev. Biol. 86, 456-470 (1981).
- Hall, D., Altun, Z. . C. elegans Atlas. , (2008).
- Page, A. P., Johnstone, I. L. The cuticle. The C. elegans Research Community. , (2007).
- Kramer, J. M., Johnson, J. J., Edgar, R. S., Basch, C., Roberts, S. The sqt-1 gene of C. elegans encodes a collagen critical for organismal morphogenesis. Cell. 55, 555-565 (1988).
- Mende, N. v. o. n., Bird, D. M., Albert, P. S., Riddle, D. L. dpy-13: a nematode collagen gene that affects body shape. Cell. 55, 567-576 (1988).
- Blaxter, M. L. Cuticle surface proteins of wild type and mutant Caenorhabditis elegans. The Journal of Biological Chemistry. 268, 6600-6609 (1993).
- Costa, M., Draper, B. W., Priess, J. R. The role of actin filaments in patterning the Caenorhabditis elegans cuticle. Dev. Biol. 184, 373-384 (1997).
- Sapio, M. R., Hilliard, M. A., Cermola, M., Favre, R., Bazzicalupo, P. The Zona Pellucida domain containing proteins, CUT-1, CUT-3 and CUT-5, play essential roles in the development of the larval alae in Caenorhabditis elegans. Dev. Biol.. 282, 231-245 (2005).
- Johnstone, I. L. Cuticle collagen genes. Expression in Caenorhabditis elegans. Trends Genet. 16, 21-27 (2000).
- Kramer, J. M., French, R. P., Park, E. C., Johnson, J. J. The Caenorhabditis elegans rol-6 gene, which interacts with the sqt-1 collagen gene to determine organismal morphology, encodes a collagen. Mol. Cell Biol. 10, 2081-2089 (1990).
- Thein, M. C. Caenorhabditis elegans exoskeleton collagen COL-19: an adult-specific marker for collagen modification and assembly, and the analysis of organismal morphology. Dev. Dyn. 226, 523-539 (2003).
- McMahon, L., Muriel, J. M., Roberts, B., Quinn, M., Johnstone, I. L. Two sets of interacting collagens form functionally distinct substructures within a Caenorhabditis elegans extracellular matrix. Molecular Biology of the Cell. 14, 1366-1378 (2003).
- Link, C. D., Ehrenfels, C. W., Wood, W. B. Mutant expression of male copulatory bursa surface markers in Caenorhabditis elegans. Development. 103, 485-495 (1988).
- Tong, Y. G., Burglin, T. R. Conditions for dye-filling of sensory neurons in Caenorhabditis elegans. J. Neurosci. Methods. 188, 58-61 (2010).
- Singh, R. N., Sulston, J. E. Some observations on moulting in Caenorhabditis elegans. Nematologica. 24, 63-71 (1978).
- Collet, J., Spike, C. A., Lundquist, E. A., Shaw, J. E., Herman, R. K. Analysis of osm-6, a gene that affects sensory cilium structure and sensory neuron function in Caenorhabditis elegans. Genetics. 148, 187-200 (1998).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados