Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Визуализация Caenorhabditis Elegans Кутикулы структур с помощью липофильных Vital краска, DII
В этой статье
Резюме
Мы представляем способ визуализировать кутикулы в прямом эфире С. Элеганс Использование красного флуоресцентного красителя липофильных DII (1,1 '-dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine перхлорат), который обычно используется в С. Элеганс, Чтобы визуализировать экологически подвергаются нейроны. С этой оптимизированный протокол, крылья и кольцевых кутикулярных структур окрашиваются по DII и наблюдать с помощью соединения микроскопии.
Аннотация
Кутикула C. Элеганс имеет высокую устойчивость структуры, которая окружает внешности животного 1-4. Кутикула не только защищает животное от окружающей среды, но и определяет форму тела и играет роль в подвижности 4-6. Несколько слоев выделяемый клетками эпидермиса составляют кутикулы, в том числе внешний липидный слой 7.
Окружная хребтов в кутикулу называется узор кольца длиной животных и присутствуют на всех этапах развития 8. Крылья являются продольные гребни, которые присутствуют во время определенных стадий развития, в том числе L1, Dauer, и взрослых этапах 2,9. Мутации в генах, которые влияют на кутикулярной организации коллаген может изменить кутикулярные структуры и морфологии тела животного 5,6,10,11. Хотя кутикулярной визуализации с использованием соединения микроскопии с ДВС оптики возможно, нынешние методы, которые подчеркивают кутикулярные структуры включают флуоресценциипроцента экспрессии трансгена 12, антитела окрашивания 13 и электронной микроскопии 1. Маркированный агглютинин зародышей пшеницы (WGA) была также использована для визуализации кутикулярной гликопротеины, но ограничен в решении тонких кутикулярных структур 14. Окрашивание кутикулярной поверхности с помощью флуоресцентного красителя наблюдается, но никогда не характеризуется подробно 15. Мы представляем способ визуализировать кутикулы в живых C. Элеганс использованием красного флуоресцентного красителя липофильных DII (1,1 '-dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine перхлорат), который обычно используется в C. Элеганс визуализировать экологически подвергаются нейроны. Этот оптимизированный протокол для окрашивания DII это простой, надежный метод с высоким разрешением флуоресцентные визуализации кольца, крылья, вульвы, мужского хвост, и гермафродитом хвоста всплеск C. Элеганс.
протокол
1. Подготовка DII пятно
- Подготовка исходного раствора 20 мг / мл DII (Biotium, Inc, Hayward, CA) в ДМФ. DII является светочувствительным, поэтому защитить DII от света, завернув в фольгу.
- Создать рабочую разбавления DII путем добавления 0,6 мкл фондовом DII на 399,4 мкл M9 для каждой группы населения. Это должно дать окончательный рабочий разбавления 30 мкг / мл в DII M9. Это может быть расширены для окрашивания нескольких популяций одновременно. Щит DII от света, окружив трубу (ы) в фольге.
2. Подготовка нематоды
- Используйте 60 мм пластины, содержащей населения незагрязненных нематод. Мыть животных из пластины с помощью раствора 0,5% Тритон Х-100 в буфере M9, осторожно закрученной жидкости в круговом движении по поверхности пластины, чтобы ослабить всех личинок и взрослых животных. Передача мыть в стерильный 1,5 мл трубки.
- Сразу же спином вниз животных при 2000 оборотов в минуту в течение 30 сек. Удаляют столько вирernatant возможно, не нарушая массу животных в нижней части трубы.
- Для уменьшения остаточной Тритон Х-100, промыть животных с использованием буфера M9, спина, и удалить супернатант. Повторите этот шаг один раз.
- Добавить 400 мкл рабочего раствора в DII M9 к трубке и вихревые кратко ресуспендирования животных в растворе.
- Встряхните трубки при 20 ° С горизонтально в течение 3 часов при 350 оборотов в минуту в защищенном от света окружающей среды. При желании, животные могут быть инкубировали до 16 часов для окрашивания.
- Чтобы уменьшить количество несвязанного красителя, замедления вращения животных при 2000 оборотов в минуту в течение 20 сек. Удаляют супернатант столько насколько это возможно без нарушения массы животных.
- Ресуспендируют животных в 400 мкл буфера M9 и налить жидкость на бактерии свободную часть NGM пластины агара с присадками OP50 Е. палочки. Разрешить животных для восстановления не менее 30 минут. Во время восстановления животные должны отползти от жидкого окрашивания DII и на еду. Этот шагснижает фоновой флуоресценции от свободных DII.
3. Монтаж и наблюдения образцов
- Растопите 4% агара в воде с использованием автоклава или микроволновой печи.
- Создание многократно прокладками, которые могут быть использованы для обеспечения равномерной толщины агара площадку, отводками две части лаборатории ленту на стекле. Сделайте два слайда Spacer общего количества.
- Упорядочить чистой предметное стекло между двумя предметными стеклами распорки. Внесите около 150 мкл (четыре капли) расплавленного 4% агар на центр чистой предметное стекло. Быстрое покрытие расплавленного агара использованием дополнительных слайда к форме агара площадку. Аккуратно снимите крышку слайд, сохраняя площадку по центру верхней части установки слайда.
- Внесите около 5 мкл нематоды анестезии (100 мкМ - 1 мм левамизол, например) на площадку.
- Горы 8 - 12 животных в анестезии и накройте покровным микроскопом.
- Соблюдайте животных с использованием соединения или конфокальной микроскопии снабжены по меньшей мере 40x объективации ве и DsRed / TRITC (или другой совместимый) фильтр. Максимумом флуоресценции возбуждения DII составляет 549 нм, а его максимум излучения составляет 565 нм для связанных красителя (Biotium, Inc, Hayward, CA).
4. Представитель Результаты
DII пятна кутикулы дикого типа и мутантных C. Элеганс. Кутикулярной поверхности содержит кольца, разделенных окружной борозды, а в несколько этапов, продольными ребрышками называемые крылья. Каждая стадия развития имеет кутикулярных структур с различными композициями 2. Хребты или борозд обоих крыльев и колец флуоресцентно пятно, в зависимости от состава поверхности, на протяжении личиночной и взрослой стадиях и остаются видимыми до дня после выздоровления с помощью этого метода. Фон флуоресцентные крапинками иногда наблюдаются (рис. 2F, G), но не регулярно (рис. 1, рис 2A-E, H, I). Все изображения были сделаны с помощью вращающегося диска конфокальной или, если отмечено, широкопольных (WF) соединения микроскопии.
ЛОР ">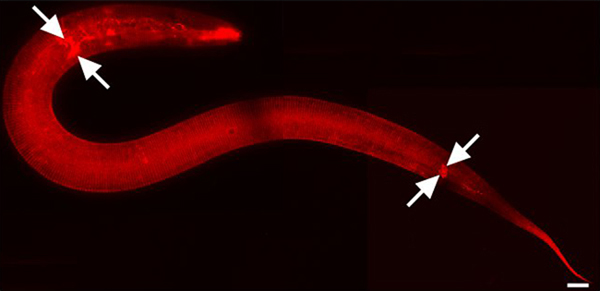
Рисунок 1. DII пятна кутикулы и экологически подвергаются нейроны. L2 стадии животное. 630x увеличением. Части мозаики изображения были получены с помощью iVision-Mac программное обеспечение (BioVision технологий, Экстон, Пенсильвания). Изображения были соединяются при помощи Adobe Photoshop CS3 (Adobe Systems, Inc, Сан-Хосе, Калифорния). Шкала бар = 10 мкм. DII также флуоресцентно пятна амфидов и фазмида сенсорных нейронов в голове и хвосте соответственно (Стрелками отмечены некоторые).
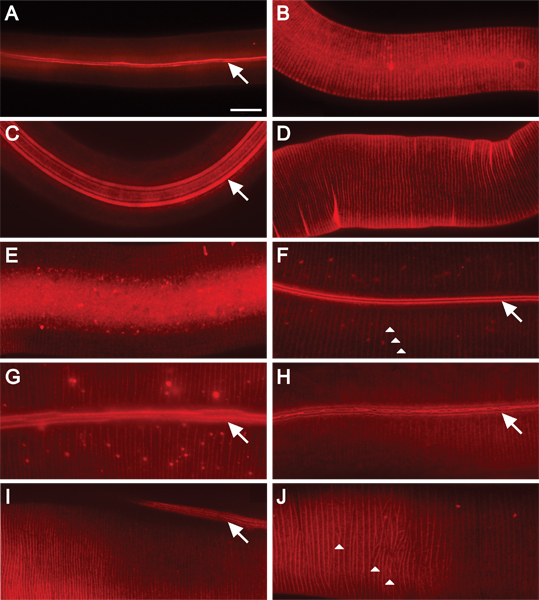
Рисунок 2. DII флуоресцентно пятна C. Элеганс кутикулу на всех этапах пост-эмбрионального развития. 630x увеличением. Шкала бар = 10 мкм. Окраска животных дикого типа в) L1, B) L2, C) Dauer; D) L3, E) L4, и F) взрослого этапа. Крылья и кольцевых хребтов флуоресцентно окрашенных в L1 и Dauer животных (A, C). DII пятна кольцевых хребтов у животных L2(B). Кольцевые борозды пятном в L3 и L4 животных (D, E). Борозды крылья и колец окрашиваются у взрослых животных (FH). Крылья состоят из двух, пяти или трех хребтов (в L1, Dauer или взрослых животных, соответственно), которые выполняются длина животного (стрелки) 16. Кольца создать окружные хребты вокруг животного (наконечники стрел, F и J). Кутикула взрослых животных мутантов дисплей умеренной кутикулярной дефекты организации (GH). G) Хребты крылья являются разрывными (WF). H), внештатный хребтов крылья слиты и разветвленных или раздвоенные (WF). Коллаген мутантов ген выставки крылья и кольцевые дефекты организации (IJ). I) В трансгенных животных гиперэкспрессией pRF4 (РОЛ-6 (su1006)), хребты крылья лежат под углом к длине животного. J) кольца в трансгенных животных гиперэкспрессией pRF4 (РОЛ-6 (su1006)) дисплей нерегулярный узор.
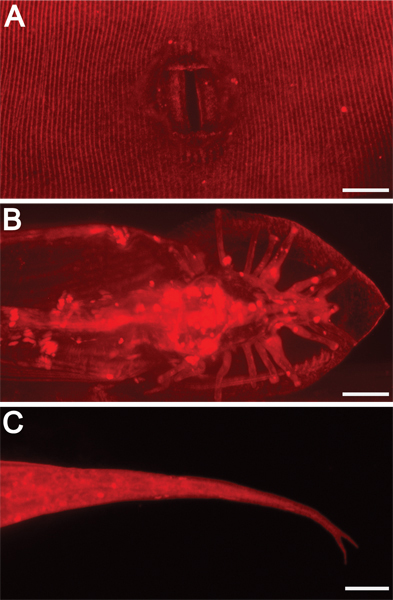
Рисунок 3. Внешнийдр. морфологических структур освещены окрашивания DII. 630x увеличением. Шкала баров = 10 мкм. DII также выделяет другие внешние особенности, в том числе) взрослый гермафродит вульвы, В), взрослый мужчина лучи хвоста и вентилятора, В и С) гермафродит хвостом шип (раздвоенный в этом мутант фоне).
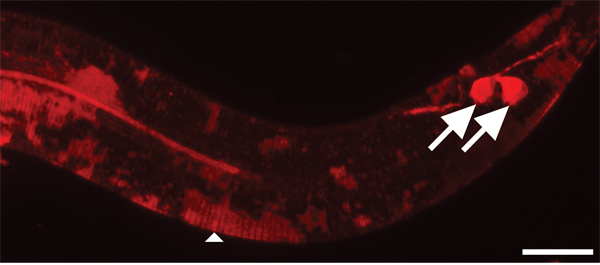
Рисунок 4. Кутикулы занимает больше времени, чтобы пятно DII, чем экологически подвергаются нейроны. 630x увеличением. Шкала бар = 10 мкм. После двух часов окрашивания, амфидов (не показано) и фазмида сенсорных нейронов (стрелки) достаточно витражи. В отличие от кутикулы молодых животных лишь частично окрашенные в патчей (стрелки).
| Мыть | Пятно решение (+ DII) | Время инкубации | Кутикулы окрашенных |
| M9 + 0,5% ТрИтон X-100 | M9 + 0,5% Тритон Х-100 | 2 часа | нет |
| M9 + 0,5% Тритон Х-100 | M9 + 0,5% Тритон Х-100 | 3 часа | нет |
| M9 + 0,5% Тритон Х-100 | M9 | 2 часа | частичный |
| M9 + 0,5% Тритон Х-100 | M9 | 3 часа | да |
| M9 + 0,5% Тритон Х-100 | H 2 0 | 2 часа | частичный |
| M9 + 0,5% Тритон Х-100 | H 2 0 | 3 часа | да |
Таблица 1. Кутикулы окрашивания в различных условиях. Различные решения инкубации и времена были протестированы для оптимизации кутикулярной окрашивания у животных. H 2 0, стерильной дистиллированной водой. Частичное окрашивание указывает неоднородное окрашивание кутикулы личиночной (рис. 4), хотя взрослые пятна кутикулы сonsistently.
Обсуждение
Метод окрашивания DII, представленные здесь позволяет сравнительно быстрый и удобный способ визуализации кутикулы на C. Элеганс. По повторное использование и оптимизации методов, обычно используемых для изображения подвергаются экологически чувствительных нейронов 15,17, DII м...
Раскрытие информации
Нам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить С. Taneja-Bageshwar, К. Beifuss, С. Kedroske и HC. Сяо за полезные обсуждения. Эта работа финансировалась запуска средства из TAMHSC Отдел молекулярной и клеточной медицины. Сферу соединения и вращающийся диск были приобретены на средства, предоставленные отделом и TAMHSC Управления Дина. Некоторые штаммы были предоставлены Caenorhabditis генетический центр, который финансируется Национальным центром по исследованию ресурсов. pRF4 (РОЛ-6 (su1006)) был дар пожарной А..
Материалы
| Name | Company | Catalog Number | Comments | |
| Реагенты | Синонимы | Компания | Номер по каталогу | Комментарии |
| DII | 1,1 '-Dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine перхлората | Biotium, Inc | 60010 | Сток разбавления: 20 мг / мл в ДМФА Рабочее разведение: 30 мг / мл |
| DMF | Диметилформамид | Sigma-Aldrich, Inc | D4551 | |
| Тритон X-100 | Octylphenoxypolyethoxyethanol | VWR International, LLC. | ЭМ-9410 | |
| M9 | 22 мм KH 2 PO 4, 42мм Na 2 HPO 4, 86 мм NaCl, 1 мМ MgSO 4 | |||
| NGM | Средний рост нематода | ИПМ Научные, Inc | 11006-501 | Может быть подготовлены следующие NGM агар протокол 18 |
| Агар-агар | EMD Chemicals, Inc | 1,01614 | 4% в воде | |
| Левамизол | Левамизол гидрохлорид | Sigma-Aldrich, Inc | 31742 | 100 мкМ - 1 мм левамизол по мере необходимости |
| Микроскоп слайды | VWR International, LLC. | 16005-106 | ||
| Стекла микроскопа крышкой | VWR International, LLC. | 16004-302 | ||
| Соединение рамки | Carl Zeiss, Inc | A1M | Используйте цели, чтобы соответствовать потребностям эксперимент | |
| TRITC или других совместимых фильтров |   | Chroma технологий корпорации | 49005 | ET - DsRed (TRITC/Cy3) распыленных набор фильтров |
Ссылки
- Cox, G. N., Kusch, M., Edgar, R. S. Cuticle of Caenorhabditis elegans: its isolation and partial characterization. The Journal of Cell Biology. 90, 7-17 (1981).
- Cox, G. N., Staprans, S., Edgar, R. S. The cuticle of Caenorhabditis elegans. II. Stage-specific changes in ultrastructure and protein composition during postembryonic development. Dev. Biol. 86, 456-470 (1981).
- Hall, D., Altun, Z. . C. elegans Atlas. , (2008).
- Page, A. P., Johnstone, I. L. The cuticle. The C. elegans Research Community. , (2007).
- Kramer, J. M., Johnson, J. J., Edgar, R. S., Basch, C., Roberts, S. The sqt-1 gene of C. elegans encodes a collagen critical for organismal morphogenesis. Cell. 55, 555-565 (1988).
- Mende, N. v. o. n., Bird, D. M., Albert, P. S., Riddle, D. L. dpy-13: a nematode collagen gene that affects body shape. Cell. 55, 567-576 (1988).
- Blaxter, M. L. Cuticle surface proteins of wild type and mutant Caenorhabditis elegans. The Journal of Biological Chemistry. 268, 6600-6609 (1993).
- Costa, M., Draper, B. W., Priess, J. R. The role of actin filaments in patterning the Caenorhabditis elegans cuticle. Dev. Biol. 184, 373-384 (1997).
- Sapio, M. R., Hilliard, M. A., Cermola, M., Favre, R., Bazzicalupo, P. The Zona Pellucida domain containing proteins, CUT-1, CUT-3 and CUT-5, play essential roles in the development of the larval alae in Caenorhabditis elegans. Dev. Biol.. 282, 231-245 (2005).
- Johnstone, I. L. Cuticle collagen genes. Expression in Caenorhabditis elegans. Trends Genet. 16, 21-27 (2000).
- Kramer, J. M., French, R. P., Park, E. C., Johnson, J. J. The Caenorhabditis elegans rol-6 gene, which interacts with the sqt-1 collagen gene to determine organismal morphology, encodes a collagen. Mol. Cell Biol. 10, 2081-2089 (1990).
- Thein, M. C. Caenorhabditis elegans exoskeleton collagen COL-19: an adult-specific marker for collagen modification and assembly, and the analysis of organismal morphology. Dev. Dyn. 226, 523-539 (2003).
- McMahon, L., Muriel, J. M., Roberts, B., Quinn, M., Johnstone, I. L. Two sets of interacting collagens form functionally distinct substructures within a Caenorhabditis elegans extracellular matrix. Molecular Biology of the Cell. 14, 1366-1378 (2003).
- Link, C. D., Ehrenfels, C. W., Wood, W. B. Mutant expression of male copulatory bursa surface markers in Caenorhabditis elegans. Development. 103, 485-495 (1988).
- Tong, Y. G., Burglin, T. R. Conditions for dye-filling of sensory neurons in Caenorhabditis elegans. J. Neurosci. Methods. 188, 58-61 (2010).
- Singh, R. N., Sulston, J. E. Some observations on moulting in Caenorhabditis elegans. Nematologica. 24, 63-71 (1978).
- Collet, J., Spike, C. A., Lundquist, E. A., Shaw, J. E., Herman, R. K. Analysis of osm-6, a gene that affects sensory cilium structure and sensory neuron function in Caenorhabditis elegans. Genetics. 148, 187-200 (1998).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены