È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Visualizzazione di Caenorhabditis Elegans Strutture cuticola Utilizzando il Dye lipofili Vital, Dii
In questo articolo
Riepilogo
Vi presentiamo un metodo per visualizzare in vivo cuticola C. elegans Con il colorante rosso fluorescente lipofile DII (1,1 '-dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine perclorato), che viene comunemente usato in C. elegans Per visualizzare l'ambiente neuroni esposti. Con questo protocollo ottimizzato, le strutture e le ali anulare cuticolare sono macchiati da DII e osservate al microscopio composto.
Abstract
La cuticola di C. elegans è una struttura molto resistente che circonda l'esterno dell'animale 1-4. La cuticola non solo protegge l'animale dall'ambiente, ma determina anche la forma del corpo e svolge un ruolo nella motilità 4-6. Diversi strati secreto dalle cellule epidermiche comprendono la cuticola, tra cui una strato lipidico esterno 7.
Creste circonferenziale nella cuticola chiamato modello annuli la lunghezza dell'animale e sono presenti in tutte le fasi di sviluppo 8. Ali sono creste longitudinali che sono presenti durante le fasi specifiche di sviluppo, tra cui L1, dauer, e le fasi adulti 2,9. Le mutazioni nei geni che influenzano l'organizzazione cuticolare collagene possono alterare la struttura cuticolare e morfologia del corpo animale 5,6,10,11. Mentre l'imaging cuticolare usando la microscopia composto con ottica DIC è possibile, gli attuali metodi che mettono in risalto le strutture cuticolare comprendono fluorescenticento transgene espressione 12, colorazione anticorpale 13, e la microscopia elettronica 1. Etichettati germe di grano agglutinina (WGA) è stato utilizzato anche per visualizzare glicoproteine cuticolare, ma è limitato nella risoluzione dei più fini strutture cuticolare 14. La colorazione della superficie cuticolare con colorante fluorescente è stato osservato, ma mai caratterizzato in dettaglio 15. Vi presentiamo un metodo per visualizzare in vivo cuticola C. elegans con il colorante rosso fluorescente lipofile DII (1,1 '-dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine perclorato), che è comunemente usato in C. elegans per visualizzare l'ambiente neuroni esposti. Questo protocollo ottimizzato per la colorazione DII è un metodo semplice e robusto per la visualizzazione ad alta risoluzione fluorescenti di annuli, alae, vulva, coda di sesso maschile e ermafrodita coda picco di C. elegans.
Protocollo
1. Preparazione del Dii macchia
- Preparare una soluzione madre di 20 mg / mL DII (Biotium, Inc., Hayward, CA) in DMF. DII è sensibile alla luce, in modo da proteggere i Dii dalla luce, avvolgendo in un foglio.
- Creare una diluizione di lavoro di Dii con l'aggiunta di 0,6 microlitri magazzino DII a 399,4 microlitri M9 per ogni popolazione. Questo dovrebbe dare una diluizione finale di lavoro di 30 mcg / ml Dii a M9. Questo può essere scalata per la colorazione popolazioni contemporaneamente. Dii scudo dalla luce, avvolgendo il tubo (s) in un foglio.
2. Preparazione dei nematodi
- Utilizzare una piastra di 60 millimetri che contiene una popolazione di nematodi incontaminata. Lavare gli animali da lastra con una soluzione di 0,5% Triton X-100 nel buffer M9 rimestando delicatamente liquido in un movimento circolare sulla superficie della piastra per sciogliere tutti gli animali larvali e adulti. Trasferimento lavaggio in un tubo sterile 1,5 ml.
- Immediatamente spin down gli animali a 2000 rpm per 30 sec. Rimuovere e gettare il più supernatant possibile senza disturbare la massa di animali sul fondo della provetta.
- Per ridurre il residuo Triton X-100, lavare gli animali utilizzando M9 tampone, rotazione, e rimuovere il surnatante. Ripetere questa operazione una sola volta.
- Aggiungere 400 ml di soluzione di lavoro DII in M9 al tubo e mescolare brevemente nel vortex per sospendere di nuovo gli animali nella soluzione.
- Agitare tubo a 20 ° C in orizzontale per 3 ore a 350 giri al minuto in una luce-ambiente protetto. Se lo si desidera, gli animali possono essere incubate fino a 16 ore per la colorazione.
- Per ridurre la quantità di colorante, spin down gli animali a 2000 rpm per 20 sec. Rimuovere ed eliminare il più possibile surnatante senza disturbare la massa degli animali.
- Animali risospendere in 400 microlitri di buffer M9 e versare il liquido su una porzione priva di batteri di una piastra di agar NGM seminato con OP50 E. coli. Consentire agli animali di recuperare almeno 30 minuti. Durante il tempo di recupero gli animali devono strisciare via dal liquido colorazione DII e sul cibo. Questo passoriduce la fluorescenza di fondo da DII libero.
3. Montaggio e osservando i campioni
- Sciogliete il 4% agar-agar in acqua con autoclave o un forno a microonde.
- Crea distanziali riutilizzabili, che può essere utilizzato per garantire spessore uniforme del pad agar, con stratificazione due pezzi di nastro di laboratorio su un vetrino. Fai due diapositive distanziatore totale.
- Organizzare un vetrino pulito di vetro tra due diapositive distanziatore. Pipettare circa 150 microlitri (quattro gocce) di agar fuso 4% sul centro del vetrino pulito. Rapidamente coprire l'agar fuso con un ulteriore scivolo di formare un pad agar. Rimuovere con cautela il vetrino di copertura, mantenendo il pad centrato sulla parte superiore della slitta di montaggio.
- Pipettare circa 5 ml di anestetico nematode (100 mM - 1 levamisolo mM, per esempio) sul pad.
- Monte 8-12 animali in anestesia e coprire con un coprioggetto microscopio.
- Osservare gli animali usando un microscopio confocale o dotati di almeno un obietti 40x ve e un DsRed / TRITC (o compatibili) del filtro. La massima eccitazione di fluorescenza di DII è 549 nm e il suo massimo di emissione è 565 nm per il colorante legato (Biotium, Inc., Hayward, CA).
4. Rappresentante Risultati
Macchie Dii la cuticola del wild-type e mutanti C. elegans. La superficie cuticolare contiene annuli separate da solchi circonferenziali e, in alcuni stadi, creste longitudinali chiamati ali. Ogni fase di sviluppo ha strutture cuticolare con composizioni diverse 2. Creste o solchi dei due alae e annuli macchia fluorescente, a seconda della composizione della superficie, in tutta stadi larvali e adulte e rimangono visibili fino ad un giorno dopo il recupero con questo metodo. Macchioline di fondo fluorescente sono a volte osservati (figure 2F, G), ma non di routine (Figura 1, Figura 2A-E, H, I). Tutte le immagini sono state scattate con disco rotante o confocale, quando nota, widefield (wf) microscopio composto.
ENT ">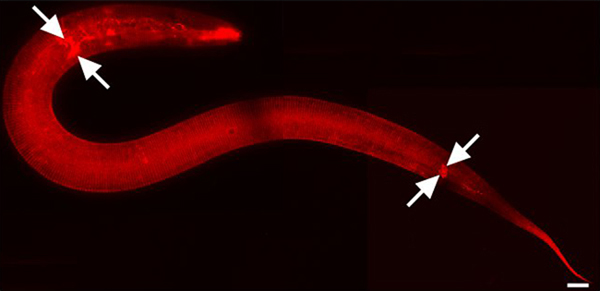
Figura 1. DII macchie cuticola e neuroni ambientalmente esposti. L2 stadio animale. Ingrandimento 630x. Parti dell'immagine mosaico sono stati catturati utilizzando ANNULLAMENTO-Mac software (Tecnologie BioVision, Exton, PA). Le immagini sono state unite con Adobe Photoshop CS3 (Adobe Systems, Inc., San Jose, CA). Barra di scala = 10 micron. DII anche fluorescente macchie amphid e fasmide neuroni sensoriali della testa e la coda rispettivamente (frecce indicano alcuni).
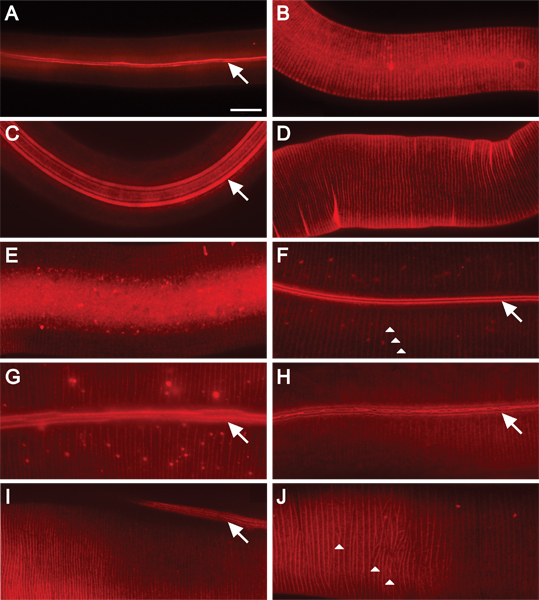
Figura 2. Dii macchie fluorescenti C. cuticola elegans in tutte le fasi della post-embrionale di sviluppo. Ingrandimento 630x. Barra di scala = 10 micron. La colorazione di tipo selvaggio animali in A) L1; B) L2; C) dauer; D) L3; E) L4, e F) Ciclo di adulto. Le dorsali ali e anulare sono macchiati fluorescente negli animali L1 e dauer (A, C). Dii macchie dorsali anulare negli animali L2(B). Anulare solchi macchia di L3 e L4 animali (D, E). I solchi delle ali e annuli sono macchiati negli animali adulti (FH). Ali sono composti da due, cinque, o tre creste (in L1, dauer o animali adulti, rispettivamente) che corrono la lunghezza dell'animale (frecce) 16. Annuli creare creste circonferenziale intorno all'animale (punte di freccia, F e J). La cuticola di adulti animali mutanti visualizzare moderati difetti organizzazione cuticolare (GH). G) Creste di alae sono discontinui (wf). H) creste ali soprannumerari sono fusi e ramificati o biforcato (wf). Mutanti del gene del collagene presentano ali e difetti dell'organizzazione anulare (J). I) In animali transgenici sovraesprimono pRF4 (rol-6 (su1006)), creste di alae giacciono in un angolo della lunghezza dell'animale. J) Annuli in animali transgenici iperespressione pRF4 (rol-6 (su1006)) mostra un pattern irregolare.
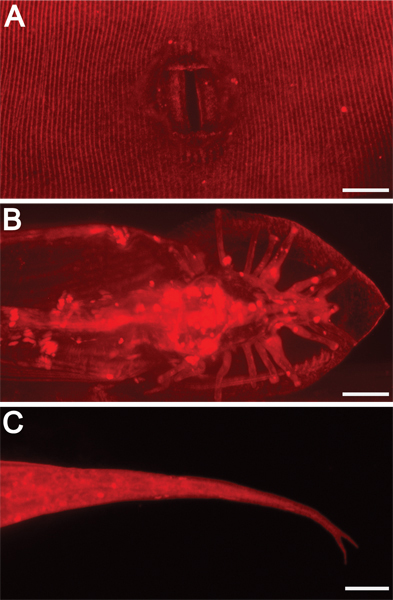
Figura 3. ExternAl strutture morfologiche sono illuminati dalla colorazione DII. ingrandimento 630x. Barre di scala = 10 micron. Dii evidenzia anche altre caratteristiche esterne, tra cui A) adulti ermafroditi vulva, B) raggi coda maschio adulto e la ventola, e C) ermafrodita punta della coda (biforcuta in questo contesto mutante).
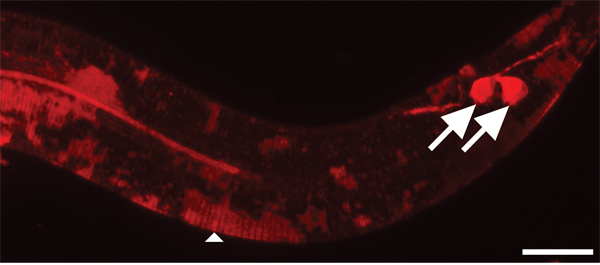
Cuticola Figura 4. Richiede più tempo per macchiare con DII di neuroni ambientalmente esposti. Ingrandimento 630x. Barra di scala = 10 micron. Dopo due ore di colorazione, amphid (non mostrato) e fasmide neuroni sensoriali (frecce) sono abbastanza colorati. Al contrario, la cuticola dei giovani animali è solo parzialmente macchiato in patch (punta di freccia).
| Lavare | Soluzione di macchia (+ DII) | Tempo di incubazione | Cuticola macchiato |
| M9 + 0,5% TrIton X-100 | M9 + 0,5% Triton X-100 | 2 ore | no |
| M9 + 0,5% Triton X-100 | M9 + 0,5% Triton X-100 | 3 ore | no |
| M9 + 0,5% Triton X-100 | M9 | 2 ore | parziale |
| M9 + 0,5% Triton X-100 | M9 | 3 ore | sì |
| M9 + 0,5% Triton X-100 | H 2 0 | 2 ore | parziale |
| M9 + 0,5% Triton X-100 | H 2 0 | 3 ore | sì |
Tabella 1. Colorazione cuticolare in condizioni diverse. Soluzioni diverse e tempi di incubazione sono stati testati per ottimizzare la colorazione cuticolare negli animali. H 2 0, acqua distillata sterile. Colorazione parziale indica colorazione irregolare della cuticola larvale (Figura 4), anche se le macchie cuticola adulti consistently.
Discussione
Il metodo di colorazione DII qui presentata permette un modo relativamente veloce e conveniente per visualizzare la cuticola in C. elegans. Da riproporre e ottimizzare un metodo comunemente usato per l'immagine dell'ambiente neuroni sensoriali esposti 15,17, DII può essere usato per macchiare fluorescente sia ali e le strutture anulare (Figure 1 e 2), così come la vulva, la coda di sesso maschile e ermafrodita coda picco (Figura 3). Abbiamo trovato che la soluzione di incubazione e l'in...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Ringraziamo S. Taneja-Bageshwar, K. Beifuss, S. Kedroske, e HC. Hsiao per le discussioni utili. Questo lavoro è stato finanziato da fondi di start-up del Dipartimento TAMHSC di Medicina Molecolare e Cellulare. L'ambito complesso e disco rotante sono stati acquistati con i fondi messi a disposizione dal Dipartimento e l'Ufficio TAMHSC del Decano. Alcuni ceppi sono stati forniti dalla genetica Caenorhabditis Center, che è finanziato dal National Center for Research Resources. pRF4 (rol-6 (su1006)) era un dono del Fuoco A..
Materiali
| Name | Company | Catalog Number | Comments | |
| Reagenti | Sinonimi | Azienda | Numero di catalogo | Commenti |
| Dii | 1,1 '-Dioctadecyl-3, 3,3', 3'-tetramethylindocarbocyanine perclorato | Biotium, Inc. | 60010 | Magazzino di diluizione: 20 mg / mL in DMF diluizione di lavoro: 30 mg / mL |
| DMF | Dimetilformammide | Sigma-Aldrich, Inc. | D4551 | |
| Tritone X-100 | Octylphenoxypolyethoxyethanol | VWR International, LLC. | EM-9410 | |
| M9 | 22mm KH 2 PO 4, 42mm Na 2 HPO 4, 86 mm di NaCl, 1 mM MgSO 4 | |||
| NGM | Nematode crescita medio | IPM Scientific, Inc. | 11006-501 | Può essere preparato seguendo il protocollo NGM agar 18 |
| Agar-agar | EMD Chemicals, Inc. | 1,01614 | 4% in acqua | |
| Levamisolo | Levamisolo cloridrato | Sigma-Aldrich, Inc. | 31742 | 100 mM - 1 levamisolo mM come richiesto |
| Microscopio diapositive | VWR International, LLC. | 16005-106 | ||
| Microscopio copertura occhiali | VWR International, LLC. | 16004-302 | ||
| Composto portata | Carl Zeiss, Inc. | A1M | Utilizzare gli obiettivi per soddisfare le esigenze della sperimentazione | |
| TRITC o altri filtro compatibile | Chroma Technology Corp. | 49005 | ET - DsRed (TRITC/Cy3) atomizzate set di filtri |
Riferimenti
- Cox, G. N., Kusch, M., Edgar, R. S. Cuticle of Caenorhabditis elegans: its isolation and partial characterization. The Journal of Cell Biology. 90, 7-17 (1981).
- Cox, G. N., Staprans, S., Edgar, R. S. The cuticle of Caenorhabditis elegans. II. Stage-specific changes in ultrastructure and protein composition during postembryonic development. Dev. Biol. 86, 456-470 (1981).
- Hall, D., Altun, Z. . C. elegans Atlas. , (2008).
- Page, A. P., Johnstone, I. L. The cuticle. The C. elegans Research Community. , (2007).
- Kramer, J. M., Johnson, J. J., Edgar, R. S., Basch, C., Roberts, S. The sqt-1 gene of C. elegans encodes a collagen critical for organismal morphogenesis. Cell. 55, 555-565 (1988).
- Mende, N. v. o. n., Bird, D. M., Albert, P. S., Riddle, D. L. dpy-13: a nematode collagen gene that affects body shape. Cell. 55, 567-576 (1988).
- Blaxter, M. L. Cuticle surface proteins of wild type and mutant Caenorhabditis elegans. The Journal of Biological Chemistry. 268, 6600-6609 (1993).
- Costa, M., Draper, B. W., Priess, J. R. The role of actin filaments in patterning the Caenorhabditis elegans cuticle. Dev. Biol. 184, 373-384 (1997).
- Sapio, M. R., Hilliard, M. A., Cermola, M., Favre, R., Bazzicalupo, P. The Zona Pellucida domain containing proteins, CUT-1, CUT-3 and CUT-5, play essential roles in the development of the larval alae in Caenorhabditis elegans. Dev. Biol.. 282, 231-245 (2005).
- Johnstone, I. L. Cuticle collagen genes. Expression in Caenorhabditis elegans. Trends Genet. 16, 21-27 (2000).
- Kramer, J. M., French, R. P., Park, E. C., Johnson, J. J. The Caenorhabditis elegans rol-6 gene, which interacts with the sqt-1 collagen gene to determine organismal morphology, encodes a collagen. Mol. Cell Biol. 10, 2081-2089 (1990).
- Thein, M. C. Caenorhabditis elegans exoskeleton collagen COL-19: an adult-specific marker for collagen modification and assembly, and the analysis of organismal morphology. Dev. Dyn. 226, 523-539 (2003).
- McMahon, L., Muriel, J. M., Roberts, B., Quinn, M., Johnstone, I. L. Two sets of interacting collagens form functionally distinct substructures within a Caenorhabditis elegans extracellular matrix. Molecular Biology of the Cell. 14, 1366-1378 (2003).
- Link, C. D., Ehrenfels, C. W., Wood, W. B. Mutant expression of male copulatory bursa surface markers in Caenorhabditis elegans. Development. 103, 485-495 (1988).
- Tong, Y. G., Burglin, T. R. Conditions for dye-filling of sensory neurons in Caenorhabditis elegans. J. Neurosci. Methods. 188, 58-61 (2010).
- Singh, R. N., Sulston, J. E. Some observations on moulting in Caenorhabditis elegans. Nematologica. 24, 63-71 (1978).
- Collet, J., Spike, C. A., Lundquist, E. A., Shaw, J. E., Herman, R. K. Analysis of osm-6, a gene that affects sensory cilium structure and sensory neuron function in Caenorhabditis elegans. Genetics. 148, 187-200 (1998).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon