Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Inducida por herbívoros-Volátiles Blueberry y señalización dentro de la planta
En este artículo
Resumen
Un método push-pull para la recolección de plantas volátiles se describe. El método permite la comparación de los volátiles inducidos por la alimentación de los herbívoros, metil jasmonato exógenas, y los daños mecánicos. Esta técnica también se utiliza para investigar la respuesta de la volatilidad de las ramas en buen estado a la exposición a los volátiles de las ramas dañadas por herbívoros en las plantas de arándanos.
Resumen
Inducida por herbívoros-volátiles de las plantas (HIPVs) son comúnmente emitidos por las plantas después de 1,2 herbívoro ataque. Estos HIPVs se rigen principalmente por el ácido jasmónico planta defensiva hormona (JA) y su jasmonato de metilo volátiles derivados (MeJA) 3,4,5. En los últimos tres años los investigadores han documentado que HIPVs pueden repeler o atraer a los herbívoros, atraer a los enemigos naturales de los herbívoros, y en algunos casos, pueden inducir o defensas primera planta antes del ataque de herbívoros. En un reciente artículo 6, me informaron que la alimentación de orugas de la polilla gitana, la aplicación exógena MeJA, y el daño mecánico induce la emisión de compuestos volátiles de las plantas de arándanos, aunque de manera diferente. Además, las sucursales de arándanos responder a HIPVs emitida por las ramas vecinas de la misma planta, incrementando los niveles de JA y la resistencia a los herbívoros (es decir, las defensas directas de las plantas), y por las emisiones de cebado volátiles (es decir, las defensas indirectas de las plantas). Resultados similaresIngs se ha informado recientemente de artemisa 7, 8 álamo, y habas 9 ..
Aquí, se describe un método push-pull para la recolección de arándanos volátiles inducidos por herbívoros (lagarta peluda) la alimentación, la aplicación exógena MeJA, y los daños mecánicos. La unidad de recogida volátiles consiste en una cámara de recogida de 4 L volátiles, una guillotina de 2 piezas, un sistema de suministro de aire que purifica el aire de entrada, y un sistema de vacío conectado a una trampa llena de Super-Q absorbente para recoger los volátiles 5,6,10 . Volátiles recogidas en el Super-Q trampas se eluyen con diclorometano y se separan y se cuantificó mediante cromatografía de gases (GC). Este método de recogida de volátiles se utilizó n-6 mi estudio para investigar la respuesta de la volatilidad de las ramas en buen estado a la exposición a los volátiles de las ramas dañadas por herbívoros en las plantas de arándanos. Estos métodos se describen a continuación. En pocas palabras, en buen estado las ramas de arándano están expuestos a HIPVs lado a otrom vecinos ramas dentro de la misma planta. Usando las mismas técnicas descritas anteriormente, los compuestos volátiles emitidos por las ramas después de la exposición a HIPVs se recogen y analizan.
Protocolo
1. Inducción local de volátiles: el daño de herbívoros
- Dos ramas de las plantas de arándanos se embolsan con una manga de poliéster hilado.
- Seis orugas de la polilla gitana (2 ª -3 ª estadios) se colocan dentro de las bolsas y se les permite alimentarse de las plantas durante 2 días antes de la recolección volátil. Las plantas de control no reciben ningún tipo de orugas.
- Las emisiones de volátiles se recogen como se describe a continuación (protocolo n º 7) el día 3 (Figura 1). Fundas de poliéster permanecen en las plantas para evitar que los insectos escapen.
2. Inducción local de volátiles: el daño mecánico
- El daño mecánico a las plantas sean infligidos por los agujeros de perforación para imitar la cantidad de área foliar removido por la polilla gitana.
- Cinco hojas por planta se lesiona con dos orificios de 7 mm situado en la base y la parte superior de las hojas al final de los días 1 y 2. El tratamiento de control no recibe daño mecánico. volátiles se recogen como se describe más adelante en el día 3.
3. Inducción local de volátiles: MeJA
- Los arándanos son tratados con 10 mL de una solución 1 mM o 1.5 de MeJA en un 0,1% de Tween-20 solución.
- MeJA se aplica con una botella de 2 oz spray. Las plantas de control se rocían con 10 ml de un 0,1% de Tween-20 solución.
- Las plantas son tratadas a las 16:00 horas, y se mantuvo en el invernadero durante 15 horas dentro de un diámetro de 17 cm y 35 cm de la cámara de Plexiglas de alta antes de las colecciones de volátiles.
- Las emisiones de volátiles se recogen como se describe a continuación.
4. Inducción sistémica de volátiles: la señalización interna
- Una rama inferior de una planta de arándano se empaqueta con una funda de poliéster hilado y dañado por la colocación de seis (2 ª -3 ª estadios) las orugas de la polilla gitana dentro de la bolsa.
- La rama dañada queda fuera de la cámara de recogida de volátiles, mientras que el indices arriba de la rama dañada se colocan dentro de la cámara (Figura 2).
- Las orugas se les permite alimentarse de la rama más baja durante 2 días.
- A partir del día 3, los compuestos volátiles se obtienen de la parte no dañada de las plantas dañadas.
- Los volátiles se recogen durante 7 días consecutivos. Las plantas de control se tratan de una manera similar, pero no recibió daño de herbívoros.
5. Vascular conectividad
- Este estudio determinó el grado de conectividad entre las diferentes ramas vasculares dentro de una planta de arándano.
- La parte final de una rama menor de una planta es cortada para apoyar una selección del agua floral con 6 ml de solución de rodamina B (Sigma-Aldrich) colorante (0,25% w / v), tal como se describe en Orians et al 11.
- Movimiento del tinte a través de la planta es revisado diariamente por 7 días.
- Después de 7 días, la cantidad de manchas de color rojo es evaluado visualmente desde diferentes posiciones de la planta.
6. La exposición a HIPVs: señalización externa
- Ramas dentro de la planta están expuestos a HIPVs de una rama de al lado o no recibió la exposición a HIPVs.
- Para exponer las ramas a HIPVs, una de las ramas inferiores se empaqueta con una manga de poliéster y seis (2 ª -3 ª estadios) las orugas de la polilla gitana se colocan dentro de bolsas (Figura 3).
- La planta está enjaulada dentro de una cámara de plexiglás similares a las descritas anteriormente. Los insectos pueden alimentarse de las plantas durante 2 días, de tal manera que las ramas adyacentes están expuestos a sustancias volátiles emitidas por la rama inducido.
- Después de la exposición (día 3), las ramas expuestas se colocan dentro de la cámara de recolección volátil, dejando fuera de la rama de insectos heridos (como se ve en la Figura 2).
- Volátiles de HIPV expuestos ramas se recogen como se describe a continuación, y la cantidad de área foliar consumida de la rama inferior se miden utilizando Scion Image Software.
7. La exposición a HIPVs: imprimación
- Para determinar si las plantas están "preparados" después de la exposición HIPV, las plantas son tratadas como en el protocolo n º 5.
- La mitad de las plantas están expuestas a HIPVs de una rama de al lado inducida, mientras que la otra mitad está expuesta a las sucursales en buen estado.
- El día 3, cuatro principios de 2 º estadio de orugas de la polilla gitana se colocan en cada planta y los volátiles se recogen como se describe a continuación (Figura 4).
- Después de las colecciones de volátiles, deja inicialmente dañados por orugas de la polilla gitana, así como los que estén dañados en el día 3, se extirpa y las cantidades de consumo de área foliar se midió.
8. Colección de volátiles
- Las emisiones de HIPV se muestra en el invernadero con un sistema push-pull. La porción de tierra por encima de las plantas en maceta (tallo, ramas y hojas), incluyendo las orugas en el tratamiento de daños herbívoro, se colocan dentro de una vola 4 Lcámara de mosaico colección. Una guillotina de 2 piezas apoya la base de las plantas. Purificado el aire entra en la parte superior de cada cámara a una velocidad de 2 L / min.
- Los volátiles se recogen en las trampas llenas con 30 mg de Alltech Super-Q adsorbente tirando de aire de las cámaras a una velocidad de 1 l / min.
- El aparato de colección volátil consta de cuatro cámaras, teniendo en cuenta las colecciones simultánea de los volátiles de cuatro plantas diferentes (Figura 1).
- Las colecciones se llevó a cabo durante el día 09:00-17:00 h.
- Después de la recolección, todas las hojas de las plantas se cosechan, se seca en estufa a 60 ° C, y se pesa, y las cámaras se enjuagan con agua del grifo y el 70% de etanol.
9. Análisis de compuestos volátiles
- Los volátiles recogidos de Super-Q trampas se eluyen con diclorometano (150 l) y 400 ng de n-octano, se añade como estándar interno.
- Separación y cuantificación de los compuestos se lleva a cabo en un Hewlett Packard 6890 SeriesCromatógrafo de Gases (GC) (Figura 5), equipado con un detector de ionización de llama (FID) y un Agilent HP-1 columna (10 mx 0,53 mm x 2,65 m), y con él como gas portador (flujo constante = 5 ml / min , velocidad = 39 cm / seg). El programa de temperatura se inició a 40 ° C mantiene durante 1 min, aumentó a 14 ° C / min hasta 180 ° C (2 min), luego a 40 ° C / min hasta 200 ° C, y se mantiene a 200 ° C durante 2 minutos .
- Identificación provisional de los compuestos se lleva a cabo en un Varian 3400 GC acoplado a un espectrómetro de masas Finnigan MAT 8230 (MS), equipado con un Supelco MDN-5S columna (30 mx 0,32 mm x 0,25 m), y con Él, como el gas portador. La MS se utiliza en ionización electrónica (EI) y el modo de cromatograma de iones totales (TIC) a 250 ° C (temperatura de la fuente). El programa se inició a 35 ° C (1 min), el aumento a 4 ° C / min a 170 º C, y luego a 15 ° C / min a 280 º C.
- Los compuestos son tentativamente identificados por comparación de los datos espectrales con los de NIST biblioteca y bíndice de retención y GC, y mediante la comparación de sus tiempos de retención con los de los compuestos disponibles en el mercado.
10. Los resultados representativos:
Veintidós volátiles fueron identificados a partir de hojas de arándano (Figura 6). La figura 7 muestra un cromatógrafo de representante de hojas de arándano en buen estado y las hojas dañadas por la alimentación de la polilla gitana. Daños mecánicos y la alimentación por orugas de la polilla gitana aumento de las emisiones volátiles a nivel local a partir de hojas de arándano en comparación con los controles (Figura 8). En comparación con la alimentación de la oruga, el tratamiento MeJA inducida 11 de los 17 compuestos inducidos por la polilla gitana (Figura 9). Hubo, sin embargo, no hay evidencia de la inducción sistémica de compuestos volátiles de las hojas en buen estado de gitana dañado polilla plantas de siete días después de daño por la alimentación inicial (es decir, la falta de señalización interna) (Figura 10). Además, después de una semana, se mueven muy lentoción del colorante rojo se observó entre las ramas de las plantas de arándano (Figura 11). No había conexión vascular elevado entre las hojas en una sola rama. Sin embargo, no fue intermedia a baja conectividad entre las dos ramas alineados verticalmente dentro de una sesión y baja conectividad entre las dos ramas en lados opuestos de una sesión.
No hubo diferencia entre las cantidades de compuestos volátiles emitidos por las ramas expuestas a HIPVs frente a los no expuestos a HIPVs (Figura 12). Sin embargo, HIPVs actúan como señales externas de la defensiva en los arándanos. Orugas de la polilla gitana se alimentaban de hojas previamente expuestos a HIPVs consume 71% menos de material de hoja que aquellos alimentados con hojas de control no expuestos (Figura 13). Además, las cantidades de sustancias volátiles emitidas por la cantidad de área foliar que se consume en HIPV expuestos ramas fueron 4 veces mayor en comparación con las ramas no expuestos (Figura 14), lo que indica que parte de HIPV ex- ramas plantean son más sensibles a los herbívoros (es decir, que fueron preparados).

Figura 1. Un sistema push-pull se utiliza para recoger los volátiles de plantas de arándanos. Las plantas se colocan dentro de las cámaras de vidrio y el aire limpio se pasa por encima de ellos. Un filtro que contiene un material adsorbente fue colocada en el lateral de cada cámara para atrapar los volátiles emitidos por la planta. Un vacío se utiliza para extraer el aire del interior de la cámara a través del filtro.
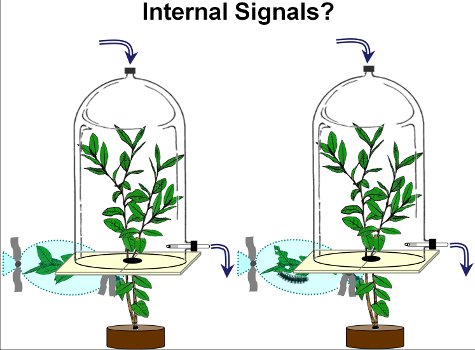
Figura 2. Para el estudio de la respuesta sistémica volátiles de las plantas de arándanos, las ramas más bajas de arándanos fueron dañados por orugas de la polilla gitana (a la derecha de la cámara) o (ventrículo izquierdo) a la izquierda en buen estado. Después de 2 días (el día 3), en buen estado volátiles de las ramas superiores de las plantas dañadas y no dañadas se recogieron.

Figura 3. Para probar si las hojas de las ramas en buen estado responder a HIPVs de ramas dañadas, me bolsas una de las ramas en cada una de las plantas de arándanos. Entonces coloqué las orugas de la polilla gitana dentro de las bolsas de la mitad de las plantas. Las bolsas que utilizan permiten el movimiento de los volátiles desde el interior hacia el exterior de la bolsa. Las plantas se colocan dentro de Plexiglas cámaras para exponer las ramas en buen estado a HIPVs. Los compuestos volátiles fueron recopilados a partir de ramas expuestas.

Figura 4. Para probar si las hojas de las ramas en buen estado son "preparados" después de la exposición a HIPVs, los experimentos se repitieron tal como se describe en la figura 3, pero las orugas de la polilla gitana se colocaron en HIPV expuestos y no expuestos ramas dentro de cada cámara de recogida de volátiles.
g "alt =" Figura 5 "/>
Figura 5. Después de las colecciones de volátiles, las muestras se inyectaron en un cromatógrafo de gases (GC) para identificar y cuantificar los compuestos volátiles emitidos por plantas de arándanos.
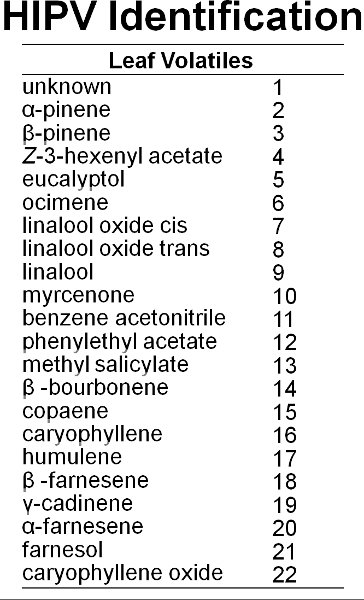
Figura 6. Por lo menos 22 compuestos son emitidos a partir de hojas de arándano.

Figura 7. Cromatógrafos típicos de arándanos en buen estado las hojas y las hojas dañadas por orugas de la polilla gitana. Los volátiles se emiten en cantidades muy bajas de daños hojas de arándano. Sin embargo, cuando las hojas están dañados por orugas de la polilla gitana, la emisión de volátiles aumentado de manera espectacular.
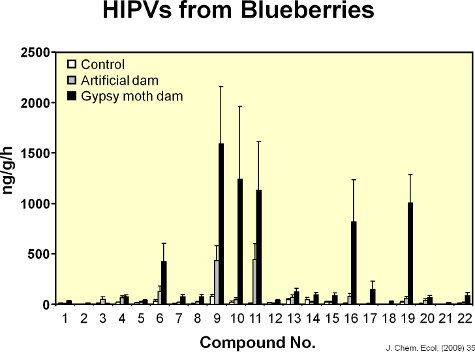
Figura 8. El gráfico muestra las cantidades de cada uno de los 22 compuestos volátiles emitidos por las hojas en buen estado, mechanically dañada por las hojas y las hojas dañadas por orugas de la polilla gitana. Daño artificial para simular la cantidad de área removida por las orugas aumento de las emisiones volátiles de las hojas de arándano, pero la respuesta fue diferente de la respuesta volátiles de las hojas para la alimentación de la polilla gitana.

Figura 9. Probaron si la vía JA regula las emisiones de volátiles en las hojas de arándano. Las plantas fueron rociadas con diferentes cantidades de Meja. Me pareció que las concentraciones crecientes de forma exógena a aplicar MeJA aumento de las emisiones de compuestos volátiles de las hojas de arándano.

Figura 10. El gráfico muestra la cantidad total de sustancias volátiles emitidas por las ramas de arándanos y el control de las ramas en buen estado de las plantas de la polilla gitana dañado (respuesta sistémica). Los compuestos volátiles fueron recogidos por un atal de 7 días consecutivos. No encontré ninguna inducción sistémica de los volátiles hasta 7 días después del daño inicial a las ramas bajas de las plantas.
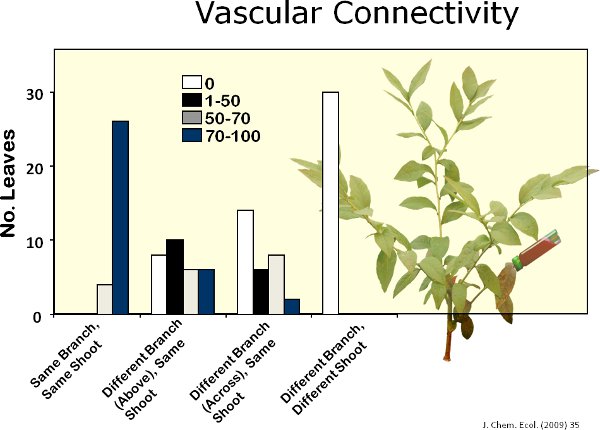
Figura 11. Yo rodamina B (colorante rojo) para determinar el grado de conectividad entre las ramas vasculares en las plantas de arándanos. Me pareció que aprox. 80%, 20%, 5% y 0% de las hojas de las ramas que contiene el tinte, las ramas justo encima de la rama que contiene el tinte, las ramas a través de la rama que contiene colorantes, y sucursales ubicadas en una sesión diferente dentro de una planta de arándano, respectivamente, fueron totalmente teñidas con el tinte.

Figura 12. El gráfico muestra la cantidad de compuestos volátiles emitidos por las ramas expuestas a las sucursales HIPVs y no expuestos. Me pareció que la exposición a HIPVs no afectan a las emisiones volátiles en barriosaburrido ramas en buen estado de arándanos.

Figura 13. El gráfico muestra la cantidad de la alimentación de orugas de la polilla gitana en las ramas de arándanos expuestos a las sucursales HIPVs y no expuestos. Orugas HIPV expuestos ramas consumían menos cantidad de hojas en comparación con los no expuestos en las ramas.

Figura 14. Cuando calcula la tasa de emisión por área de consumo, me encontré con que HIPV expuestos ramas han aumentado las tasas de emisión de compuestos volátiles en comparación con las ramas expuestas, lo que indica que la exposición a HIPVs preparado las hojas en las ramas de arándanos para una respuesta mayor volatilidad.
Discusión
El push-pull aparato colección volátiles descrito aquí representa un método estándar para las colecciones del espacio de cabeza de los volátiles de las plantas. Este aparato fue utilizado para determinar la respuesta volátiles de las hojas del arándano a la herbivoría por orugas de la polilla gitana y también me permitió ofrecer nuevas pruebas para el papel de HIPVs en la señalización dentro de la planta.
Los resultados presentados aquí indican que la alimentación de oruga, ex...
Divulgaciones
No tengo nada que revelar
Agradecimientos
El autor agradece a Robert Holdcraft de asistencia técnica. Este estudio fue financiado en parte por el USDA CSREES especiales Grant (2009-34155-19957) y los fondos de escotilla (NJ08192).
Materiales
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Cámaras volátiles colección | Analítica Research Systems, Inc. | VCC-G6X12DT-1P | Gainesville, FL |
| Compresor de aire de 20 gal, sin aceite, 2 hp | Hacia el oeste | 3JR71 | Vendido por Grainger, Inc. |
| De aire del sistema de entrega | Analítica Research Systems, Inc. | VCS-ADS-4AFM4C | Gainesville, FL |
| De aire del sistema de recogida | Analítica Research Systems, Inc. | VCS-MVCS-4CX1P | Gainesville, FL |
| Bomba de vacío 100-150V, ¼ hp | Gast Manufacturing, Inc. | 4F740 | Vendido por Grainger, Inc. |
| Metil jasmonato | Sigma-Aldrich | J2500 | St. Louis, MO |
| Tween-20 | Sigma-Aldrich | 93773 | St. Louis, MO |
| Rodamina B | Sigma-Aldrich | St. Louis, MO | |
| Botellas de plástico spray, 2 oz | Setco Inc. | Cranbury, NJ | |
| Mangas de poliéster hilada | Rockingham Oportunidades Corp. | Reidsville, Carolina del Norte | |
| Super-Q trampas de recolección de volátiles | Analítica Research Systems, Inc. | VCT-1/4X3-SPQ | Gainesville, FL |
| Scion imagen de software | Scion Corporation | Frederick, MD | |
| Diclorometano | Sigma-Aldrich | 270997 | St. Louis, MO |
| Cromatógrafo de gases HP 6890 | Hewlett Packard | ||
| Cromatógrafo de gases Varian 3400 | Varian | ||
| n-octano | Sigma-Aldrich | 296988 | St. Louis, MO |
| Espectrómetro de masas MAT 8230 | Finnigan | San Jose, CA | |
| HP-1 GC columna | Agilent Technologies | Palo Alto, California | |
| MDN-5S GC columna | Supelco, Inc. | Bellefonte, PA |
Referencias
- Dicke, M., Van Loon, J. J. A. Multitrophic effects of herbivore-induced plant volatiles in an evolutionary context. Entomol. Exp. Appl. 97, 237-237 (2000).
- Mumm, R., Dicke, M. Variation in natural plant products and the attraction of bodyguards involved in indirect plant defense. Can. J. Zool. 88, 628-628 (2010).
- Hopke, J. Herbivore-induced volatiles: the emission of acyclic homoterpenes from leaves of Phaseolus lunatus and Zea mays can be triggered by a β-glucosidase and jasmonic acid. FEBS Lett. 352, 146-146 (1994).
- Rodriguez-Saona, C. Behavioral and electrophysiological responses of the emerald ash borer, Agrilus planipennis, to induced volatiles of Manchurian ash, Fraxinus mandshurica. Chemoecology. 16, 75-75 (2006).
- Rodriguez-Saona, C. Herbivore induced volatiles in the perennial shrub, Vaccinium corymbosum, and their role in inter-branch signaling. J. Chem. Ecol. 35, 163-163 (2009).
- Karban, R. Damage-induced resistance in sagebrush: volatiles are key to intra- and interplant communication. Ecology. 87, 922-922 (2006).
- Frost, C. J. Within-plant signalling by volatiles overcomes vascular constraints on systemic signalling and primes responses against herbivores. Ecol. Lett. 10, 490-490 (2007).
- Heil, M., Bueno Silva, J. C. Within-plant signaling by volatiles leads to induction and priming of an indirect plant defense in nature. Proc. Natl. Acad. Sci. U.S.A. 104, 5467-5467 (2007).
- Turlings, T. C. Exploitation of herbivore-induced plant odors by host-seeking parasitic wasps. Science. 250, 1251-1251 (1990).
- Makovic, I. Volatiles involved in the nonhost rejection of Fraxinus pennsylvanica by Lymantria dispar larvae. J. Agric. Food Chem. 44, 929-929 (1996).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados