Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Herbivores induite Volatiles Blueberry et intra-usine de signalisation
Dans cet article
Résumé
Une méthode push-pull pour la collecte des plantes volatils est décrite. La méthode permet une comparaison des composés volatils induite par l'alimentation des herbivores, le jasmonate de méthyle exogène, et les dommages mécaniques. Cette technique est également utilisée pour étudier la réponse volatiles de branches intactes à l'exposition aux composés volatils à partir de branches endommagées par des herbivores dans les plants de bleuets.
Résumé
Volatiles des plantes induite par les Herbivores (HIPVs) sont communément émis par les plantes, après 1,2 attentat herbivore. Ces HIPVs sont principalement réglementés par l'acide jasmonique hormones végétales défensives (JA) et ses dérivés méthyl jasmonate volatiles (MeJa) 3,4,5. Au cours des dernières décennies les chercheurs ont démontré que les trois HIPVs peut repousser ou attirer les herbivores, d'attirer les ennemis naturels des herbivores et, dans certains cas, ils peuvent induire ou de défense des plantes Premier avant l'attaque des herbivores. Dans un document récent 6, j'ai signalé que l'alimentation par des chenilles de la spongieuse, l'application exogène Meja, et les dommages mécaniques induisent des émissions de composés volatils à partir des plants de bleuets, quoique différemment. En outre, les succursales de répondre aux bleuets HIPVs émis par les branches voisines de la même plante en augmentant les niveaux de JA et la résistance aux herbivores (c'est à dire, les défenses des plantes directe), et par les émissions d'amorçage volatils (ie, les défenses des plantes indirecte). Similaires à trouverIngs ont été rapportés récemment pour armoise 7, 8 peupliers, et les haricots de Lima 9 ..
Ici, je décris une méthode push-pull pour la collecte de bleuets volatiles induits par des herbivores (spongieuse) l'alimentation, l'application exogène Meja, et les dommages mécaniques. L'unité de collecte volatile compose d'une chambre de 4 L de collecte volatiles, une guillotine 2-pièces, un système de livraison de l'air qui purifie l'air entrant, et un système d'aspiration relié à un piège rempli de Super-Q adsorbant pour recueillir volatiles 5,6,10 . Volatiles recueillies en Super-Q pièges sont élués avec du dichlorométhane, puis séparés et quantifiés à l'aide chromatographie en phase gazeuse (GC). Cette méthode de collecte volatile a été utilisé mon étude n 6 pour étudier la réponse volatiles de branches intactes à l'exposition aux composés volatils à partir de branches endommagées par des herbivores dans les plants de bleuets. Ces méthodes sont décrites ici. Brièvement, intact branches de bleuets sont exposés à HIPVs BOFM branches voisines dans la même usine. En utilisant les mêmes techniques décrites ci-dessus, les volatiles émises par les branches après une exposition à HIPVs sont recueillies et analysées.
Protocole
1. L'induction locale de volatiles: les dommages herbivore
- Deux branches de plants de bleuets sont emballés avec un manchon de polyester filé.
- Six chenilles spongieuse (2 e -3 e stades larvaires) sont placés à l'intérieur du sac et a permis de se nourrir de plantes pour 2 jours avant la collecte volatiles. Les plantes de contrôle ne reçoivent pas de chenilles.
- Émissions volatiles sont collectées que décrit ci-dessous (protocole n ° 7) au jour 3 (figure 1). Manches en polyester reste sur les végétaux pour empêcher les insectes de s'échapper.
2. L'induction locale de volatiles: les dégâts mécaniques
- Les dégâts mécaniques aux plantes sont infligées par des trous pour imiter la quantité de surface foliaire enlevé par la spongieuse.
- Cinq feuilles par plante sont blessés avec deux trous de 7 mm située à la base et la partie supérieure des feuilles à la fin du jour 1 et 2. Le traitement de contrôle ne reçoit pas les dommages mécaniques. volatils sont recueillis comme décrit ci-dessous le jour 3.
3. L'induction locale de volatiles: MeJa
- Les plants de bleuets sont traités avec 10 ml d'une solution soit 1 ou 1,5 mM d'MeJa dans un 0,1% de Tween-20 solution.
- MeJa est appliquée en utilisant une bouteille de 2 oz de pulvérisation. Les plantes de contrôle sont pulvérisés avec 10 ml d'un 0,1% de Tween-20 solution.
- Les plantes sont traitées à 16:00 h, et conservés dans la serre pendant 15 heures à l'intérieur d'un diamètre de 17 cm et 35 cm de haute chambre en plexiglas avant collections volatiles.
- Émissions volatiles sont collectées comme décrit ci-dessous.
4. L'induction systémique de volatiles: la signalisation interne
- Une branche inférieure d'un plant de bleuet est ensaché avec un manchon de polyester filé et endommagé en plaçant six (2 e -3 e stades) chenilles de spongieuses l'intérieur du sac.
- La branche endommagé reste en dehors de la chambre de collecte des volatiles, tandis que la branches ci-dessus la branche endommagés sont placés à l'intérieur de la chambre (figure 2).
- Les chenilles sont autorisés à se nourrir de la branche du bas pendant 2 jours.
- A partir du jour 3, les volatiles sont collectées à partir de la partie non endommagée de plantes endommagées.
- Volatiles sont recueillies pendant 7 jours consécutifs. Les plantes de contrôle sont traités de façon similaire mais n'a pas reçu les dommages herbivore.
5. Vasculaire connectivité
- Cette étude a déterminé le degré de connectivité entre les différentes branches vasculaires au sein d'un plant de bleuet.
- La portion d'extrémité d'une branche inférieure d'une plante est coupée pour soutenir un pick eau florale contenant 6 ml de solution d'un rhodamine B-(Sigma-Aldrich) colorant (0,25% p / v), comme décrit dans Orians et al. 11
- Mouvement de la teinture à travers la plante est contrôlée quotidiennement pendant 7 jours.
- Après 7 jours, le montant de la coloration rouge est évaluée visuellement à partir de positions différentes de la plante.
6. L'exposition à HIPVs: signalisation externe
- Branches dans une usine sont soit exposés à HIPVs partir d'une branche adjacente ou reçu aucune exposition à HIPVs.
- Pour exposer les branches d'HIPVs, une branche inférieure est ensaché avec un manchon de polyester et de six (2 e -3 e stades) chenilles de spongieuses sont placées à l'intérieur de sacs (figure 3).
- L'usine est mise en cage dans une chambre en plexiglas similaires à ceux décrits ci-dessus. Les insectes sont autorisés à se nourrir de plantes pour 2 jours, tels que les branches adjacentes sont exposés à volatils émis par la branche induite.
- Après l'exposition (jour 3), les branches exposées sont placées à l'intérieur de la chambre de collecte volatile, laissant l'extérieur branche insectes blessés (voir Figure 2).
- Volatiles de HIPV exposés branches sont recueillies comme décrit ci-dessous, et la quantité de surface des feuilles consommées par la branche inférieure sont mesurés en utilisant Scion Image Software.
7. L'exposition à HIPVs: l'amorçage
- Afin de déterminer si les plantes sont "amorcée" après l'exposition HIPV, les plantes sont traitées comme dans le protocole n ° 5.
- La moitié des plantes sont exposées à partir d'une branche HIPVs induite adjacentes, tandis que l'autre moitié est exposée à des branches intactes.
- Au jour 3, quatre au début 2 e stade larvaire chenilles de spongieuses sont placées sur chaque plante et les volatiles sont collectées comme décrit ci-dessous (Figure 4).
- Après les collections volatiles, laisse d'abord endommagé par des chenilles de la spongieuse, ainsi que ceux qui sont endommagés au jour 3, sont excisés et les quantités de surface foliaire consommée est mesurée.
8. Collecte des matières volatiles
- Émissions HIPV sont échantillonnées dans la serre en utilisant un système push-pull. La partie hors sol des plantes en pot (souches, branches et feuilles), y compris les chenilles dans le traitement des dommages herbivore, sont placés dans un Vola 4 Lchambre de collecte de tuiles. Une guillotine en 2 parties supporte la base des plantes. Purifié air pénètre dans le haut de chaque chambre à un débit de 2 L / min.
- Volatiles sont recueillis dans des pièges remplis de 30 mg d'Alltech Super-Q adsorbant en tirant d'air des chambres à un taux de 1 L / min.
- L'appareil de collecte de volatiles se compose de quatre chambres, permettant de collections simultanées des composés volatils à partir de quatre plantes différentes (figure 1).
- Les collections sont réalisées pendant la journée 9h00-17h00 h.
- Après la collecte, toutes les feuilles des plantes sont récoltées, séchées au four à 60 ° C et pesés, et les chambres sont rincés à l'eau du robinet et 70% d'éthanol.
9. L'analyse des composés volatils
- Les volatiles recueillies auprès de Super-Q pièges sont élués avec du dichlorométhane (150 pi) et de 400 ng de n-octane est ajoutée comme standard interne.
- Séparation et quantification des composés se fait sur un Hewlett Packard 6890 SeriesChromatographe en phase gazeuse (GC) (figure 5), équipé d'un détecteur à ionisation de flamme (FID) et une Agilent HP-1 colonne (10 mx 0,53 mm x 2,65 um), et il l'utiliser comme gaz porteur (flux constant = 5 ml / min , vitesse = 39 cm / sec). Le programme de température a commencé à 40 ° C maintenu pendant 1 min, l'augmentation à 14 ° C / min à 180 ° C (2 min), puis à 40 ° C / min à 200 ° C, et maintenu à 200 ° C pendant 2 min .
- Tentative d'identification des composés est réalisée sur un Varian 3400 GC couplée à un spectromètre de masse Finnigan MAT 8230 (MS), équipé d'un Supelco MDN-5S colonne (30 mx 0,32 mm x 0,25 um), et avec lui comme le gaz porteur. Le MS est exploité en ionisation électronique (IE) et le total des chromatogramme ionique (TIC) en mode à 250 ° C (température de la source). Le programme a démarré à 35 ° C (1 min), a augmenté à 4 ° C / min à 170 ° C, puis à 15 ° C / min à 280 ° C.
- Les composés sont identifiés provisoirement par la comparaison des données spectrales avec ceux du NIST bibliothèque et bIndice de rétention y GC, et en comparant leur temps de rétention avec ceux des composés disponibles dans le commerce.
10. Les résultats représentatifs:
Vingt-deux volatiles ont été identifiés à partir de feuilles de bleuet (figure 6). La figure 7 montre un chromatographe représentant de feuilles de bleuet en bon état et les feuilles abîmées par l'alimentation par la spongieuse. Les dommages mécaniques et de l'alimentation par les chenilles de spongieuses augmentation des émissions de substances volatiles localement à partir de feuilles de bleuets par rapport aux témoins (figure 8). Par rapport à l'alimentation chenille, le traitement induit MeJa 11 des 17 composés induits par la spongieuse (figure 9). Il y avait, cependant, aucune preuve de l'induction systémique de substances volatiles des feuilles intactes de la spongieuse endommagé les plantes sept jours après les dommages alimentation initiale (à savoir, le manque de signalisation interne) (figure 10). En outre, après une semaine, très lent mouvementment du colorant rouge a été observée parmi les branches de plants de bleuets (figure 11). Il a été élevé de connectivité vasculaires parmi les feuilles dans une seule branche. Cependant, il était intermédiaire à faible connectivité entre les deux branches alignées verticalement au sein d'un tournage, et la connectivité à faible entre les deux branches sur les côtés opposés d'un tournage.
Il n'y avait aucune différence entre les montants de volatiles émises par les branches exposées à HIPVs par rapport à ceux non exposés à HIPVs (figure 12). Toutefois, HIPVs agissent comme signaux externes défensives dans les bleuets. Chenilles de spongieuses nourries sur des feuilles préalablement exposés à HIPVs consommé matériau de feuille 71% moins que ceux nourris avec des feuilles de contrôle non exposés (figure 13). Par ailleurs, des quantités de composés volatils émis par le montant de la surface foliaire consommée dans HIPV exposés branches étaient 4 fois plus élevée par rapport aux branches non exposées (figure 14), indiquant que les feuilles de HIPV ex- branches posées étaient plus sensibles aux herbivores (c'est à dire, ils ont été amorcées).

Figure 1. Un système de push-pull est utilisé pour collecter volatiles provenant des plants de bleuets. Les plantes sont placées à l'intérieur des chambres de verre et l'air propre est passé sur eux. Un filtre contenant un matériau adsorbant est fixée sur le côté de chaque chambre pour volatils émis piège de l'usine. Un vide est utilisée pour aspirer l'air à l'intérieur de la chambre à travers le filtre.
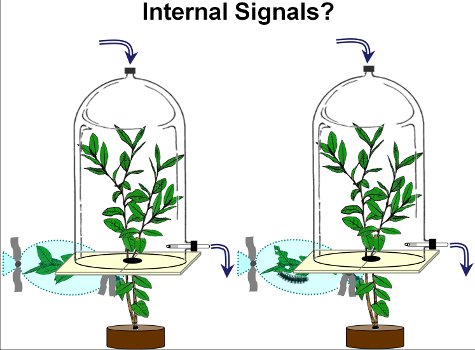
Figure 2. Afin d'étudier la réponse systémique volatils de plants de bleuets, les branches inférieures de bleuets ont été soit endommagées par les chenilles de la spongieuse (à droite de chambre) ou à gauche intact (à gauche de chambre). Après 2 jours (le jour 3), les volatiles à partir intacts branches supérieures de plantes endommagées et non endommagées ont été recueillies.

Figure 3. Pour tester si les feuilles des branches intactes répondre à HIPVs partir de branches endommagées, je ensachées l'une des branches de chacun des plants de bleuets. J'ai ensuite placé les chenilles spongieuse à l'intérieur du sac de la moitié des plantes. Les sacs J'ai utilisé permettre le mouvement de volatiles de l'intérieur vers l'extérieur des sacs. Les plantes ont été placées à l'intérieur des chambres en plexiglas pour exposer les branches intactes au HIPVs. Volatiles ont ensuite été collectées à partir de branches exposées.

Figure 4. Pour tester si les feuilles de branches sont intacts "amorcée" après exposition à HIPVs, des expériences ont été répétées comme décrit dans la figure 3, mais les chenilles de spongieuses ont été placés sur les branches HIPV exposés et non exposés à l'intérieur de chaque chambre de collecte volatiles.
g "alt =" Figure 5 "/>
Figure 5. Après collections volatils, les échantillons sont injectés sur un chromatographe en phase gazeuse (GC) pour identifier et quantifier les composés volatils émis par les plants de bleuets.
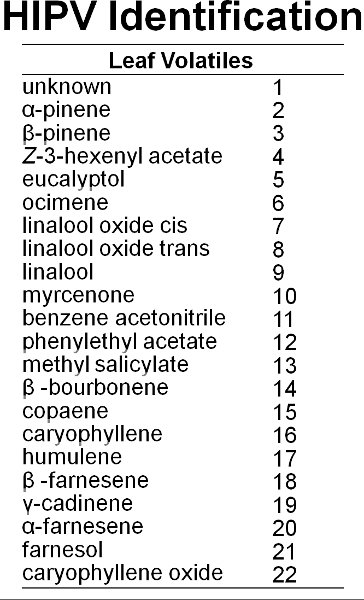
Figure 6. Au moins 22 composés sont émis à partir des feuilles de bleuet.

Figure 7. Chromatographes typiques de bleuets intacts les feuilles et les feuilles endommagées par les chenilles de la spongieuse. Volatiles sont émis à de très faibles quantités de feuilles de bleuets intacts. Toutefois, lorsque les feuilles sont endommagées par les chenilles de la spongieuse, l'émission de substances volatiles ont considérablement augmenté.
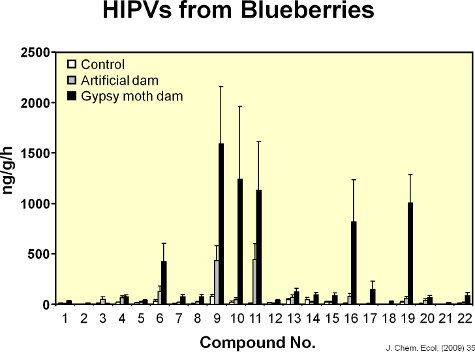
Figure 8. Le graphique montre les quantités de chacun des 22 composés volatils émis par les feuilles intactes, mechanically endommagés par les feuilles et les feuilles endommagées par les chenilles de la spongieuse. Dommages artificielle pour imiter la quantité de surface foliaire enlevé par des chenilles accrue d'émissions volatiles de feuilles de bleuet, mais la réponse a été différente de la réponse volatiles des feuilles pour nourrir la spongieuse.

Figure 9. Testé si la filière JA réglemente les émissions volatiles dans les feuilles de myrtille. Les plantes ont été pulvérisées avec des quantités différentes de MeJa. J'ai constaté que des concentrations croissantes de manière exogène appliqué MeJa augmentation des émissions de composés volatils à partir des feuilles de bleuet.

Figure 10. Le graphique montre les quantités totales de substances volatiles émises par les branches de bleuets de contrôle et de branches intactes à partir de plantes spongieuse endommagé (réponse systémique). Volatiles ont été recueillies pour un auTal de 7 jours consécutifs. Je n'ai pas trouvé d'induction systémique de substances volatiles, même 7 jours après dommage initial à branches inférieures des plantes.
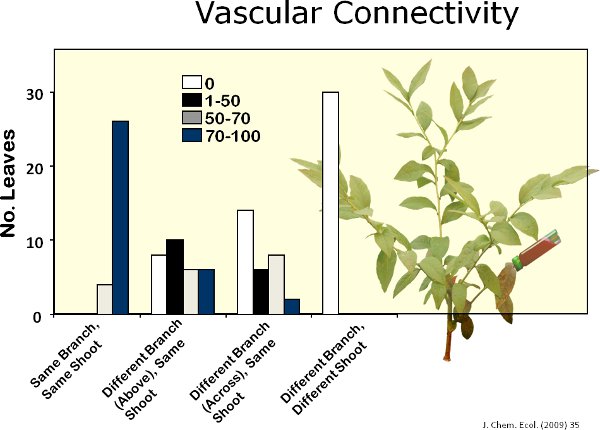
Figure 11. J'ai utilisé la rhodamine B (colorant rouge) pour déterminer le degré de connectivité entre les branches vasculaires dans les plants de bleuets. J'ai constaté que environ. 80%, 20%, 5% et 0% des feuilles des branches contenant le colorant, les branches directement au-dessus de la branche contenant le colorant, succursales à travers la branche contenant un colorant, et les agences situées dans une fusillade différentes au sein d'un plant de bleuet, respectivement, ont été entièrement colorés avec le colorant.

Figure 12. Le graphique montre la quantité de composés volatils émis par les branches exposées à des branches HIPVs et non exposés. J'ai trouvé que l'exposition à HIPVs n'a pas affecté les émissions volatiles dans voiennuyeuses branches de bleuets intacts.

Figure 13. Le graphique montre la quantité de l'alimentation par des chenilles spongieuse sur les branches de bleuets exposés à des branches HIPVs et non exposés. Chenilles sur HIPV exposés branches consommé moins la quantité de feuillage comparés avec ceux sur les branches non exposées.

Figure 14. Quand je calcule le taux d'émission par zone consommé, j'ai trouvé que HIPV exposés succursales a augmenté les taux d'émission de substances volatiles par rapport aux branches non exposées, indiquant que l'exposition à HIPVs amorcée feuilles dans les branches de bleuets pour une réponse plus volatiles.
Discussion
Le push-pull appareil de collecte de volatiles décrit ici représente une méthode standard pour les collections headspace de volatiles des plantes. Cet appareil a été utilisé pour déterminer la réponse volatiles des feuilles de bleuets à l'herbivorie par les chenilles spongieuse et m'a aussi permis de fournir de nouvelles preuves du rôle de HIPVs dans les échanges intra-usine de signalisation.
Les résultats présentés ici montrent que l'alimentation chenille, exogène...
Déclarations de divulgation
Je n'ai rien à divulguer
Remerciements
L'auteur remercie Robert Holdcraft d'assistance technique. Cette étude a été financée en partie par une subvention de l'USDA CSREES spéciaux (2009-34155-19957) et les fonds de trappe (NJ08192).
matériels
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
| Les chambres de collecte volatils | Analytical Systems Research, Inc | VCC-G6X12DT-1P | Gainesville, FL |
| Le compresseur d'air, 20 gal, sans huile, 2 hp | Ouest | 3JR71 | Vendu par Grainger, Inc |
| Système de livraison de l'air | Analytical Systems Research, Inc | VCS-ADS-4AFM4C | Gainesville, FL |
| Système de collecte de l'air | Analytical Systems Research, Inc | VCS-MVC-4CX1P | Gainesville, FL |
| Pompe à vide 100-150V, ¼ HP | Gast Manufacturing, Inc | 4F740 | Vendu par Grainger, Inc |
| Jasmonate de méthyle | Sigma-Aldrich | J2500 | St. Louis, MO |
| Tween-20 | Sigma-Aldrich | 93773 | St. Louis, MO |
| Rhodamine-B | Sigma-Aldrich | St. Louis, MO | |
| Vaporisateurs en plastique, 2 oz | Setco Inc | Cranbury, NJ | |
| Manches en polyester | Opportunités Rockingham Corp | Reidsville, NC | |
| Super-Q pièges collection de volatiles | Analytical Systems Research, Inc | VCT-1/4X3-SPQ | Gainesville, FL |
| Logiciel Scion Image | Scion Corporation | Frederick, MD | |
| Dichlorométhane | Sigma-Aldrich | 270997 | St. Louis, MO |
| Chromatographe HP 6890 | Hewlett Packard | ||
| Chromatographe en phase gazeuse Varian 3400 | Varian | ||
| n-octane | Sigma-Aldrich | 296988 | St. Louis, MO |
| Spectromètre de masse MAT 8230 | Finnigan | San José, Californie | |
| HP-1 colonne de GC | Agilent Technologies | Palo Alto, CA | |
| MDN-5S colonne de GC | Supelco, Inc | Bellefonte, PA |
Références
- Dicke, M., Van Loon, J. J. A. Multitrophic effects of herbivore-induced plant volatiles in an evolutionary context. Entomol. Exp. Appl. 97, 237-237 (2000).
- Mumm, R., Dicke, M. Variation in natural plant products and the attraction of bodyguards involved in indirect plant defense. Can. J. Zool. 88, 628-628 (2010).
- Hopke, J. Herbivore-induced volatiles: the emission of acyclic homoterpenes from leaves of Phaseolus lunatus and Zea mays can be triggered by a β-glucosidase and jasmonic acid. FEBS Lett. 352, 146-146 (1994).
- Rodriguez-Saona, C. Behavioral and electrophysiological responses of the emerald ash borer, Agrilus planipennis, to induced volatiles of Manchurian ash, Fraxinus mandshurica. Chemoecology. 16, 75-75 (2006).
- Rodriguez-Saona, C. Herbivore induced volatiles in the perennial shrub, Vaccinium corymbosum, and their role in inter-branch signaling. J. Chem. Ecol. 35, 163-163 (2009).
- Karban, R. Damage-induced resistance in sagebrush: volatiles are key to intra- and interplant communication. Ecology. 87, 922-922 (2006).
- Frost, C. J. Within-plant signalling by volatiles overcomes vascular constraints on systemic signalling and primes responses against herbivores. Ecol. Lett. 10, 490-490 (2007).
- Heil, M., Bueno Silva, J. C. Within-plant signaling by volatiles leads to induction and priming of an indirect plant defense in nature. Proc. Natl. Acad. Sci. U.S.A. 104, 5467-5467 (2007).
- Turlings, T. C. Exploitation of herbivore-induced plant odors by host-seeking parasitic wasps. Science. 250, 1251-1251 (1990).
- Makovic, I. Volatiles involved in the nonhost rejection of Fraxinus pennsylvanica by Lymantria dispar larvae. J. Agric. Food Chem. 44, 929-929 (1996).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon