Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herbivore-induzierte Blueberry Volatile und Intra-Anlage Signaling
In diesem Artikel
Zusammenfassung
Eine Push-Pull-Methode zur Erfassung von Pflanzen flüchtigen beschrieben. Die Methode ermöglicht einen Vergleich der flüchtigen von herbivore Ernährung, exogene Methyljasmonat und mechanische Schäden induziert. Diese Technik wird auch eingesetzt, um die flüchtigen Antwort des unbeschädigten Niederlassungen um die Exposition gegenüber flüchtigen Stoffen aus Pflanzenfresser beschädigte Zweige innerhalb Blaubeerpflanzen untersuchen.
Zusammenfassung
Herbivore-induzierten Pflanzen volatiles (HIPVs) werden in der Regel aus Pflanzen nach Pflanzenfresser Angriff 1,2 emittiert. Diese HIPVs werden hauptsächlich durch die defensive Pflanzenhormon Jasmonsäure (JA) und seine flüchtigen derivative Methyljasmonat (MeJA) 3,4,5 geregelt. In den letzten 3 Jahrzehnten haben Forscher belegt, dass HIPVs können abstoßen oder anziehen Pflanzenfresser ziehen die natürlichen Feinde der Herbivoren, und in einigen Fällen können sie auslösen oder prime-Anlage Verteidigung vor Pflanzenfresser Angriff. In einem jüngst veröffentlichten Papier 6, berichtete ich, dass das Füttern von Schwammspinner-Raupen, exogene MeJA Anwendung und mechanische Beschädigungen verursachen die Emissionen von flüchtigen Stoffen aus Blaubeerpflanzen, wenn auch anders. Darüber hinaus blueberry Zweige HIPVs aus den benachbarten Zweigen der gleichen Pflanze durch die Anhebung der JA und Widerstand gegen Pflanzenfresser (dh direkte Anlage Verteidigung) emittiert reagieren und durch Priming flüchtige Emissionen (dh indirekte Anlage Abwehrkräfte). Ähnliche findenIngs wurden kürzlich für sagebrush 7, Pappel 8 und Limabohnen 9 gemeldet ..
Hier beschreibe ich einen Push-Pull-Methode für das Sammeln Heidelbeeren volatiles durch Pflanzenfresser (Schwammspinner) Fütterung, exogene MeJA Anwendung und mechanische Schäden induziert. Der flüchtige Sammlung besteht aus einem 4 L flüchtigen Sammelraum, eine 2-teilige Guillotine, einem Luftzufuhr-System, dass einströmende Luft reinigt und mit einem Vakuumsystem verbunden, um eine Falle mit Super-Q Adsorbens gefüllt, um flüchtige Stoffe 5,6,10 sammeln . Volatile in Super-Q-Fallen gesammelt werden mit Dichlormethan eluiert und dann getrennt und quantifiziert mittels Gaschromatographie (GC). Diese flüchtigen Sammlung Methode wurde verwendet, n meinem Studium 6, um die flüchtigen Antwort unbeschädigt Niederlassungen um die Exposition gegenüber flüchtigen Stoffen aus Pflanzenfresser beschädigte Zweige innerhalb Blaubeerpflanzen untersuchen. Diese Methoden werden hier beschrieben. Kurz gesagt, sind unbeschädigt blueberry Zweige HIPVs ausgesetzt herm benachbarten Niederlassungen innerhalb der gleichen Anlage. Mit der gleichen oben beschriebenen Techniken sind flüchtige Stoffe aus Zweigen nach der Exposition gegenüber HIPVs emittiert gesammelt und analysiert.
Protokoll
1. Lokale Induktion von flüchtigen: Pflanzenfresser Schäden
- Zwei Zweige der Heidelbeere Pflanzen werden mit einem gesponnenen Polyester Ärmel eingesackt.
- Sechs Schwammspinner-Raupen (2.-3 instars) sind in den Taschen platziert und darf sich auf Pflanzen für 2 Tage vor der flüchtige Sammlung füttern. Control-Anlagen erhalten keine Raupen.
- Flüchtige Emissionen sind wie folgt (Protokoll Nr. 7) am Tag 3 (Abbildung 1) beschrieben gesammelt. Polyester Ärmel bleiben an Pflanzen, Insekten an der Flucht zu verhindern.
2. Lokale Induktion von flüchtigen: mechanische Beschädigung
- Mechanische Schäden an Pflanzen wird durch Lochen, um die Menge der Blattfläche von Schwammspinner entfernt imitieren zugefügt.
- Fünf Blätter pro Pflanze sind mit zwei 7-mm-Löcher an der Basis und den oberen Teil der Blätter am Ende der Tage 1 und 2 befindet sich verletzt. Die Kontrolle der Behandlung nicht erhalten mechanischer Beschädigung.
- Flüchtige Emissionen erhoben werden, wie unten am Tag 3 beschrieben.
3. Lokale Induktion von flüchtigen: MeJA
- Blueberry Pflanzen werden mit 10 ml entweder eine 1 oder 1,5 mM Lösung von MeJA in einer 0,1% Tween-20-Lösung behandelt.
- MeJA wird mittels einer 2-oz-Sprühflasche. Control-Anlagen sind mit 10 ml einer 0,1% Tween-20-Lösung besprüht.
- Die Pflanzen sind um 16.00 Uhr behandelt und gehalten im Gewächshaus für 15 h in einem 17-cm Durchmesser und 35-cm hohen Plexiglas-Kammer vor der flüchtigen Sammlungen.
- Flüchtige Emissionen erhoben werden, wie unten beschrieben.
4. Systemische Induktion von flüchtigen: interne Signalisierung
- Eine untere Zweig einer Heidelbeere Anlage ist mit einem gesponnenen Polyester Ärmel verpackt und beschädigt, indem sechs (2.-3 instars) Schwammspinner-Raupen in der Tasche.
- Die beschädigten Filiale bleibt außerhalb des flüchtigen Sammelkammer, während die branches über dem beschädigten Branche sind im Inneren der Kammer platziert (Abbildung 2).
- Raupen dürfen auf dem unteren Zweig für 2 Tage zu ernähren.
- Beginnend am Tag 3, sind flüchtige Stoffe aus dem unbeschädigten Teil der beschädigten Pflanzen gesammelt.
- Flüchtige Stoffe werden für 7 aufeinanderfolgende Tage gesammelt. Control-Anlagen sind in ähnlicher Weise behandelt, aber nicht erhalten Pflanzenfresser Schäden.
5. Vascular-Konnektivität
- Diese Studie ermittelt den Grad der vaskulären Konnektivität zwischen verschiedenen Branchen innerhalb einer Heidelbeere Pflanze.
- Der Endabschnitt des unteren Ast aus einer Pflanze wird geschnitten, um ein florales Wasser holen mit 6 ml Lösung eines Rhodamin-B (Sigma-Aldrich) Farbstoff (0,25% w / v), wie in Orians et al unterstützen. 11
- Bewegung des Farbstoffes durch die Anlage ist täglich für 7 Tage überwacht.
- Nach 7 Tagen ist die Menge der roten Färbung visuell von verschiedenen Positionen aus der Anlage beurteilt.
6. Die Exposition gegenüber HIPVs: externe Signalisierung
- Branchen innerhalb einer Anlage sind entweder HIPVs aus einer benachbarten Filiale ausgesetzt oder erhielten keine Exposition gegenüber HIPVs.
- Zur Freilegung Zweige HIPVs, ist eine untere Zweig mit einer Polyester-Schutzhülle und sechs (2.-3 instars) Schwammspinner-Raupen sind Innentaschen (Abbildung 3) platziert eingesackt.
- Die Anlage befindet sich in einem Plexiglas-Kammer ähnlich wie die oben beschriebenen caged. Insekten sind erlaubt, auf Pflanzen für 2 Tage zu ernähren, so dass benachbarte Branchen, um flüchtige Stoffe aus der induzierten Filiale abgegeben werden ausgesetzt.
- Nach der Belichtung (Tag 3), ausgesetzt sind Niederlassungen in den flüchtigen Sammlung Kammer platziert, so dass die Insekten verletzt Niederlassung außerhalb (wie in Abbildung 2 zu sehen).
- Flüchtige aus HIPV ausgesetzten Zweige gesammelt werden, wie unten beschrieben, und die Menge der Blattfläche aus dem unteren Ast konsumiert werden mit Scion Image Software.
7. Die Exposition gegenüber HIPVs: Grundieren
- Um festzustellen, ob Pflanzen "grundiert" nach HIPV der Exposition werden die Pflanzen wie in Protokoll Nr. 5 behandelt.
- Die Hälfte der Pflanzen sind HIPVs von einer induzierten benachbarten Filiale ausgesetzt, während die andere Hälfte ist unbeschädigt Filialen ausgesetzt.
- Am Tag 3, vier frühen 2.-Stadiums Schwammspinner-Raupen sind an jeder Pflanze gelegt und flüchtigen Stoffe werden gesammelt, wie unten beschrieben (Abbildung 4).
- Nach flüchtigen Sammlungen, Blätter zunächst von Schwammspinner-Raupen, sowie diejenigen, die am Tag 3 beschädigt sind beschädigt, werden herausgeschnitten und die Beträge der Blattfläche konsumiert werden gemessen.
8. Sammlung von flüchtigen
- HIPV Emissionen werden im Gewächshaus mit einer Push-Pull-System abgetastet. Der oberirdische Teil der Topfpflanzen (Stamm, Äste und Blätter), einschließlich Raupen in den Pflanzenfresser Schäden Behandlung werden in einem 4 L vola platziertFliesen-Kollektion Kammer. Eine 2-teilige Guillotine unterstützt der Basis von Pflanzen. Gereinigte Luft tritt oben auf jeder Kammer bei einer Rate von 2 L / min.
- Flüchtige Stoffe werden in Fallen mit 30 mg Alltech Super-Q Adsorbens, indem Luft aus den Kammern mit einer Rate von 1 L / min gefüllt gesammelt.
- Der flüchtige Sammlung Apparat besteht aus vier Kammern, so dass für die gleichzeitige Sammlung von flüchtigen Stoffen aus vier verschiedenen Pflanzen (Abbildung 1).
- Sammlungen sind tagsüber von 9.00 bis 17.00 h. durchgeführt
- Nach der Sammlung aller Blätter von Pflanzen geerntet werden, getrocknet bei 60 ° C, und gewogen und Kammern sind mit Leitungswasser und 70% Ethanol gespült.
9. Die Analyse der flüchtigen
- Die gesammelten flüchtigen Stoffen aus Super-Q-Traps werden mit Dichlormethan (150 ul) und 400 ng der n-Oktan als interner Standard zugesetzt eluiert.
- Trennung und Quantifizierung von Verbindungen befindet sich auf einem Hewlett Packard 6890 Series getanGaschromatographen (GC) (Abbildung 5), mit einem Flammenionisationsdetektor (FID) und ausgestattet Agilent HP-1-Säule (10 mx 0,53 mm x 2,65 Mikrometer), und mit He als Trägergas (constant flow = 5 ml / min , Geschwindigkeit = 39 cm / sec). Das Temperaturprogramm bei 40 begonnen ° C für 1 min gehalten, erhöht bei 14 ° C / min auf 180 ° C (2 min), dann bei 40 ° C / min auf 200 ° C und hielt bei 200 ° C für 2 min .
- Vorläufige Identifizierung von Verbindungen wird auf einem Varian 3400 GC gekoppelt mit einem Finnigan MAT 8230 Massenspektrometer (MS), mit einem Supelco MDN-5S-Säule (30 mx 0,32 mm x 0,25 &mgr; m) ausgestattet, und mit He als Trägergas durchgeführt. Die MS ist in Elektronen-Ionisation (EI) und insgesamt (TIC)-Modus bei 250 ° C betrieben (Quelle Temperatur). Das Programm begann um 35 ° C (1 min), erhöhte bei 4 ° C / min auf 170 ° C, dann bei 15 ° C / min bis 280 ° C.
- Verbindungen sind vorläufig durch den Vergleich der spektralen Daten mit denen von NIST-Bibliothek und b identifizierty GC Retentionsindex und durch Vergleich ihrer Retentionszeiten mit denen von kommerziell erhältlichen Präparaten.
10. Repräsentative Ergebnisse:
Zweiundzwanzig flüchtigen Bestandteile aus Heidelbeere Blätter (Abb. 6) identifiziert. Abbildung 7 zeigt ein repräsentatives Chromatogramm der unbeschädigten Heidelbeere Blätter und Blätter durch die Fütterung Schwammspinner beschädigt. Mechanische Schäden und Fütterung von Schwammspinner-Raupen erhöhte flüchtige Emissionen vor Ort aus Heidelbeere Blätter im Vergleich zur Kontrollgruppe (Abbildung 8). Im Vergleich zum Raupe füttern, veranlasste die MeJA Behandlung 11 der 17 Verbindungen, die durch Schwammspinner (Abbildung 9) induziert. Es gab jedoch keine Anzeichen einer systemischen Induktion von flüchtigen Stoffen aus unbeschädigten Blättern der Schwammspinner-geschädigten Pflanzen 7 Tage nach der ersten Fraßschäden (dh mangelnde interne Signalisierung) (Abbildung 10). Darüber hinaus, nach einer Woche, sehr langsam bewegenment des roten Farbstoffes wurde unter Zweigen Blaubeerpflanzen (Abbildung 11) beobachtet. Es gab hohen vaskulären Konnektivität zwischen Blättern in einem einzigen Zweig. Allerdings gab es mittel-bis Low-Konnektivität zwischen zwei Zweige vertikal innerhalb einer Schießerei ausgerichtet und niedrig-Konnektivität zwischen zwei Zweige auf gegenüberliegenden Seiten eines zu schießen.
Es gab keinen Unterschied zwischen Mengen von flüchtigen Stoffen aus Zweigen ausgesetzt HIPVs im Vergleich zu denen nicht HIPVs (Abbildung 12) ausgesetzt emittiert. Allerdings wirken HIPVs als externe defensive Signale in Blaubeeren. Schwammspinner-Raupen auf den Blättern gefüttert zuvor HIPVs verbraucht 71% weniger Blattmaterial als jene gefüttert unbelichteten Kontrolle Blätter (Abbildung 13) ausgesetzt. Darüber hinaus wurden Mengen an flüchtigen pro Menge Blattfläche in HIPV ausgesetzt Niederlassungen verbraucht emittiert 4-fach höher im Vergleich zu unbelichteten Äste (Abbildung 14), was darauf hinweist, dass Blätter von HIPV-ex gestellt Filialen wurden stärker auf Herbivorie (dh, sie wurden grundiert).

Abbildung 1. Eine Push-Pull-System wird verwendet, um flüchtige Stoffe aus Heidelbeeren Pflanzen zu sammeln. Die Pflanzen sind in Glas Kammern gelegt und saubere Luft ist über sie hinweggegangen. Ein Filter mit einem Adsorbens Material wurde auf der Seite der jeweiligen Kammer zu fangen flüchtige Stoffe aus der Anlage emittierten befestigt. Ein Vakuum wird benutzt, um Luft aus dem Inneren der Kammer ziehen durch den Filter.
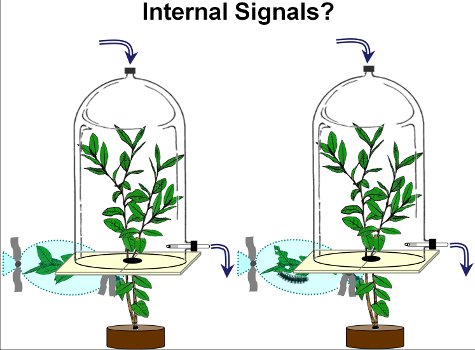
Abbildung 2. Um die systemischen flüchtige Antwort von Blaubeerpflanzen Studie wurden niedrigere blueberry Zweige entweder durch Schwammspinner-Raupen (rechte Kammer) oder links unbeschädigt (linke Kammer) beschädigt. Nach 2 Tagen (am Tag 3), wurden flüchtige Stoffe aus unbeschädigten oberen Zweige aus beschädigten und unbeschädigten Pflanzen gesammelt.

Abbildung 3. Um zu testen, ob Blätter unbeschädigt Zweige HIPVs von beschädigten Äste reagieren, eingesackt ich einen der Zweige in jedem Blaubeerpflanzen. Dann stellte ich Schwammspinner-Raupen in den Taschen der Hälfte der Pflanzen. Die Taschen habe ich eine Bewegung des flüchtigen von innen nach außen von Taschen. Die Pflanzen wurden in Kammern aus Plexiglas aufgestellt, um unbeschädigte Äste HIPVs aussetzen. Flüchtige Bestandteile wurden dann von exponierten Branchen gesammelt.

Abbildung 4. Um zu testen, ob Blätter unbeschädigt Zweige sind "grundiert" nach der Exposition gegenüber HIPVs, Versuche wurden wiederholt, wie in Abbildung 3 beschrieben, aber Schwammspinner-Raupen wurden auf HIPV-belichteten und unbelichteten Niederlassungen in jedem flüchtigen Sammelkammer platziert.
g "alt =" Bild 5 "/>
Abbildung 5. Nach flüchtigen Sammlungen Proben werden auf einem Gaschromatographen (GC) injiziert, um zu identifizieren und zu quantifizieren, die flüchtigen Bestandteile aus Blaubeerpflanzen emittiert.
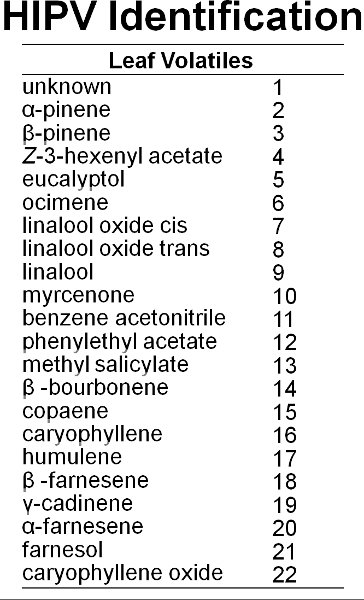
Abbildung 6. Mindestens 22 Verbindungen aus Heidelbeere Blätter abgegeben.

Abbildung 7. Typische Chromatographen aus unbeschädigten Heidelbeere Blätter und Blätter beschädigt Schwammspinner-Raupen. Flüchtige Stoffe werden in sehr geringen Mengen aus unbeschädigten Heidelbeere Blätter abgegeben. Allerdings, wenn Blätter von Schwammspinner-Raupen beschädigt sind, erhöhte Emission von flüchtigen dramatisch.
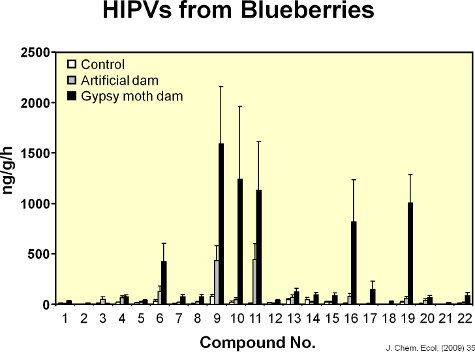
Abbildung 8. Die Grafik zeigt die Mengen von jedem von 22 flüchtigen Stoffen aus unbeschädigten Blättern, m emittiertechanically geschädigten Blätter und Blätter von Schwammspinner-Raupen beschädigt. Künstliche Schäden in Höhe von Blattfläche von Raupen entfernt imitieren erhöhte flüchtige Emissionen aus Heidelbeere Blätter, sondern die Reaktion war anders als die flüchtigen Reaktion der Blätter Schwammspinner Fütterung.

Abbildung 9. Getestet, ob die JA-Weg flüchtigen Emissionen in Heidelbeere Blätter reguliert. Die Pflanzen wurden mit unterschiedlichen Mengen an MeJA gesprüht. Ich fand, dass steigende Konzentrationen von exogen-Anwendung MeJA Emissionen von flüchtigen stieg von Heidelbeere Blätter.

Abbildung 10 dargestellt. Die Grafik zeigt die Gesamtbeträge von flüchtigen Stoffen aus steuern blueberry Äste und Zweige aus unbeschädigten von Schwammspinner beschädigt Pflanzen (systemische Reaktion) emittiert. Flüchtige Bestandteile wurden für einen zu sammelntal von 7 aufeinanderfolgenden Tagen. Ich fand keine systemische Induktion von flüchtigen sogar 7 Tage nach dem ersten Schaden an unteren Zweigen der Pflanzen.
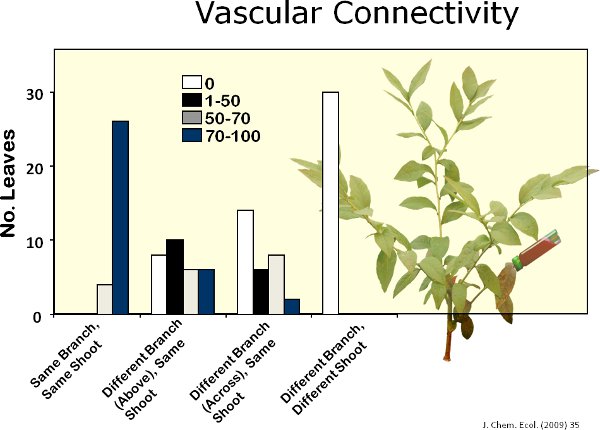
Abbildung 11. Ich Rhodamin-B (roter Farbstoff), um den Grad der vaskulären Konnektivität zwischen Niederlassungen in Blaubeerpflanzen bestimmen. Ich fand, dass ca.. 80%, 20%, 5% und 0% der Blätter von Zweigen, die den Farbstoff, Äste direkt über dem Zweig mit dem Farbstoff, Niederlassungen in der gesamten Branche mit Farbstoff, und Niederlassungen in einem anderen schießen innerhalb einer Heidelbeere Pflanze befindet, wurden jeweils voll mit dem Farbstoff angefärbt.

Abbildung 12. Die Grafik zeigt die Menge an flüchtigen Stoffen aus Zweigen ausgesetzt HIPVs und unbelichteten Filialen abgegeben. Ich fand, dass die Exposition zu HIPVs hatte keinen Einfluss auf flüchtige Emissionen in Nachbarländernlangweilig unbeschädigt blueberry Filialen.

Abbildung 13. Die Grafik zeigt die Menge der Fütterung von Schwammspinner-Raupen auf Heidelbeer-Filialen ausgesetzt HIPVs und unbelichteten Filialen. Raupen auf HIPV ausgesetzt Niederlassungen verbraucht weniger Menge an Laub im Vergleich zu denen auf unbelichteten Filialen.

Abbildung 14. Wenn ich die Emissionsrate pro Fläche verbraucht berechnet, fand ich, dass HIPV ausgesetzt Filialen hatte Emissionsraten von flüchtigen gegenüber unbelichteten Filialen erhöht, was darauf hinweist, dass die Exposition zu HIPVs grundierten Blättern in blueberry Niederlassungen für eine erhöhte flüchtige Antwort.
Diskussion
Die Push-Pull-flüchtige Sammlung hier beschriebenen Apparatur stellt eine standardisierte Methode für Headspace-Sammlungen pflanzengenetischer volatiles. Dieses Gerät wurde verwendet, um die flüchtigen Reaktion der Heidelbeere Blätter Herbivorie von Schwammspinner-Raupen bestimmen und auch mir erlaubt, neue Beweise für die Rolle des HIPVs in innerbetrieblichen Signalisierung bieten.
Die hier vorgestellten Ergebnisse zeigen, dass Raupe füttern, exogen-Anwendung MeJA und mechanische Ver...
Offenlegungen
Ich habe nichts zu offenbaren
Danksagungen
Der Autor dankt Robert Holdcraft für die technische Unterstützung. Diese Studie wurde teilweise durch einen USDA CSREES Spezielle Grant (2009-34155-19957) und Luke Fonds (NJ08192) finanziert.
Materialien
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| Volatile Sammelkammern | Analytical Research Systems, Inc. | VCC-G6X12DT-1P | Gainesville, FL |
| Air Kompressor, 20 gal, ölfrei, 2 PS | Nach Westen | 3JR71 | Verkauft von Grainger, Inc. |
| Air Liefersystem | Analytical Research Systems, Inc. | VCS-ADS-4AFM4C | Gainesville, FL |
| Air Sammelsystem | Analytical Research Systems, Inc. | VCS-MVCS-4CX1P | Gainesville, FL |
| Vakuumpumpe 100-150V, ¼ PS | Gast Manufacturing, Inc. | 4F740 | Verkauft von Grainger, Inc. |
| Methyljasmonat | Sigma-Aldrich | J2500 | St. Louis, MO |
| Tween-20 | Sigma-Aldrich | 93773 | St. Louis, MO |
| Rhodamin-B | Sigma-Aldrich | St. Louis, MO | |
| Plastic Sprühflaschen, 2 Unzen | Setco Inc. | Cranbury, NJ | |
| Spun Polyester Ärmel | Rockingham Opportunities Corp | Reidsville, NC | |
| Super-Q flüchtige Sammlung Fallen | Analytical Research Systems, Inc. | VCT-1/4X3-SPQ | Gainesville, FL |
| Scion Image Software | Scion Inc. | Frederick, MD | |
| Dichlormethan | Sigma-Aldrich | 270997 | St. Louis, MO |
| Gaschromatograph HP 6890 | Hewlett Packard | ||
| Gaschromatograph Varian 3400 | Varian | ||
| n-Octan | Sigma-Aldrich | 296988 | St. Louis, MO |
| Massenspektrometer MAT 8230 | Finnigan | San Jose, CA | |
| HP-1 GC-Säule | Agilent Technologies | Palo Alto, CA | |
| MDN-5S GC-Säule | Supelco, Inc. | Bellefonte, PA |
Referenzen
- Dicke, M., Van Loon, J. J. A. Multitrophic effects of herbivore-induced plant volatiles in an evolutionary context. Entomol. Exp. Appl. 97, 237-237 (2000).
- Mumm, R., Dicke, M. Variation in natural plant products and the attraction of bodyguards involved in indirect plant defense. Can. J. Zool. 88, 628-628 (2010).
- Hopke, J. Herbivore-induced volatiles: the emission of acyclic homoterpenes from leaves of Phaseolus lunatus and Zea mays can be triggered by a β-glucosidase and jasmonic acid. FEBS Lett. 352, 146-146 (1994).
- Rodriguez-Saona, C. Behavioral and electrophysiological responses of the emerald ash borer, Agrilus planipennis, to induced volatiles of Manchurian ash, Fraxinus mandshurica. Chemoecology. 16, 75-75 (2006).
- Rodriguez-Saona, C. Herbivore induced volatiles in the perennial shrub, Vaccinium corymbosum, and their role in inter-branch signaling. J. Chem. Ecol. 35, 163-163 (2009).
- Karban, R. Damage-induced resistance in sagebrush: volatiles are key to intra- and interplant communication. Ecology. 87, 922-922 (2006).
- Frost, C. J. Within-plant signalling by volatiles overcomes vascular constraints on systemic signalling and primes responses against herbivores. Ecol. Lett. 10, 490-490 (2007).
- Heil, M., Bueno Silva, J. C. Within-plant signaling by volatiles leads to induction and priming of an indirect plant defense in nature. Proc. Natl. Acad. Sci. U.S.A. 104, 5467-5467 (2007).
- Turlings, T. C. Exploitation of herbivore-induced plant odors by host-seeking parasitic wasps. Science. 250, 1251-1251 (1990).
- Makovic, I. Volatiles involved in the nonhost rejection of Fraxinus pennsylvanica by Lymantria dispar larvae. J. Agric. Food Chem. 44, 929-929 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten