Method Article
Caracterización electrofisiológica de las buenas prácticas agrarias que expresan las poblaciones de células en la retina intacta
En este artículo
Resumen
Este artículo describe la grabación de las células individuales de marcado con fluorescencia poblaciones neuronales en la retina del ratón intacto. Mediante el uso de excitación de dos fotones infrarrojos células transgenetically etiquetado fueron objeto de grabación de patch-clamp para estudiar la luz de sus respuestas, las propiedades de campo receptivo, y la morfología.
Resumen
El estudio de las propiedades fisiológicas y las conexiones sinápticas de neuronas específicas en el tejido intacto es un reto para las células que carecen de características morfológicas visibles, o mostrar una baja densidad de población. Esto se aplica particularmente a la retina las células amacrinas, una clase excepcional multiforme de las interneuronas que comprenden aproximadamente 30 subtipos de los mamíferos 1. A pesar de ser una parte crucial del procesamiento visual de la configuración de la salida de la retina 2, la mayoría de estos subtipos no se han estudiado hasta ahora en un contexto funcional, porque encontrar estas células con un electrodo de registro es un evento raro.
Recientemente, una multitud de líneas de ratones transgénicos que expresan está disponible fluorescentes marcadores como la proteína verde fluorescente (GFP) bajo el control de los promotores de los receptores de membrana o las enzimas que son específicas de sólo un subconjunto de neuronas en un determinado tejido 3,4. Estas células pre-etiquetados, por lo tanto accessible para microelectrodos dirigida dirigidos bajo control microscópico, lo que permite el estudio sistemático de sus propiedades fisiológicas in situ. Sin embargo, la excitación de los marcadores fluorescentes es acompañado por el riesgo de fototoxicidad para el tejido vivo. En la retina, este enfoque es además obstaculizada por el problema de que la luz de excitación causa una estimulación adecuada de los fotorreceptores, por lo tanto causando fotopigmento blanqueo y la transferencia de los circuitos de la retina en una condición de luz adaptadas. Estos inconvenientes se superan mediante el uso de la excitación por infrarrojos dictada por un modo bloqueado en pulsos cortos de láser de la gama de femtosegundo. De excitación de dos fotones proporciona la energía suficiente para la excitación fluoróforo y al mismo tiempo que restringe la excitación en un pequeño volumen de tejido minimizando los riesgos de daño solar 5. Además, deja en la retina sensible a los estímulos visuales ya que la luz infrarroja (> 850 nm) sólo se absorbe mal por fotopigmentos 6.
en las grabaciones in situ de las buenas prácticas agrarias-que expresan las células que son visualmente el blanco de dos fotones de excitación. La retina está preparado y mantenido en la oscuridad y pueden ser sometidos a estímulos ópticos que se proyectan a través del condensador del microscopio (Figura 1). Patch-clamp grabación de las respuestas de la luz puede ser combinado con un tinte de relleno para revelar la morfología y para comprobar si hay diferencias unión mediada tinte de acoplamiento a las células vecinas, de modo que la célula diana puede por estudiar en diferentes niveles de experimentación.
Protocolo
La descripción siguiente se supone que el experimentador tiene una comprensión básica de la estructura de la retina, grabación de patch-clamp, y la microscopia de dos fotones. Para obtener información útil en el establecimiento y ejecución de una instalación de patch-clamp y dos fotones sistema de imagen ver Refs [7-12].
1. Animales y preparación de tejidos
- Mantenga ratón adaptada a la oscuridad durante al menos 3 h. Mientras tanto, prepare 2.1 l de la solución extracelular formado por (en mM) 125 NaCl, 2,5 KCl, 1 CaCl 2, 1,6 MgCl 2, 25 NaHCO 3, 10 D-glucosa y equilibrar a un pH de 7,4 por gaseamiento con carbogen (5% de CO 2 en O 2) a temperatura ambiente. un
- Practicar la eutanasia con el ratón en una cámara hermética de CO 2 sobredosis seguido por dislocación cervical. Este procedimiento y los pasos siguientes se deben realizar en la oscuridad. Use poca longitud de onda larga de iluminación (que bloquean longitudes de onda corta a partir de una fuente de luz fría por un 690 nm-longpass de filtro) para apoyar la visión personal, manteniendo los ojos del animal adaptado a la oscuridad (los ratones sólo tienen una visión pobre en la parte roja del espectro de luz). Para trabajar en la iluminación completa oscuridad el uso de infrarrojos (> 800 nm) y el desgaste gafas de visión nocturna.
- Ojos enucleación con un par de tijeras curvas iris y transferirlos a un plato de la solución extracelular colocado bajo un microscopio de disección.
- Quitar la córnea y cuerpo ciliar mediante la apertura de la bombilla ojo a lo largo de la ora serrata (la frontera entre la retina y el cuerpo ciliar) con un par de tijeras de primavera (que utiliza por primera vez una lanceta para perforar un punto de partida para el corte). Sacar la lente y separar cuidadosamente la retina del epitelio pigmentario. Si la orientación de la retina es crucial para su estudio, indican que, como en la Ref. [12]. Cortar el nervio óptico entre la retina y el epitelio pigmentario de la retina y retirar de la ojera. Tenga en cuenta la dirección de las superficies de la retina: el interior de la retina enrollado es el Gangllado de iones de la célula, el exterior es el lado de los fotorreceptores.
- Eliminar el vítreo de la superficie de la retina interna, tirando de él apagado con la ayuda de un palillo de madera. Para ello, utilice una pequeña cantidad de solución extracelular que sólo cubre la retina. Los palos del vítreo al palillo de dientes y pueden ser arrastrados por centrifugación de la retina. A continuación, aplicar incisiones pequeñas a lo largo del perímetro de la retina para facilitar el aplastamiento de los tejidos.
- Transferencia de la retina en la cámara de grabación de los fotorreceptores hacia abajo, lo extendió sobre el fondo de cristal (se utiliza un pincel fino) e inmovilizarlo con un marco de nylon colgados de acero inoxidable. Prepare la retina segundo de la misma forma y mantenerlo adaptado a la oscuridad en la solución carboxygenated extracelular para su uso posterior.
2. Grabaciones
- Instale la cámara de grabación en la oscuridad con un microscopio láser de escaneo vertical y superfuse la preparación de retina en forma continua (no menos de 5 ml / min) con la solución extracelular carboxygenated calienta a 35 ° C. El microscopio (también equipado con una cámara sensible al infrarrojo CCD) se encuentra en un amortiguador de aire dentro de la tabla una jaula de Faraday para la protección electrónica. Cubrir la jaula con una cortina no transparente para mantener la preparación en la oscuridad. También fuera de la pantalla la luz de los monitores de ordenador por una película transparente de color rojo.
- Ajustar el láser infrarrojo a 850-870 nm o más longitudes de onda, cambiar a modo bloqueado condición y uso de dos fotones de excitación para visualizar las células que expresan GFP. Atenuar la salida del láser utilizando filtros de densidad neutra controlado por el software de escaneo láser de hasta un grado que apenas es suficiente para el reconocimiento claro de la célula fluorescente
- De patch-clamp grabaciones en micropipetas actual-clamp modo de uso de vidrio (que utilizan tubos de vidrio de borosilicato de 1,5 mm de diámetro exterior y espesor de pared de 0,225 mm) lleno de solución intracelular formado por (en mM) 125 K-gluconato, 10 de KCl, 0,5 EGTA, 10 HEPES, pH a 7,4 con KOH (dando una resistencia pipeta de alrededor de 5 MW). Tenga en cuenta que otras condiciones experimentales como la grabación de voltaje-clamp requiere una solución diferente. Si las inyecciones de colorante se desea, agregue una sonda fluorescente (usamos 10 mM Alexa Fluor 594) o una molécula trazadora (3% Neurobiotin). Inserte la micropipeta en el soporte y asegúrese de que el electrodo de referencia (hilo de plata clorada) está en contacto con la solución extracelular en la cámara de grabación.
- Aplique presión a la micropipeta y un objetivo que expresan GFP de células (se utiliza un objetivo de 40 veces el agua de inmersión; NA 1,25). Cuerpos de células amacrinas se encuentran en la capa de células ganglionares (justo debajo de la superficie en la orientación actual de la retina), así como en la parte proximal de la capa nuclear interna (alrededor de 55-75 micras de profundidad dentro de la preparación). Antes de ponerse en contacto con la micropipeta célula objetivo, la membrana limitante interna (una funda hecha de endfeet gliales) en la retinala superficie tiene que ser penetrado. Penetración exitosa es reconocido por la solución intracelular que es expulsado de la punta de la micropipeta y se desprende de la membrana limitante interna del tejido retiniano subyacente como puede observarse en una imagen de la transmisión por infrarrojos capturado por la cámara CCD-IR.
- Acercarse a la celda deseada mediante la comparación de la posición de soma de la imagen de dos fotones con la imagen de la cámara CCD IR-que muestra la posición de la micropipeta de grabación. Tenga en cuenta que este paso no es fácil de lograr y requiere algo de práctica, porque las células que expresan GFP tiene que ser reconocido en la transmisión de imágenes por infrarrojos con el fin de dirigir la micropipeta hacia ella. Orientación correcta se consigue cuando la punta de la micropipeta provoca hundimientos en la superficie celular que se puede ver en la imagen de dos fotones. Alternativa a este procedimiento, utilice un colorante fluorescente (por ejemplo, Alexa Fluor 594, 100 mM) en la solución intracelular para revelar la posición micropipeta en la imagen de dos fotones. De excitación de dos fotones infrarrojos permite la fluorescencia suficiente de este medio de contraste para hacer que la micropipeta discernible. Para ello, ajuste el rango de detección del software de escaneo láser para abarcar también fluorescencia de color rojo.
- Liberar la presión de la micropipeta y obtener un conjunto de células patch-clamp de configuración en modo de corriente-clamp. Una grabación utilizable debe dar un potencial de membrana de -50 a -55 mV y una duración de al menos 20 min.
- Presentar estímulos visuales creado por un software de estimulación (usamos QDS por Thomas Euler, de la Universidad de Tübingen, Alemania), 11 en un monitor de computadora. Ajustar la posición espacial de la estimulación que se centra en la celda registrado: Marque la posición de la célula en el monitor muestra la imagen de la transmisión de la cámara IR-CCD y un centro de estímulo terreno como en la misma. Ajustar la intensidad del estímulo mediante la inserción de filtros de densidad neutra en la trayectoria del haz. Para la calibración del monitor de espectro y la intensidad de ver Ref. [14]. Elegir un Prolonged interestímulo intervalo (por ejemplo, 15 s) para evitar la adaptación. Incluyen un fotodiodo en la trayectoria del haz de llevar un registro de los tiempos de estímulo.
- Iniciar el protocolo de estimulación y registrar las respuestas de la luz (se utiliza una frecuencia de muestreo de 10 kHz con el filtrado a 5 kHz para no clavar las células, para la grabación de pico de una frecuencia de muestreo 20 kHz más alto como se recomienda). Utilice el software de estimulación de la luz para activar el software de grabación.
- Para el tinte de llenado permiten la difusión del agente fluorescente en las células registrado durante 30-45 minutos antes de la retracción de la micropipeta con cuidado de la célula. Tenga cuidado de no sacar el cuerpo de la célula. Si el marcador no fluorescente Neurobiotin fue utilizado, es necesario la visualización mediante la unión a la estreptavidina conjugada con un fluoróforo (usamos estreptavidina-Cy3, 1:400 durante la noche a 4 ° C después de 20 min paraformaldehído fijación de la retina, para el tinte de acoplamiento estudios de incubación estreptavidina se puede prolongar hasta 3 d). Por otra parte, las inyecciones también se puede realizar conelectrodos aguda (> 100 MW) cuando el medio es conducido a la celda iontoforética empalado (pulsos rectangulares: 0,25-1 nA, 100 ms, el intervalo de 100 ms, el tiempo total 3-6 min).
3. Los resultados representativos:
Los siguientes resultados proceden de un estudio de un ratón que expresa la proteína verde fluorescente (GFP) bajo el promotor de la tirosina hidroxilasa 13,14, la enzima que cataliza el paso limitante en la síntesis de catecolaminas (TH:: GFP ratón). En función del brillo de la señal de las buenas prácticas agrarias y dos poblaciones de células diferenciadas se distinguen (Figura 2A). Las células que expresan el nivel de las buenas prácticas agrarias más alto poseen los cuerpos celulares situados en la capa nuclear interna (INL, Figura 2A) o desplazados en la capa de células ganglionares (GCL, Figura 2B) y estratificar en el centro de la capa plexiforme interna (IPL, Figura 2 C) . Fueron identificados como de tipo 2 células 14-16 y sistemática podría ser estudiados con respecto a la morfología (Figura 3) y elegiractividad Rical (Figura 4) a pesar de su densidad de población sólo llega a 250 células / mm 2.

Figura 1. Representación esquemática de la instalación experimental. Excitación de dos fotones (camino de luz roja punteada) de fluoróforo células que expresan en la retina intacta permite visual dirigidos por una micropipeta (emisión verde trayectoria de la luz). La retina es sometido a estímulos ópticos proyectados a través del condensador del microscopio (paso de luz amarilla), y la respuesta celular de luz se registran.
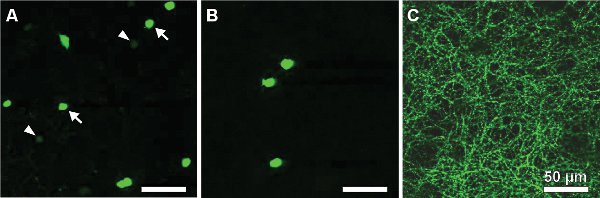
Figura 2. GFP-células que expresan en un flatmount la retina de un TH:: GFP ratón. Dos poblaciones se pueden distinguir por el brillo de la señal de las buenas prácticas agrarias: tipo 1 (células DA), ubicado en el INL que presentan una fluorescencia débil (A, ver las puntas de flecha) y el tipo de intensidad que marca 2 célulascon cuerpos de las células, ya sea en el INL (A, ver las flechas) o desplazados en el GCL (B) y una estratificación dendríticas en el estrato S3 de la IPL (C). Las barras de escala, de 50 micras.
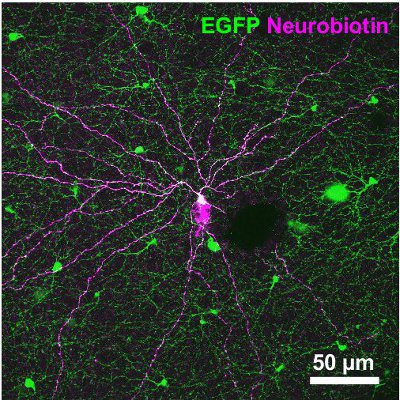
Figura 3. Morfología de un tipo 2 células inyectadas con la Neurobiotin marcador. El marcador fue posteriormente visualizadas por estreptavidina-Cy3 vinculante (magenta). La micrografía, que también se representa la señal de GFP (verde), es una proyección de imagen que cubre las pilas de la CGT y la IPL. Barra de escala, de 50 micras.
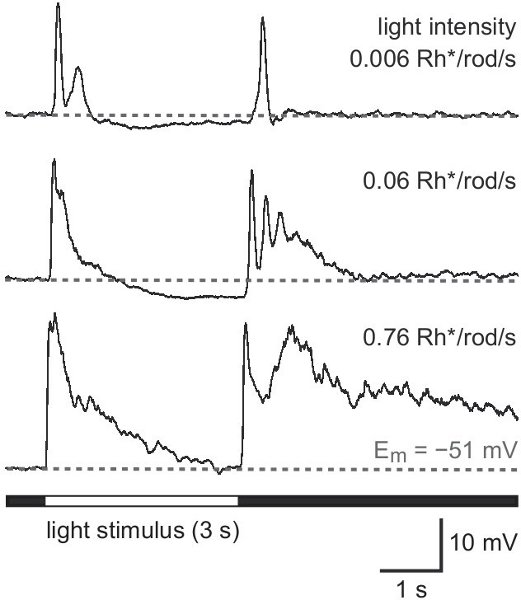
Figura 4. La luz de las respuestas de tipo 2 celda ubicada en la GCL. Respuesta patrón de luz blanca todo el campo de iluminación de intensidad creciente en el rango de escotópica. La intensidad del estímulo se da en photoisomerizations por varilla por segundo (Rh * / barra / s). Un estímulo prolongado de 3 s se utiliza para mejorar distintosiones de los componentes de la respuesta al inicio del estímulo (respuesta en ON) y desplazamiento (OFF respuesta).
Discusión
Este método ofrece la posibilidad de estudiar las propiedades eléctricas de neuronas específicas en la retina intacta bajo la guía visual, sin influir en el estado de adaptación de la retina. Es especialmente adecuado para la caracterización de las células que están en la actualidad en vez poco estudiada debido a la baja densidad de población como la mayoría de las poblaciones de células amacrinas. De dos fotones de excitación permite alta resolución y alto contraste de imagen, incluso de las partes más profundas del tejido 17, un requisito previo para mayor precisión y éxito de patch-clamp de células en particular en el INL con su alta densidad de los cuerpos celulares.
La retina del ratón aislado es viable para 3-4 h en las condiciones experimentales. Si la retina segunda se almacena en la oscuridad bajo carbogen gas continua, mantiene el color púrpura de fotopigmento crudo y se puede utilizar después de terminar los experimentos con la retina en primer lugar. En un principio, el objetivocelda seleccionada con la micropipeta en el wholemount la retina es un poco difícil y requiere algo de práctica, especialmente cuando se trabaja en la oscuridad. Incluyendo un tinte fluorescente en la micropipeta se puede simplificar el procedimiento, porque las células y micropipeta son visibles bajo la excitación de dos fotones, al mismo tiempo. Sin embargo, la adición de componentes de la solución intracelular puede impedir la formación de gigaseal o hacer que la calidad de la grabación a sufrir. Una vez alcanzado con éxito, una buena grabación puede durar alrededor de 1 h.
Mientras que la luz de excitación infrarroja es en sí mismo sólo absorbe poco por fotorreceptores de la retina, emocionado GFP-que expresan las células emiten luz en la parte visible del espectro. Sin embargo, fluoróforos están entusiasmados sólo en un pequeño volumen de actividad que no es probable que cambie la condición de adaptación de la retina. Aún más, la excitación sólo es necesario para la selección y puede ser apagado durante la grabación de las respuestas de la luz.
El usefulnceso de este enfoque es que ya han demostrado estudios en poblaciones específicas de células amacrinas 14,18 de la cual los registros electrofisiológicos de lo contrario hubiera sido posible sólo por accidente 12. Por último, esta técnica de gran alcance se puede ampliar aún más mediante la inclusión de un enfoque farmacológico 14, Ca 2 + de imágenes de 19 o mediante el uso de las células inyectadas para los estudios de inmunohistoquímica o microscopía electrónica. De esta manera, la posición funcional de un tipo de célula en el circuito de la retina puede ser descifrado.
Divulgaciones
Los ratones fueron manipulados y sacrificados de acuerdo con las directrices institucionales para el bienestar de los animales y las leyes sobre experimentos con animales emitidos por el gobierno alemán.
Agradecimientos
Este trabajo fue apoyado por la Deutsche Forschungsgemeinschaft (WE849/16 1 / 2 a KD y RW). Damos las gracias a Thomas Euler (Töbingen, Alemania) para el software QDS luz estimulación.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo / Equip-ción | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Gafas de visión nocturna | Gutzeit GmbH, Warthausen, Alemania | Xtron F1 | incluye una fuente de luz de 800 nm |
| Filtro óptico | Schott, Mainz, Alemania | RG9 | paso largo con filtro de corte de 690 nm |
| Iris tijeras | Herramientas de Bellas Ciencia | 14061-09 | curva con hoja de 22 mm |
| Primavera tijeras | Herramientas de Bellas Ciencia | 15000-00 | recta con hoja de 3 mm |
| Grabación de la cámara | Luigs y Neumann GmbH, Ratingen, Alemania | 2-100 500 0180 tipo A (TC) | Teflon cámara con deslizamiento montada abajo cubierta de vidrio (aprox. 0,15 mm, N º 2-100 500 0182) |
| El flujo del calentador | Sistemas multicanal, Reutlingen, Alemania | PH01, TC01 | cánula de perfusión climatizada con la temperatura scontrolador de Ensor y la temperatura |
| Microscopio de barrido láser | Leica Microsystems | DM LFS | controlados por Leica Confocal Software |
| Aire mesa | Newport | VH 3036W-OPT | |
| Láser | Spectra-Physics | En modo bloqueado tsunami Ti: zafiro láser | |
| CCD de la cámara | pco AG, Kelheim, Alemania | PixelFly QE | incluyendo el software de control |
| Micropipeta capilares de vidrio | Hilgenberg, Malsfeld, Alemania | 1408411 | |
| Micropipeta extractor | Sutter instrumento | P-97 | |
| Alexa Fluor 594 | Invitrogen | A-20004 | colorante fluorescente |
| Neurobiotin | Axxora | VC-SP-1120-M050 | no fluorescente marcador |
| Estreptavidina-Cy3 | Dianova | 016-160-084 | |
| Micromanipulator | Luigs y Neumann GmbH, Ratingen, Alemania | 210-100 000 0010 | motorizados Mini25 unidad manipulador con pantalla SM-5 |
| Patch-clamp amplificador | npi electronic GmbH, Tamm, Alemania | SEC-05LX npi | |
| Digitalizador | National Instruments | BNC-2090 | |
| De adquisición de datos de software WinWCP | John Dempster, de la Universidad de Escocia, Glasgow, Reino Unido | http://spider.science.strath. ac.uk / sipbs / software.htm | |
| Visual QDS estímulo generador | Thomas Euler, de la Universidad de Tübingen, Alemania | tiene que ser operado en un equipo distinto el control de dos monitores (interfaz de usuario, el estímulo del monitor) | |
| Filtros de densidad neutra | ITOS, Mainz, Alemania |
Referencias
- Masland, R. H. The fundamental plan of the retina. Nat. Neurosci. 4, 877-886 (2001).
- Baccus, S. A. Timing and computation in inner retinal circuitry. Annu. Rev. Physiol. 69, 271-290 (2007).
- Haverkamp, S., Inta, D., Monyer, H., Wässle, H. Expression analysis of green fluorescent protein in retinal neurons of four transgenic mouse lines. Neuroscience. 160, 126-139 (2009).
- Siegert, S., Gross-Scherf, B., Del Punta, K., Didkovsky, N., Heintz, N., Roska, B. Genetic address book for retinal cell types. Nat. Neurosci. 12, 1197-1204 (2009).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Euler, T., Detwiler, P. W., Denk, B. Directionally selective calcium signals in dendrites of starburst amacrine cells. Nature. 418, 845-852 (2002).
- Sakmann, B., Neher, E. Single-Channel Recording. , Plenum Press. (1995).
- Jackson, M. B. Whole-cell voltage clamp recording. Current Protocols in Neuroscience. Gerfen, C. , Wiley. (1997).
- Majewska, A., Yiu, G., Yuste, R. A custom-made two-photon microscope and deconvolution system. Pfügers Arch. - Eur. J. Physiol. 441, 398-408 (2000).
- Yuste, R., Konnerth, A. maging in Neuroscience and Development: A Laboratory Manual. , Cold Spring Harbor Laboratory. (2005).
- Euler, T., Hausselt, S. E., Margolis, D. J., Breuninger, T., Castell, X., Detwiler, P. B., Denk, W. Eyecup scope - optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Arch. - Eur. J. Physiol. 457, 1393-1414 (2009).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nat. Protoc. 5, 1347-1352 (2010).
- Matsushita, N., Okada, H., Yasoshima, Y., Takahashi, N., Kiuchi, K., Kobayashi, K. Dynamics of tyrosine hydroxylase promoter activity during midbrain dopaminergic neuron development. J. Neurochem. 82, 295-304 (2002).
- Knop, G. C., Feigenspan, A., Weiler, R., Dedek, K. Inputs underlying the ON-OFF light responses of type 2 wide-field amacrine cells in TH-GFP mice. J. Neurosci. 31, 4780-4791 (2011).
- Zhang, D. Q., Stone, J. F., Zhou, T., Ohta, H., McMahon, D. G. Characterization of genetically labeled catecholamine neurons in the mouse retina. Neuroreport. 15, 1761-1765 (2004).
- Contini, M., Lin, B., Kobayashi, K., Okano, H., Masland, R. H., Raviola, E. Synaptic input to ON-biploar cells onto the dopaminergic neurons of the mouse retina. J. Comp. Neurol. 518, 2035-2050 (2010).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat. Methods. 2, 932-940 (2005).
- Dedek, K., Breuninger, T., de Sevilla Müller, L. P., Maxeiner, S., Schultz, K., Janssen-Bienhold, U., Willecke, K., Euler, T., Weiler, R. A novel type of interplexiform amacrine cell in the mouse retina. Eur. J. Neurosci. 30, 217-228 (2009).
- Denk, W., Detwiler, P. B. Optical recording of light-evoked calcium signals in the functionally intact retina. Proc. Natl. Acad. Sci. U.S.A. 96, 7035-7040 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados