Method Article
無傷の網膜におけるGFP発現細胞集団の電気生理学的特性
要約
この記事は、そのままマウスの網膜における蛍光標識神経集団から個々のセルの記録を示しています。二光子赤外線励起を使用してtransgenetically標識された細胞は、それらの光反応、受容野の特性、及び形態を研究するためのパッチクランプ記録を対象としていた。
要約
無傷の組織内の特定の神経細胞の生理学的特性とシナプス結合を研究することは顕著な形態的特徴を欠いたり、低人口密度を示すこれらの細胞のための挑戦である。これは、特に網膜アマクリン細胞、哺乳類1で約30のサブタイプを構成する介在ニューロンの非常に多形のクラスに適用されます。記録電極と、これらの細胞に遭遇することはまれな事象であるため、網膜出力の2を形成することによって視覚処理の重要な一部であるものの、これらのサブタイプのほとんどは、機能的なコンテキストでこれまで検討されていない。
最近、トランスジェニックマウス系統の多数は、特定の組織3,4の神経細胞のサブセットだけに固有の膜受容体や酵素のプロモーターの制御下に緑色蛍光タンパク質(GFP)のような蛍光マーカーを発現することが可能です。これらの事前に標識された細胞は、それゆえaccessiblですその場でそれらの生理学的特性の体系的研究を可能にして、微細な制御下で標的指向微小電極への電子。しかし、蛍光マーカーの励起は、生体組織のための光毒性の危険性を伴っている。網膜では、このアプローチはさらに、励起光は、このように明順応状態に網膜回路を漂白し、転送する光色素を被らせる、光受容体の適切な刺激を引き起こすという問題によって妨げられている。これらの欠点は、フェムト秒領域の短パルスのモード同期レーザーによって提供される赤外励起を使用することによって克服される。二光子励起は、蛍光体の励起のための十分なエネルギーを提供すると同時に、光損傷5の危険性を最小限に抑え、小さな組織のボリュームへの励起を制限します。赤外光を(> 850 nm)の唯一の悪いphotopigments 6によって吸収されるためにも、それは視覚刺激に応答網膜を残します。
場の録音で電気生理学的達成するためにトランスジェニックマウスの網膜の使用方法を示す。網膜が準備され、暗闇の中で維持され、顕微鏡のコンデンサー(図1)を介して投影される光の刺激に供することができるさ。光反応のパッチクランプ記録は、色素が形態を明らかにし、標的細胞がによって異なる実験的なレベルで検討できるように、隣接するセルに結合するギャップジャンクションを介した色素をチェックするための充填と組み合わせることができます。
プロトコル
以下の説明では、実験者は網膜構造、パッチクランプ記録、および二光子顕微鏡の基本的な理解を持っていることを前提としています。パッチクランプのセットアップと2光子イメージングシステムを確立し、実行する上で有用な情報については文献[7-12]を参照してください。
1。動物と組織の準備
- マウスは、少なくとも3時間暗順応してくださいcarbogenと処刑によってそれまでの間、から成る細胞外溶液の1〜2リットル(mMで)125のNaCl、2.5 KClを、1のCaCl 2、1.6のMgCl 2、25飽和NaHCO 3、10 D -グルコースを準備し、pH7.4にそれを平衡化(5%O 2でCO 2)室温で。 a
- 頸椎脱臼に続いてCO 2過剰投与によって気密チャンバー内にマウスを安楽死させる。この手順と次の手順は、暗闇の中で実行する必要があります。暗く長い波長の照明を使用して(我々は690 nmのlongpasによる冷光源から短い波長をブロックする動物の目は(マウスは光のスペクトルの赤色部分で視力を持つ)暗順応に保ちながらのフィルタが)個人的なビジョンをサポートする。完全な暗闇での作業のために赤外線照明を使用してください(> 800 nm)と暗視ゴーグルを着用してください。
- 除核するには、湾曲した虹彩のハサミで目と解剖顕微鏡下に置かれ、細胞外液の皿に移す。
- 春のはさみとORAのコナラ(網膜や毛様体の間の境界)(我々が最初に穴を開けるためにカットするための出発点をランセットを使用する)に沿って目の電球を開いて、角膜や毛様体を取り外します。レンズを取り出し、慎重に色素上皮から網膜を分離。網膜の向きは自分の研究に重要な意味を持つ場合、それは文献[12]などを示している。網膜と色素上皮との間の光学的神経を切断し、アイカップから網膜を削除します。網膜表面の方向に注意してください:カールアップ網膜の内側にはganglですイオンのセル側、外側は、感光体の側です。
- そっと木のつまようじの助けを借りてそれを引っ張って、内側の網膜表面から硝子体を取り除きます。この目的のために、ちょうど網膜をカバーする細胞外液の少量を使用してください。硝子楊枝にスティックと網膜から遠心ドラッグすることができます。その後、組織のフラット化容易にするために網膜周辺部に沿って短い切開を適用します。
- グラスの底の上に広がって(我々は細かいブラシを使用)とステンレス鋼のナイロン神経質のフレームでそれを固定化、記録室下に光受容側に網膜を移す。同じ方法で第二網膜を準備し、それが後で使用するためにcarboxygenated細胞外液中に暗順応してください。
2。レコーディング
- 直立レーザー走査型顕微鏡の下で暗闇での録音室をインストールし、(連続して網膜の準備を表面かん流する5以上ミリリットル/マイルcarboxygenated細胞外溶液とn)は35℃に加熱顕微鏡は、(また、赤外感度CCDカメラを搭載)を電磁的に遮蔽するためのファラデーケージの内部に衝撃吸収エアテーブルに位置しています。暗闇の中で準備を保つために、非透明なカーテンでケージを覆う。我々はまた、赤い透明フィルムによって、コンピュータモニターからの光をオフスクリーン。
- 、850〜870 nm以上長波長側に赤外レーザーをチューニングモードロック状態に切り替え、およびGFP発現細胞を可視化する二光子励起を使用してください。蛍光細胞の明確な認識のための丁度十分な程度にレーザースキャニングソフトウェアによってダウン制御NDフィルターを使用してレーザーの出力を減衰させる
- で構成される細胞内液(mMで)125 K -グルコン酸、10のKCl、0.5 EGTで満たされた電流クランプモードの使用のガラスのマイクロピペットのパッチクランプ記録(我々が1.5mm外径と0.225ミリメートル、肉厚のホウケイ酸ガラス管を使用する)ためのKOH(MΩ約5のピペットの抵抗を与える)でpH7.4に滴定、10 HEPES、。電圧クランプ記録のような他の実験条件が異なるソリューションが必要であることに注意してください。色素の注射が必要な場合は、蛍光プローブ(我々は10 mMのAlexa Fluor 594のを使用)またはトレーサー分子(3%Neurobiotin)を追加します。ホルダーにマイクロピペットを挿入し、参照電極(塩化銀線が)録音室内の細胞外溶液に接触していることを確認してください。
- マイクロピペットへの圧力を適用し、対象とGFP発現細胞を(我々は40倍の水浸対物レンズを使用して、NA 1.25)。アマクリン細胞体は、内顆粒層の近位部(準備中55から75μm程度の深さ)における神経節細胞層(直接網膜の現在の方向で表面下)と同様に位置しています。標的細胞、網膜における内境界膜(グリアendfeet製シース)付きマイクロピペットの接触の前に表面は浸透する必要があります。成功した侵入は、マイクロピペットの先端から追い出さとIR - CCDカメラで撮影した赤外線透過像を観察することができるように基本的な網膜組織から内境界膜を切り離している細胞内液で認識されます。
- 録音のマイクロピペットの位置を示すIR - CCDカメラの画像で2つの光子画像から細胞体の位置を比較することにより、所望の細胞に近づく。 GFP発現細胞はそれに向かってマイクロピペットを指示するために赤外透過画像で認識する必要があるため、このステップは簡単に達成されないことに注意してくださいといくつかの練習が必要です。マイクロピペットの先端は、2光子画像に見られる細胞表面のえくぼ形成させる際に、正しいターゲットが達成されます。この手順の代わりに、二光子画像にマイクロピペットの位置を明らかにするために細胞内液中の蛍光色素(例えばAlexa Fluor 594の、100μM)を使用してください。二光子赤外線励起のマイクロピペットを識別できるようにするには、この色素の十分な蛍光が可能になります。この目的のために、また、赤色蛍光をカバーするためにレーザースキャンソフトウェアで検出範囲を調整する。
- マイクロピペットからの圧力を解放し、電流クランプモードで全細胞パッチクランプの設定を取得します。使用可能な録音は、少なくとも20分間、-50〜-55 mVと最後の膜電位を与える必要があります。
- コンピュータのモニタ上に刺激のソフトウェアによって作成された現在の視覚刺激(我々はトーマスオイラー、テュービンゲン大学、ドイツでQDSを使用する)11。記録された細胞を中心とする刺激の空間的位置を調整する:IR - CCDカメラと中心その上にスポット状の刺激の透過画像を示すモニタ上のセルの位置をマークします。光路内にNDフィルターを挿入することで刺激強度をチューニングします。モニターのスペクトルと強度のキャリブレーションのために文献[14]を参照してください。曳索を選択してください適応を避けるために、dを刺激間隔(例えば15秒)。刺激のタイミングの記録を残すためにビームのパス内にフォトダイオードが含まれています。
- 刺激のプロトコルを起動し、光反応を(我々は非スパイク細胞に5 kHzでのフィルタリングでは10kHzのサンプリングレートを使用して、スパイクの記録のために20 kHzのようなより高いサンプリングレートを推奨します)を記録。レコーディングソフトウェアをトリガするために、光刺激のソフトウェアを使用してください。
- 染料は、慎重に後退細胞からマイクロピペットを前に30-45分のための記録された細胞内に蛍光剤の拡散を聞かせ充填するための。セル本体を抜かないように注意してください。非蛍光トレーサーNeurobiotinが使用されている場合、それは(私は4で一晩ストレプトアビジン- Cy3を、1:400を使用して° C蛍光体に結合したストレプトアビジンに結合することにより可視化を必要と網膜の20分のパラホルムアルデヒド固定後、色素カップリング用研究ストレプトアビジンのインキュベーション)が3日に延長することができます。また、注射もして行うことができます。色素がimpaledセル(:0.25から1 nAの、100ミリ秒、間隔100ミリ秒、合計時間3月6日分の矩形パルス)にiontophoretically駆動されるシャープの電極(MΩ> 100)。
3。代表的な結果:
以下の結果は、チロシン水酸化酵素13,14のためのプロモーター下に緑色蛍光タンパク質(GFP)を発現するマウス、カテコールアミン合成(::GFPマウスTH)の速度律速段階を触媒する酵素の研究に由来する。 GFP -シグナル二つの異なる細胞集団の明るさに基づいて(図2A)区別することができる。高いGFPレベルを発現する細胞は、内顆粒層にある細胞体(INL、図2A)を持っているか、神経節細胞層に変位(GCL、図2B)および内網状層の真ん中(IPL、図2C)で階層化する。彼らは、タイプ2のセル14から16として同定され、体系的に形態に関して(図3)に師事し、選出することができるrical活動(図4)、その人口密度はわずか250細胞/ mm 2にのぼるにもかかわらず。

図1。実験装置の模式図。無傷の網膜における蛍光体発現細胞の二光子励起(赤色の点線の光路は)マイクロピペット(緑色発光の光路)によって標的視覚可能になります。網膜は、顕微鏡のコンデンサー(黄色の光路)を介して投影光学刺激にさらされ、そして細胞の光の応答が記録されます。
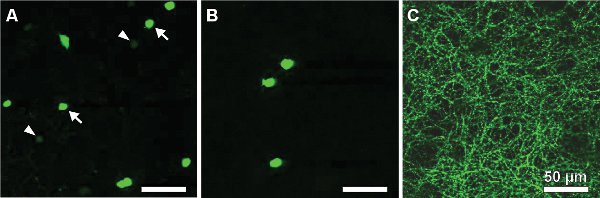
図2。 THの網膜flatmountにおけるGFP発現細胞::GFPマウス。タイプ2細胞に弱い蛍光を示すINLにあるタイプ1細胞(DA細胞)(、矢印を参照)と激しくラベル付け:2つの集団はGFP -信号の明るさによって区別することができますINLのいずれかの細胞体(、矢印を参照)またはGCL(B)とIPLの地層S3(C)における樹状成層に避難。スケールバーは50μm。
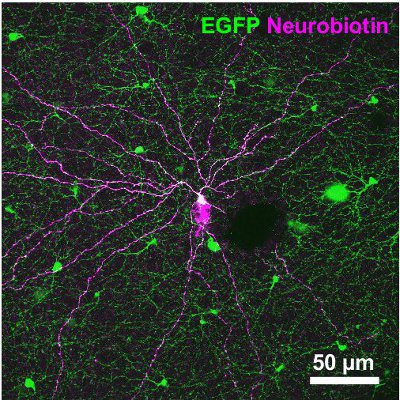
図3。トレーサーNeurobiotinを注入された2型細胞の形態。トレーサーは、ストレプトアビジン- Cy3を結合(マゼンタ)で続いて可視化した。また、GFPのシグナル(緑)を描いたている顕微鏡写真は、、GCLとIPLをカバーする画像スタックの投影です。スケールバーは50μm。
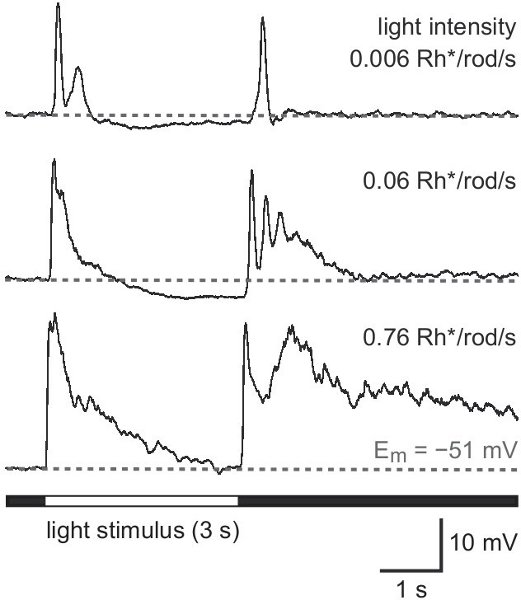
図4。 GCLに位置する2型細胞の光反応。暗所視の範囲で増加する強度の白色光のフルフィールド照明への応答パターン。刺激強度は毎秒ロッドあたりphotoisomerizations(RH * /ロッド/ s)で与えられる。 3秒の長時間の刺激は、より良い別個に使用された刺激開始(レスポンスON)とオフセット(応答OFF)での応答の成分のイオン。
ディスカッション
このメソッドは、網膜のadaptational状態に影響を与えることなく、視覚的な指導の下で無傷の網膜の特定の神経細胞の電気的特性を研究するために可能性を提供しています。それは、特に現在ではむしろ悪いアマクリン細胞の大部分の集団のような低人口密度のために研究されているセルの特性評価に適しています。二光子励起は、高解像度と高コントラストでも、組織17の深い部分からのイメージング、正確に目標を定めるための前提条件と成功を、特に細胞体のその高密度とINLの細胞のパッチクランプを可能にします。
分離されたマウスの網膜では、実験条件下で3〜4時間のための実行可能です。第二網膜が連続carbogenのガス発生で完全な暗闇に格納されている場合、それは無漂白の光色素の紫の色を保持し、最初の網膜での実験を終えた後に使用することができます。初めに、ターゲット網膜wholemountのマイクロピペットで選択したセルは、暗闇で作業する場合は特に、少し挑戦的であり、いくつかの練習が必要です。セルとマイクロピペットは、同時に2つの光子励起下の表示されているので、マイクロピペットで蛍光色素を含むことは、手続きを簡素化することができます。しかし、細胞内液にコンポーネントを追加することgigaseal形成を阻害したり、記録品質が低下する可能性があります。一度成功達成、良好な記録は約1時間持続できる
赤外励起光自体がわずかしか網膜光受容体によって吸収されるのに対し、励起GFP発現細胞では、スペクトルの可視部分で光を発する。しかし、蛍光体は、網膜のadaptational条件を変更される可能性が低い小型の焦点ボリュームに興奮している。すべてのより多くの、励起は標的のために必要とされ、光反応の録画中にオフにすることができます。
usefulnこのアプローチのESSは、すでに電気生理学的記録は、そうでない場合だけ事故を12で可能だった14,18、そこからアマクリン細胞の特定の集団の研究によって実証されている。最後に、この強力な技術は、さらに薬理学的ア プローチ14、Ca 2 +動態のイメージング19を含めることにより、または免疫細胞化学的研究や電子顕微鏡のための注入された細胞を使用して拡張することができます。そうすれば、網膜回路内の特定の細胞型の機能的な位置を解明することができます。
開示事項
マウスは、制度的な動物福祉のためのガイドラインとドイツの政府が発行する動物実験に関する法律に従って処理して安楽死させた。
謝辞
この作品は、ドイツ学術振興(KD及びRWへWE849/16 1 / 2)によってサポートされていました。我々は、光刺激のソフトウェアのQDS用トーマスオイラー(Töbingen、ドイツ)に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 試薬/資機材 | 会社 | カタログ番号 | コメント |
|---|---|---|---|
| 暗視ゴーグル | グートツァイト社、Warthausen、ドイツ | xtronのF1 | 800nmの光源を含んで |
| 光学フィルタ | Schott社、マインツ、ドイツ | RG9 | 690 nmのカットオフでフィルタをロングパス |
| アイリスはさみ | ファイン科学ツール | 14061〜09 | 22 mmのブレードで湾曲 |
| 春のはさみ | ファイン科学ツール | 15000〜00 | ストレート3 mmの刃を持つ |
| 記録室 | Luigs&ノイマン社、ラティンゲン、ドイツ | 200〜100 500 0180型(TC) | ボトムマウント型のガラス製カバースリップを持つテフロンチャンバー(約0.15ミリメートル、第200〜100 500 0182) |
| フローヒーター | マルチチャンネルシステム、ロイトリンゲン、ドイツ | PH01、TC01 | 温度のある加熱可能な血流カニューレアンソールと温度コントローラ |
| レーザー走査顕微鏡 | ライカマイクロシステムズ | DM LFS | ライカ共焦点のソフトウェアによって制御 |
| 空気テーブル | ニューポート | VH 3036W - OPT | |
| レーザー | スペクトラフィジックス | 津波のモード同期Ti:サファイアレーザー | |
| CCDカメラ | PCO AG、Kelheim、ドイツ | PixelFly QE | 制御ソフトウェアを含む |
| マイクロピペットガラスキャピラリー | Hilgenberg製、Malsfeld、ドイツ | 1408411 | |
| マイクロピペットプラー | サッターインストゥルメント | P - 97 | |
| Alexa Fluor 594の | インビトロジェン | - 20004 | 蛍光色素 |
| Neurobiotin | Axxora | VC - SP - 1120 - M050 | 非蛍光トレーサー |
| ストレプトアビジン- Cy3の | Dianova | 016-160-084 | |
| マイクromanipulator | Luigs&ノイマン社、ラティンゲン、ドイツ | 210〜100 000 0010 | ディスプレイSM - 5の電動Mini25マニピュレータユニット |
| パッチクランプアンプ | NPI電子社、タム、ドイツ | SEC - 05LX NPI | |
| デジタイザー | ナショナルインスツルメンツ | BNC - 2090 | |
| データ収集ソフトウェアWinWCP | ジョンデンプスター、スコットランドの大学、グラスゴー、イギリス | http://spider.science.strath。 ac.uk / sipbs / software.htm | |
| 視覚刺激発生器のQDS | トーマスオイラー、テュービンゲン大学、ドイツ | 2台のモニタを(ユーザーインターフェース、刺激モニター)を制御する別のコンピュータ上で動作する必要があります | |
| NDフィルター | ITOS、マインツ、ドイツ |
参考文献
- Masland, R. H. The fundamental plan of the retina. Nat. Neurosci. 4, 877-886 (2001).
- Baccus, S. A. Timing and computation in inner retinal circuitry. Annu. Rev. Physiol. 69, 271-290 (2007).
- Haverkamp, S., Inta, D., Monyer, H., Wässle, H. Expression analysis of green fluorescent protein in retinal neurons of four transgenic mouse lines. Neuroscience. 160, 126-139 (2009).
- Siegert, S., Gross-Scherf, B., Del Punta, K., Didkovsky, N., Heintz, N., Roska, B. Genetic address book for retinal cell types. Nat. Neurosci. 12, 1197-1204 (2009).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Euler, T., Detwiler, P. W., Denk, B. Directionally selective calcium signals in dendrites of starburst amacrine cells. Nature. 418, 845-852 (2002).
- Sakmann, B., Neher, E. Single-Channel Recording. , Plenum Press. (1995).
- Jackson, M. B. Whole-cell voltage clamp recording. Current Protocols in Neuroscience. Gerfen, C. , Wiley. (1997).
- Majewska, A., Yiu, G., Yuste, R. A custom-made two-photon microscope and deconvolution system. Pfügers Arch. - Eur. J. Physiol. 441, 398-408 (2000).
- Yuste, R., Konnerth, A. maging in Neuroscience and Development: A Laboratory Manual. , Cold Spring Harbor Laboratory. (2005).
- Euler, T., Hausselt, S. E., Margolis, D. J., Breuninger, T., Castell, X., Detwiler, P. B., Denk, W. Eyecup scope - optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Arch. - Eur. J. Physiol. 457, 1393-1414 (2009).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nat. Protoc. 5, 1347-1352 (2010).
- Matsushita, N., Okada, H., Yasoshima, Y., Takahashi, N., Kiuchi, K., Kobayashi, K. Dynamics of tyrosine hydroxylase promoter activity during midbrain dopaminergic neuron development. J. Neurochem. 82, 295-304 (2002).
- Knop, G. C., Feigenspan, A., Weiler, R., Dedek, K. Inputs underlying the ON-OFF light responses of type 2 wide-field amacrine cells in TH-GFP mice. J. Neurosci. 31, 4780-4791 (2011).
- Zhang, D. Q., Stone, J. F., Zhou, T., Ohta, H., McMahon, D. G. Characterization of genetically labeled catecholamine neurons in the mouse retina. Neuroreport. 15, 1761-1765 (2004).
- Contini, M., Lin, B., Kobayashi, K., Okano, H., Masland, R. H., Raviola, E. Synaptic input to ON-biploar cells onto the dopaminergic neurons of the mouse retina. J. Comp. Neurol. 518, 2035-2050 (2010).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat. Methods. 2, 932-940 (2005).
- Dedek, K., Breuninger, T., de Sevilla Müller, L. P., Maxeiner, S., Schultz, K., Janssen-Bienhold, U., Willecke, K., Euler, T., Weiler, R. A novel type of interplexiform amacrine cell in the mouse retina. Eur. J. Neurosci. 30, 217-228 (2009).
- Denk, W., Detwiler, P. B. Optical recording of light-evoked calcium signals in the functionally intact retina. Proc. Natl. Acad. Sci. U.S.A. 96, 7035-7040 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved