Method Article
Caracterização eletrofisiológica de GFP-Expressando populações de células na retina intacta
Neste Artigo
Resumo
Este artigo descreve a gravação de células individuais de fluorescente etiquetado populações neuronais na retina do rato intacto. Usando dois fótons infravermelhos excitação transgenetically células marcadas foram alvo de patch-clamp de gravação para estudar as respostas de luz, as propriedades de campo receptivo, e morfologia.
Resumo
Estudar as propriedades fisiológicas e conexões sinápticas de neurônios específicos no tecido intacto é um desafio para as células que evidente falta características morfológicas ou mostrar uma baixa densidade populacional. Isso vale principalmente para células amácrinas da retina, uma classe de interneurônios excepcionalmente multiformes que compõem cerca de 30 subtipos em mamíferos 1. Apesar de ser uma parte crucial do processamento visual, moldando a saída da retina 2, a maioria desses subtipos não foram estudadas até agora em um contexto funcional, pois encontrar essas células com um eletrodo de gravação é um evento raro.
Recentemente, uma infinidade de linhas de camundongo transgênico que está disponível marcadores fluorescentes expressar como a proteína verde fluorescente (GFP) sob o controle de promotores de receptores de membrana ou enzimas que são específicos para apenas um subconjunto de neurônios em um dado tecido 3,4. Estas células pré-rotulados são, portanto, accessible para microeletrodo dirigido segmentação sob controle microscópico, permitindo o estudo sistemático de suas propriedades fisiológicas in situ. No entanto, a excitação de marcadores fluorescentes é acompanhada pelo risco de fototoxicidade para o tecido vivo. Na retina, esta abordagem é adicionalmente prejudicada pelo problema que a luz de excitação faz com que a estimulação adequada dos fotorreceptores, assim, infligir fotopigmento branqueamento e transferência dos circuitos da retina em uma condição de luz adaptado. Estas desvantagens são superadas usando excitação infravermelho entregue por um mode-locked laser em pulsos curtos da faixa de femtossegundos. Excitação de dois fotões fornece energia suficiente para a excitação fluoróforo e, ao mesmo tempo restringe a excitação a um pequeno volume de tecido a minimização dos perigos de photodamage 5. Além disso, ele deixa a retina sensíveis aos estímulos visuais desde a luz infravermelha (> 850 nm) só é mal absorvido pelo fotopigmentos 6.
em gravações situ de células que expressam GFP que são visualmente alvo de dois fótons excitação. A retina é preparada e mantida no escuro e pode ser submetido a estímulos ópticos, que são projetadas através do condensador do microscópio (Figura 1). Patch-clamp gravação de respostas a luz pode ser combinado com a tintura de enchimento para revelar a morfologia e para verificar se há corante gap-junction mediada acoplamento para as células vizinhas, de modo que a célula-alvo pode por estudadas em diferentes níveis experimental.
Protocolo
A descrição a seguir pressupõe que o pesquisador tem um conhecimento básico da estrutura da retina, patch-clamp de gravação e de microscopia de dois fótons. Para obter informações úteis sobre como estabelecer e executar uma instalação de patch-clamp e dois fótons sistema de imagem veja referências [7-12].
1. Animal e de preparação dos tecidos
- Mantenha rato de adaptação ao escuro por pelo menos 3 h. Nesse meio tempo, prepare 1-2 l de solução extracelular consistindo de (em mM) 125 NaCl, 2,5 KCl, 1 CaCl 2, 1,6 MgCl 2, 25 NaHCO 3, 10 D-glicose e equilibrar-o para pH 7,4 por gás com carbogênio (5% de CO 2 em O 2) em temperatura ambiente. um
- Euthanize o mouse em uma câmara hermética de CO 2 overdose seguido por deslocamento cervical. Este procedimento e os seguintes passos devem ser realizados na escuridão. Use iluminação de longo comprimento de onda dim (que bloquear comprimentos de onda curtos a partir de uma fonte de luz fria por um 690 nm-longpass filtro) para apoiar a visão pessoal, mantendo os olhos do animal de adaptação ao escuro (ratos só têm má visão na parte vermelha do espectro de luz). Para o trabalho na iluminação completa escuridão usar infravermelho (> 800 nm) e usar óculos de visão noturna.
- Enuclear olhos com um par de tesouras curvas íris e transferi-los para um prato de solução extracelular colocadas sob um microscópio de dissecação.
- Remover da córnea e do corpo ciliar, abrindo o bulbo do olho ao longo da ora serrata (a fronteira entre a retina eo corpo ciliar) com uma tesoura de mola (nós usamos primeiro uma lanceta para furar um ponto de partida para o corte). Retire a lente e separe cuidadosamente a retina do epitélio pigmentar. Se a orientação da retina é crucial para o seu estudo, indicam que, como na Ref. [12]. Cortar o nervo óptico entre retina e epitélio pigmentar da retina e remover a partir do ocular. Observe a direção das superfícies da retina: o interior da retina enrolado-up é o Ganglion lado célula; o exterior é o lado fotorreceptoras.
- Remover o vítreo da superfície interna da retina, puxando-o fora com o auxílio de um palito de madeira. Para este fim, use um pequeno volume de solução extracelular que apenas cobre a retina. As varas do vítreo para o palito e podem ser arrastados centrifugamente fora da retina. Em seguida, aplique incisões curtas ao longo do perímetro da retina para facilitar o nivelamento do tecido.
- Transferir a retina para dentro da câmara de gravação fotorreceptoras voltada para baixo, estendeu-o no fundo de vidro (usamos um pincel fino) e imobilizá-lo com um quadro de nylon amarrado de aço inoxidável. Prepare a retina segundo da mesma maneira e mantê-lo de adaptação ao escuro em solução extracelular carboxygenated para uso posterior.
2. Gravações
- Instalar a câmara de gravação na escuridão sob um microscópio a laser na vertical digitalização e superfuse a preparação da retina continuamente (não inferior a 5 ml / min) com solução extracelular carboxygenated aquecida a 35 ° C. O microscópio (também equipado com uma câmera CCD infravermelho-sensível) está situado em um choque de absorção de mesa de ar dentro de uma gaiola de Faraday para eletrônicos de proteção. Cobrir a gaiola com uma cortina não transparente para manter a preparação em trevas. Nós também fora da tela a luz de monitores de computador por película transparente vermelho.
- Ajustar o laser infravermelho para 850-870 nm ou comprimentos de onda maiores, alterne para modo bloqueado condição e utilização de dois fótons de excitação para visualizar células que expressam GFP. Atenuar a saída do laser usando filtros de densidade neutra controlada pelo software de digitalização a laser até um grau que é apenas suficiente para o reconhecimento claro da célula fluorescentes
- Para patch-clamp gravações em grampo atual modo de usar micropipetas de vidro (utilizamos tubos de vidro de borosilicato de 1,5 mm de diâmetro externo e espessura da parede 0,225 mm) preenchidas com solução intracelular consistindo de (em mM) 125 K gluconato, 10 KCl, 0,5 EGTA, 10 HEPES, titulada para pH 7,4 com KOH (dando uma resistência pipeta de cerca de 5 mohms). Note-se que outras condições experimentais como tensão-clamp gravação requer uma solução diferente. Se injeções de corante são desejados, adicione uma sonda fluorescente (nós usamos 10 mM Alexa Fluor 594) ou uma molécula marcador (3% Neurobiotin). Insira o micropipeta no suporte e certifique-se que o eletrodo de referência (fio de prata clorada) está em contato com a solução extracelular na câmara de gravação.
- Aplicar pressão ao micropipeta e alvo de uma expressando GFP-célula (usamos um de 40 vezes objetiva de imersão em água; NA 1,25). Corpos celulares amácrinas estão situados na camada de células ganglionares (diretamente abaixo da superfície na orientação atual da retina), bem como na parte proximal da camada nuclear interna (cerca de 55-75 mM profundamente dentro da preparação). Antes de micropipeta contato com a célula-alvo, a membrana limitante interna (a bainha feita de glial endfeet) na retinasuperfície tem de ser penetrada. Penetração bem sucedida é reconhecida pela solução intracelular que é expulso da ponta micropipeta e destaca a membrana limitante interna da retina ao tecido subjacente como pode ser observado em uma imagem de transmissão infravermelha capturada pela câmera IR-CCD.
- Abordagem a célula desejada, comparando a posição soma a partir da imagem de dois fótons com a imagem da câmera CCD IR-mostrando a posição da micropipeta de gravação. Note que este passo não é fácil, e exige alguma prática, porque a célula expressando GFP-tem que ser reconhecida na imagem de transmissão infravermelha, a fim de direcionar a micropipeta em direção a ela. Direcionamento correto é alcançado quando a ponta da micropipeta causa ondulações na superfície da célula que pode ser visto na imagem de dois fótons. Alternativa a este procedimento, use um corante fluorescente (por exemplo Alexa Fluor 594, 100 mM) na solução intracelular para revelar a posição micropipeta na imagem de dois fótons. Dois fótons excitação infravermelho permite fluorescência suficiente deste corante para fazer a micropipeta discernível. Para este fim, ajustar o alcance de detecção do software de digitalização a laser para cobrir também a fluorescência vermelha.
- Libertação de pressão da micropipeta e obter uma célula inteira configuração de patch-clamp clamp na corrente de modo. Uma gravação utilizável deve dar um potencial de membrana de -50 a -55 mV e durar pelo menos 20 min.
- Apresentar estímulos visuais criados por um software de estimulação (usamos QDS por Thomas Euler, da Universidade de Tübingen, Alemanha) 11 em um monitor de computador. Ajuste a posição espacial do estímulo a ser centralizado na célula registrados: Mark a posição da célula no monitor que mostra a imagem de transmissão da câmera CCD e IR-centro de um estímulo como o local para ele. Sintonize a intensidade do estímulo através da inserção de filtros de densidade neutra para o caminho do feixe. Para a calibração do espectro monitorar e intensidade ver Ref. [14]. Escolha um prolonged interstimulus intervalo (por exemplo, 15 s) para evitar a adaptação. Incluem um fotodiodo no caminho do feixe de manter registro do tempo de estímulo.
- Iniciar o protocolo de estimulação e gravar as respostas luz (nós usamos uma taxa de amostragem de 10 kHz com filtragem de 5 kHz para não-spiking células; para gravação spike uma maior taxa de amostragem de 20 kHz, como é recomendado). Use o software de estímulo de luz para ativar o software de gravação.
- Para deixar o corante preenchendo difusa agente fluorescente na célula gravada por 30-45 min antes cuidadosamente retração da micropipeta da célula. Tome cuidado para não retirar o corpo da célula. Se o não-traçador fluorescente Neurobiotin foi usado, ele precisa de visualização por ligação a estreptavidina conjugada a um fluoróforo (usamos estreptavidina-Cy3, 1:400 durante a noite a 4 ° C após 20 min paraformaldeído fixação da retina; para a tintura de acoplamento estudos de incubação estreptavidina pode ser prolongado para 3 d). Alternativamente, as injeções também pode ser realizada comeletrodos pontiagudos (> 100 mohms) quando o corante é conduzido para dentro da célula iontophoretically empalado (pulsos retangulares: 0,25-1 nA, 100 ms, intervalo de 100 ms, o tempo total 06/03 min).
3. Resultados representativos:
Os seguintes resultados provêm de um estudo sobre um rato que expressam a proteína verde fluorescente (GFP), sob o promotor de tirosina hidroxilase 13,14, a enzima que catalisa a taxa de etapa limitante na síntese de catecolaminas (TH:: GFP mouse). Com base no brilho da GFP sinal de duas populações celulares distintas são distinguíveis (Figura 2A). Células que expressam o nível mais elevado GFP possuem corpos celulares localizados na camada nuclear interna (INL, Figura 2A) ou deslocadas na camada de células ganglionares (GCL, Figura 2B) e estratificar no meio da camada plexiforme interna (IPL, figura 2C) . Eles foram identificados como tipo 2 células 14-16 e poderia ser sistematicamente estudada em relação à morfologia (Figura 3) e elegeratividade rical (Figura 4), embora sua densidade populacional só equivale a 250 células / mm 2.

Figura 1. Representação esquemática da instalação experimental. Dois fótons de excitação (caminho da luz vermelha pontilhada) de células que expressam fluoróforo na retina intacta permite visuais segmentação por uma micropipeta (verde caminho emissão de luz). A retina é submetido a estímulos ópticos projetados através do condensador do microscópio (caminho da luz amarela), e as respostas celulares a luz são registradas.
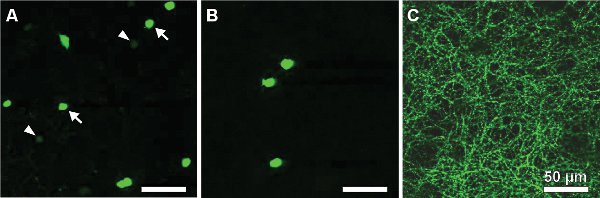
Figura 2. GFP-células que expressam em uma flatmount retina de um TH:: mouse GFP. Duas populações pode ser distinguido pelo brilho da GFP sinal: tipo 1 (células DA) localizada no INL mostrando fluorescência fraca (A, ver pontas de seta) e tipo 2 células intensamente marcadocom corpos celulares tanto no INL (A, ver setas) ou deslocadas na GCL (B) e uma estratificação dendrítica no estrato S3 do IPL (C). Barras de escala, 50 mm.
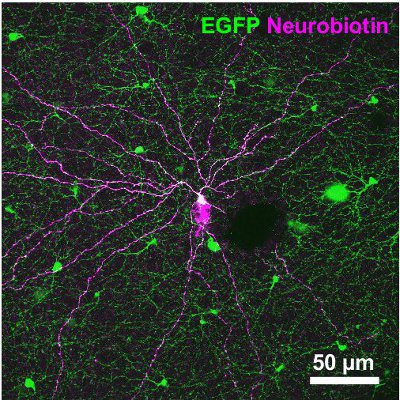
Figura 3. Morfologia de uma célula do tipo 2 injetado com o Neurobiotin marcador. O traçador foi posteriormente visualizado por estreptavidina-Cy3 binding (magenta). A micrografia, que também está representando o sinal de GFP (verde), é uma projeção de pilhas de imagens cobrindo o GCL e IPL. Barra de escala, 50 mm.
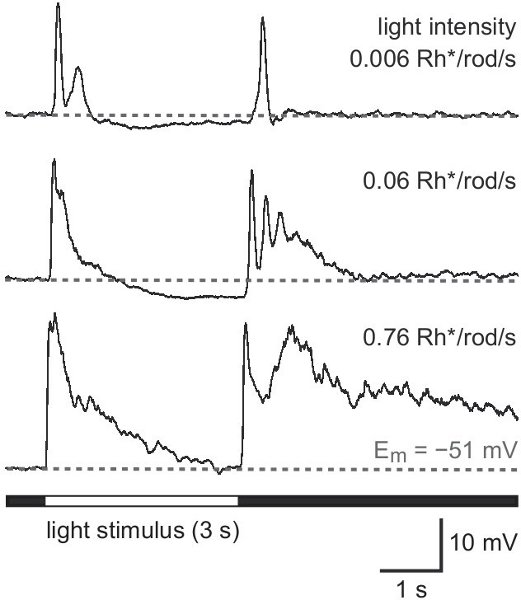
Figura 4. Respostas luz de uma célula do tipo 2 localizado na GCL. Padrão de resposta ao branco iluminação de campo total de luz de intensidade crescente na faixa escotópica. Intensidade do estímulo é dado em photoisomerizations por haste por segundo (Rh * / rod / s). Um estímulo prolongado de 3 s foi usado para uma melhor distintosíon dos componentes de resposta no início do estímulo (ON resposta) e offset (OFF resposta).
Discussão
Este método oferece a possibilidade de estudar as propriedades elétricas de neurônios específicos na retina intacta sob orientação visual, sem influenciar a condição de adaptação da retina. É particularmente adequado para a caracterização de células que estão actualmente bastante mal estudada, devido à baixa densidade populacional como a maioria das populações de células amácrinas. Dois fótons excitação permite imagens de alta resolução e alto contraste até mesmo de partes mais profundas do tecido 17, um pré-requisito para uma mira precisa e bem sucedida patch-fixação de células particularmente no INL, com sua alta densidade de corpos celulares.
A retina do rato isolada é viável para 3-4 h nas condições experimentais. Se a retina segundo é armazenado em completa escuridão sob gaseamento carbogênio contínua, mantém a cor púrpura do fotopigmento crus e pode ser usado depois de terminar experimentos com a retina em primeiro lugar. No início, visando acélulas selecionado com a micropipeta na wholemount da retina é um pouco desafiador e requer alguma prática, especialmente quando se trabalha na escuridão. Incluindo um corante fluorescente na micropipeta pode simplificar o procedimento, porque celular e micropipeta são visíveis sob dois fótons de excitação, ao mesmo tempo. No entanto, a adição de componentes à solução intracelular podem impedir a formação de gigaseal ou causar a qualidade de gravação a sofrer. Uma vez alcançado com sucesso, uma boa gravação pode durar cerca de 1 h.
Considerando que a luz de excitação infravermelho si só é mal absorvido por fotorreceptores da retina, animado células que expressam GFP emite luz na parte visível do espectro. No entanto, fluoróforos está animado apenas em um pequeno volume focal que não é susceptível de alterar a condição de adaptação da retina. Ainda mais excitação, só é necessária para segmentação e pode ser desligado durante a gravação de respostas luz.
O usefulness desta abordagem já está demonstrada por estudos em populações específicas de células amácrinas 14,18 a partir do qual as gravações eletrofisiológicas de outra forma teria sido possível apenas por acidente 12. Finalmente, esta poderosa técnica pode ainda ser prorrogado, incluindo uma abordagem farmacológica 14, Ca 2 + 19 ou imagem usando células injetadas para estudos imunocitoquímicos ou microscopia eletrônica. Dessa forma, a posição funcional de um dado tipo de célula no circuito da retina podem ser desvendados.
Divulgações
Camundongos foram tratados e sacrificados, em conformidade com as diretrizes institucionais para bem-estar animal e as leis em experimentos com animais emitidos pelo governo alemão.
Agradecimentos
Este trabalho foi financiado pelo Deutsche Forschungsgemeinschaft (WE849/16 1 / 2 a KD e RW). Estamos gratos ao Euler Thomas (Töbingen, Alemanha) para o software QDS luz estimulação.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagente / equipamentos de | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| Óculos de visão noturna | Gutzeit GmbH, Warthausen, Alemanha | Xtron F1 | inclui uma fonte de luz 800 nm |
| Filtro óptico | Schott, Mainz, Alemanha | RG9 | longpass filtro com corte em 690 nm |
| Iris tesoura | Multa Ferramentas Ciência | 14061-09 | curvo com 22 milímetros de lâmina |
| Tesoura primavera | Multa Ferramentas Ciência | 15000-00 | em linha reta com 3 milímetros de lâmina |
| Câmara de gravação | Luigs & Neumann GmbH, Ratingen, Alemanha | 200-100 500 0180 Tipo A (CT) | Teflon câmara com fundo montado lamínula de vidro (aprox. 0,15 mm; n º 2-100 500 0182) |
| Aquecedor de fluxo | Sistemas de multicanal, Reutlingen, Alemanha | PH01, TC01 | cânula de perfusão aquecido com a temperatura scontrolador de Ensor e temperatura |
| Microscópio de varredura a laser | Leica Microsystems | DM LFS | controlada pelo Software Leica Confocal |
| Air tabela | Newport | VH 3036W-OPT | |
| Laser | Spectra-Physics | Modo bloqueado tsunami Ti: safira de laser | |
| CCD da câmera | pco AG, Kelheim, Alemanha | PixelFly QE | incluindo software de controle |
| Micropipeta capilares de vidro | Hilgenberg, Malsfeld, Alemanha | 1408411 | |
| Micropipeta extrator | Instrumento Sutter | P-97 | |
| Alexa Fluor 594 | Invitrogen | A-20004 | corante fluorescente |
| Neurobiotin | Axxora | VC-SP-1120-M050 | não traçador fluorescente |
| Estreptavidina-Cy3 | Dianova | 016-160-084 | |
| Micromanipulator | Luigs & Neumann GmbH, Ratingen, Alemanha | 210-100 000 0010 | motorizada Mini25 unidade manipulador com display SM-5 |
| Amplificador de patch-clamp | npi electronic GmbH, Tamm, Alemanha | SEC-05LX npi | |
| Digitizer | National Instruments | BNC-2090 | |
| De aquisição de dados software WinWCP | John Dempster, University of Scotland, Glasgow, Reino Unido | http://spider.science.strath. ac.uk / sipbs / software.htm | |
| QDS gerador de estímulo visual | Thomas Euler, da Universidade de Tübingen, Alemanha | tem que ser operado em um computador separado controlar dois monitores (interface do usuário, estímulo monitor) | |
| Os filtros de densidade neutra | ITOS, Mainz, Alemanha |
Referências
- Masland, R. H. The fundamental plan of the retina. Nat. Neurosci. 4, 877-886 (2001).
- Baccus, S. A. Timing and computation in inner retinal circuitry. Annu. Rev. Physiol. 69, 271-290 (2007).
- Haverkamp, S., Inta, D., Monyer, H., Wässle, H. Expression analysis of green fluorescent protein in retinal neurons of four transgenic mouse lines. Neuroscience. 160, 126-139 (2009).
- Siegert, S., Gross-Scherf, B., Del Punta, K., Didkovsky, N., Heintz, N., Roska, B. Genetic address book for retinal cell types. Nat. Neurosci. 12, 1197-1204 (2009).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Euler, T., Detwiler, P. W., Denk, B. Directionally selective calcium signals in dendrites of starburst amacrine cells. Nature. 418, 845-852 (2002).
- Sakmann, B., Neher, E. Single-Channel Recording. , Plenum Press. (1995).
- Jackson, M. B. Whole-cell voltage clamp recording. Current Protocols in Neuroscience. Gerfen, C. , Wiley. (1997).
- Majewska, A., Yiu, G., Yuste, R. A custom-made two-photon microscope and deconvolution system. Pfügers Arch. - Eur. J. Physiol. 441, 398-408 (2000).
- Yuste, R., Konnerth, A. maging in Neuroscience and Development: A Laboratory Manual. , Cold Spring Harbor Laboratory. (2005).
- Euler, T., Hausselt, S. E., Margolis, D. J., Breuninger, T., Castell, X., Detwiler, P. B., Denk, W. Eyecup scope - optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Arch. - Eur. J. Physiol. 457, 1393-1414 (2009).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nat. Protoc. 5, 1347-1352 (2010).
- Matsushita, N., Okada, H., Yasoshima, Y., Takahashi, N., Kiuchi, K., Kobayashi, K. Dynamics of tyrosine hydroxylase promoter activity during midbrain dopaminergic neuron development. J. Neurochem. 82, 295-304 (2002).
- Knop, G. C., Feigenspan, A., Weiler, R., Dedek, K. Inputs underlying the ON-OFF light responses of type 2 wide-field amacrine cells in TH-GFP mice. J. Neurosci. 31, 4780-4791 (2011).
- Zhang, D. Q., Stone, J. F., Zhou, T., Ohta, H., McMahon, D. G. Characterization of genetically labeled catecholamine neurons in the mouse retina. Neuroreport. 15, 1761-1765 (2004).
- Contini, M., Lin, B., Kobayashi, K., Okano, H., Masland, R. H., Raviola, E. Synaptic input to ON-biploar cells onto the dopaminergic neurons of the mouse retina. J. Comp. Neurol. 518, 2035-2050 (2010).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat. Methods. 2, 932-940 (2005).
- Dedek, K., Breuninger, T., de Sevilla Müller, L. P., Maxeiner, S., Schultz, K., Janssen-Bienhold, U., Willecke, K., Euler, T., Weiler, R. A novel type of interplexiform amacrine cell in the mouse retina. Eur. J. Neurosci. 30, 217-228 (2009).
- Denk, W., Detwiler, P. B. Optical recording of light-evoked calcium signals in the functionally intact retina. Proc. Natl. Acad. Sci. U.S.A. 96, 7035-7040 (1999).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados