Method Article
Populations cellulaires Caractérisation électrophysiologique des exprimant la GFP dans la rétine intacte
Dans cet article
Résumé
Cet article décrit l'enregistrement des cellules individuelles de fluorescence taggés populations neuronales dans la rétine de souris intactes. En utilisant deux photons d'excitation infrarouge cellules transgenetically étiquetés ont été ciblés pour patch-clamp pour étudier leurs réponses lumière, les propriétés des champs réceptifs, et la morphologie.
Résumé
Étudier les propriétés physiologiques et les connexions synaptiques des neurones spécifiques dans le tissu intact est un défi pour les cellules qui manque flagrant caractéristiques morphologiques ou afficher une faible densité de population. Ceci s'applique particulièrement aux cellules amacrines rétiniennes, une classe exceptionnelle multiformes des interneurones qui composent environ 30 sous-types de mammifères 1. Bien qu'étant une partie cruciale de la transformation visuelle par la rétine façonner la sortie 2, la plupart de ces sous-types n'ont pas été étudiés jusqu'à présent, dans un contexte fonctionnel parce rencontrer ces cellules avec une électrode d'enregistrement est un événement rare.
Récemment, une multitude de lignées de souris transgéniques est disponible qui expriment des marqueurs fluorescents comme la protéine fluorescente verte (GFP) sous le contrôle de promoteurs pour les récepteurs membranaires ou des enzymes qui sont spécifiques à un sous-ensemble de neurones dans un tissu donné 3,4. Ces cellules pré-étiquetés sont donc accessible à microélectrode dirigé ciblant sous contrôle microscopique, permettant l'étude systématique de leurs propriétés physiologiques in situ. Cependant, l'excitation des marqueurs fluorescents est accompagné par le risque de phototoxicité pour les tissus vivants. Dans la rétine, cette approche est entravé par le problème que la lumière d'excitation provoque une stimulation appropriée des photorécepteurs, infligeant ainsi photopigment blanchiment et le transfert des circuits rétiniens dans un état de lumière adaptés. Ces inconvénients sont surmontés en utilisant une excitation à infrarouge livré par un mode bloqué au laser dans de courtes impulsions de la gamme femtoseconde. D'excitation à deux photons fournit suffisamment d'énergie pour l'excitation fluorophore et dans le même temps restreint l'excitation pour un volume de tissu de petites minimisant les risques d'agression solaire 5. Aussi, il quitte la rétine sensible aux stimuli visuels depuis une lumière infrarouge (> 850 nm) est seulement mal absorbé par photopigments 6.
dans les enregistrements in situ à partir de cellules exprimant la GFP qui sont visuellement ciblés par excitation à deux photons. La rétine est préparé et maintenu dans l'obscurité et peut être soumis à des stimuli optiques qui sont projetées par le condenseur du microscope (figure 1). Patch-clamp enregistrement des réponses de lumière peut être combiné avec de la teinture de remplissage pour révéler la morphologie et pour vérifier l'écart de jonction à médiation colorant couplage à des cellules voisines, de sorte que la cellule cible peut par étudiés sur différents niveaux d'expérimentation.
Protocole
La description suivante suppose que l'expérimentateur a une compréhension de base de la structure de la rétine, patch-clamp, et microscopie à deux photons. Pour plus d'informations utiles sur l'établissement et l'exécution d'un setup de patch-clamp et le système d'imagerie à deux photons voir les références [7-12].
1. Des animaux et de préparation des tissus
- Gardez la souris adaptés à l'obscurité pendant au moins 3 h. En attendant, préparez 1-2 L de solution extracellulaire constituée d'(en mm) 125 NaCl, KCl 2,5, CaCl 2 1, 1,6 MgCl 2, 25 NaHCO 3, 10 D-glucose et s'équilibrer à pH 7,4 par gazage au carbogène (5% de CO 2 en O 2) à température ambiante. d'un
- Euthanasier la souris dans une chambre étanche à l'air par le CO 2 surdose suivie par dislocation cervicale. Cette procédure et les étapes suivantes doivent être effectuées dans l'obscurité. Utilisez dim longueur d'onde d'illumination (nous bloquons courtes longueurs d'onde d'une source de lumière froide par un 690 nm-longpass filtre) pour appuyer la vision personnelle tout en gardant les yeux de l'animal adaptés à l'obscurité (les souris ont une mauvaise vue que dans la partie rouge du spectre lumineux). Pour travailler dans l'obscurité d'illumination utilisation complète infrarouge (> 800 nm) et l'usure lunettes de vision nocturne.
- Énucléer les yeux avec une paire de ciseaux à iris courbes et les transférer à un plat de solution extracellulaire placé sous un microscope à dissection.
- Retirez la cornée et le corps ciliaire par l'ouverture de l'ampoule oeil le long de la ora serrata (la frontière entre la rétine et du corps ciliaire) avec une paire de ciseaux à ressort (nous utilisons d'abord une lancette pour percer un point de départ pour la coupe). Sortez de la lentille et de séparer soigneusement la rétine de l'épithélium pigmentaire. Si l'orientation de la rétine est crucial pour votre étude, indiquent comme ça, en référence [12]. Couper le nerf optique entre la rétine et l'épithélium pigmentaire de la rétine et de supprimer de l'œilleton. Notez la direction de la surface rétinienne: l'intérieur de la rétine lovée est le Ganglcôté pile ion; l'extérieur est le côté photorécepteur.
- Enlever le vitré de la surface intérieure de la rétine par le tirant doucement hors à l'aide d'un cure-dent en bois. Pour ce faire, utilisez un petit volume de solution extracellulaire qui couvre juste la rétine. Les bâtons vitreux à le cure-dents et peut être traîné par centrifugation sur la rétine. Puis, appliquez courtes incisions le long du périmètre pour faciliter la rétine aplatissement du tissu.
- Transfert de la rétine dans la chambre d'enregistrement des photorécepteurs vers le bas, l'étaler sur le fond de verre (nous utilisons un pinceau fin) et l'immobiliser avec un châssis de nylon tendus en acier inoxydable. Préparer la rétine seconde de la même manière et le garder adaptés à l'obscurité dans la solution extracellulaire carboxygenated pour une utilisation ultérieure.
2. Enregistrements
- Installez la chambre d'enregistrement dans les ténèbres sous un microscope laser verticale de numérisation et de la préparation superfuse rétine en permanence (pas moins de 5 ml / min) avec la solution extracellulaire carboxygenated chauffée à 35 ° C. Le microscope (également équipé d'une caméra infrarouge sensible CCD) est situé sur un amortisseur de table de l'air intérieur d'une cage de Faraday pour la protection électronique. Couvrir la cage avec un rideau opaque pour maintenir la préparation dans l'obscurité. Nous avons également l'écran de la lumière à partir des écrans d'ordinateur par un film transparent rouge.
- Réglez le laser infrarouge pour 850-870 nm ou plus des longueurs d'onde, de passer en mode verrouillage de l'état et l'utilisation excitation à deux photons pour visualiser exprimant la GFP cellules. Atténuer la sortie du laser à l'aide de filtres de densité neutre contrôlé par le logiciel de numérisation laser, jusqu'à un degré qui est juste suffisante pour une reconnaissance claire de la cellule fluorescente
- Pour les enregistrements de patch-clamp dans le mode actuel micropipettes-clamp en verre (nous utilisons des tubes en verre borosilicate de 1,5 mm de diamètre extérieur et 0,225 mm d'épaisseur) rempli avec une solution composée de intracellulaires (en mm) 125 K-gluconate, 10 KCl, 0,5 EGTA 10, HEPES, titrée à pH 7,4 avec KOH (donnant une résistance pipette d'environ 5 MW). Notez que d'autres conditions expérimentales comme la tension-clamp nécessite une solution différente. Si les injections de colorant sont désiré, ajouter une sonde fluorescente (nous utilisons 10 mM Alexa Fluor 594) ou une molécule traceur (3% Neurobiotin). Insérez la micropipette dans le support et s'assurer que l'électrode de référence (fil d'argent chlorés) est en contact avec la solution extracellulaire dans la chambre d'enregistrement.
- Appliquer une pression à la micropipette et de cibler une cellule exprimant la GFP (nous utilisons un objectif de 40 fois l'eau d'immersion; NA 1,25). Corps cellulaires amacrines sont situés dans la couche des cellules ganglionnaires (directement sous la surface dans l'orientation actuelle de la rétine) ainsi que dans la partie proximale de la couche nucléaire interne (environ 55 à 75 um profondément dans la préparation). Avant le contact avec la cellule micropipette ciblées, la membrane limitante interne (une gaine faite de cellules gliales endfeet) à la rétinesurface doit être pénétré. Pénétration réussie est reconnue par la solution intracellulaire qui est chassé de la pointe de micropipette et se détache de la membrane limitante interne de la rétine tissus sous-jacents que l'on peut observer sur une image infrarouge en transmission capturée par la caméra IR-CCD.
- Approche de la cellule souhaitée en comparant la position soma de l'image à deux photons avec l'image de la caméra IR-CCD montrant la position de la micropipette enregistrement. Notez que cette étape n'est pas facile à réaliser et nécessite une certaine pratique, car la cellule exprimant la GFP doit être reconnu à l'image de transmission infrarouge afin de diriger la micropipette vers elle. Ciblage correct est atteint lorsque la pointe micropipette causes de capitons de la surface cellulaire qui peut être vu dans l'image à deux photons. Alternative à cette procédure, utilisez un colorant fluorescent (par exemple, Alexa Fluor 594, 100 pM) dans la solution intracellulaire de révéler la position micropipette dans l'image à deux photons. Excitation à deux photons infrarouges permet de fluorescence suffisante de ce colorant pour rendre la micropipette perceptible. Pour ce faire, réglez la plage de détection du logiciel de numérisation laser pour couvrir également la fluorescence rouge.
- Communiqué de la pression de la micropipette et obtenir une cellule entière de patch-clamp de configuration dans le courant-clamp mode. Un enregistrement exploitable devrait donner un potentiel de membrane de -50 à -55 mV et durer au moins 20 min.
- Présent stimuli visuels créés par un logiciel de stimulation (nous utilisons QDS par Thomas d'Euler, Université de Tübingen, Allemagne) 11 sur un écran d'ordinateur. Ajustez la position spatiale de la stimulation à être centré sur la cellule enregistrés: Marquer la position de la cellule sur le moniteur montrant l'image de transmission de la caméra IR-CCD et un centre de stimulation place, comme sur celle-ci. Tune l'intensité du stimulus en insérant filtres de densité neutre dans le trajet du faisceau. Pour l'étalonnage du spectre de surveiller et de l'intensité voir réf [14]. Choisir un Prolonged interstimulus intervalle (par exemple 15 s) afin d'éviter d'adaptation. Inclure une photodiode dans le trajet du faisceau de garder une trace du timing de relance.
- Démarrez le protocole de stimulation et d'enregistrer les réponses de lumière (nous utilisons un taux d'échantillonnage de 10 kHz avec un filtrage à 5 kHz pour les non-dopage cellules; pour l'enregistrement de pic un taux plus élevé d'échantillonnage de 20 kHz, comme il est recommandé). Utilisez le logiciel stimulation lumineuse pour déclencher le logiciel d'enregistrement.
- Pour le remplissage de colorant laisser le diffuse agent fluorescent dans la cellule enregistrée pendant 30-45 min avant attentivement rétractant la micropipette de la cellule. Prenez soin de ne pas sortir le corps de la cellule. Si le non-fluorescent traceur Neurobiotin a été utilisé, il doit la visualisation en se liant à la streptavidine conjuguée à un fluorophore (nous utilisons la streptavidine-Cy3, 1:400 pendant la nuit à 4 ° C après 20 min de fixation paraformaldéhyde de la rétine; pour le colorant de couplage Des études streptavidine incubation peut être prolongée à 3 d). Alternativement, les injections peuvent aussi être réalisées avecélectrodes forte (> 100 MQ) lorsque le colorant est entraîné par iontophorèse dans la cellule empalé (impulsions rectangulaires: de 0,25 à 1 nA, 100 ms, l'intervalle de 100 ms, temps total 3-6 min).
3. Les résultats représentatifs:
Les résultats suivants proviennent d'une étude sur les souris exprimant une protéine fluorescente verte (GFP) sous le promoteur de la tyrosine hydroxylase 13,14, l'enzyme catalysant l'étape limitante dans la synthèse des catécholamines (TH:: GFP souris). Basé sur la luminosité des deux signaux GFP-populations de cellules distinctes se distinguent (figure 2A). Les cellules exprimant le niveau supérieur GFP possèdent des corps cellulaires situés dans la couche nucléaire interne (INL, figure 2A) ou déplacées dans la couche des cellules ganglionnaires (GCL, figure 2B) et stratifier au milieu de la couche interne plexiforme (IPL, figure 2C) . Ils ont été identifiés comme des cellules de type 2 14-16 et pourraient être systématiquement étudiés par rapport à la morphologie (figure 3) et élireriques d'activité (figure 4), même si sa densité de population ne s'élève qu'à 250 cellules / mm 2.

Figure 1. Représentation schématique du dispositif expérimental. Excitation à deux photons (rouge trajet de la lumière en pointillés) du fluorophore cellules exprimant dans la rétine intacte permet visuelle ciblage par une micropipette (chemin vert émission de lumière). La rétine est soumis à des stimuli optiques projetée à travers le condenseur du microscope (trajet de la lumière jaune), et les réponses cellulaires légers sont enregistrés.
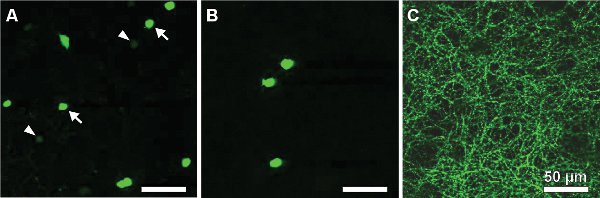
Figure 2. GFP cellules exprimant dans un flatmount rétinienne d'un TH:: la souris GFP. Deux populations peuvent être distinguées par l'éclat de la GFP-signal: le type 1 (cellules DA), situé à l'INL montrant une faible fluorescence (A, voir flèches) et le type intensément marquées 2 cellulesavec les corps cellulaires, soit dans l'INL (A, voir flèches) ou déplacées dans la GCL (B) et une stratification dendritiques dans la strate S3 de l'IPL (C). Barres d'échelle, 50 um.
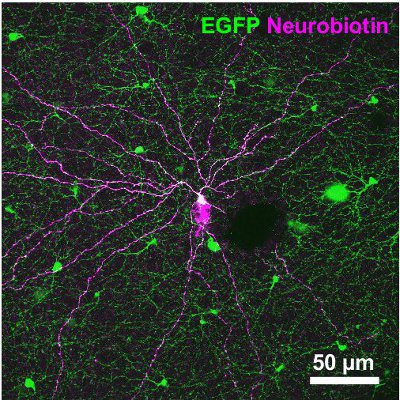
Figure 3. Morphologie d'un type 2 de cellules injectées avec le Neurobiotin traceur. Le traceur est ensuite visualisé par streptavidine-Cy3 contraignant (magenta). La micrographie, qui est également représentant le signal GFP (green), est une projection de piles d'images couvrant la GCL et l'IPL. La barre d'échelle, 50 um.
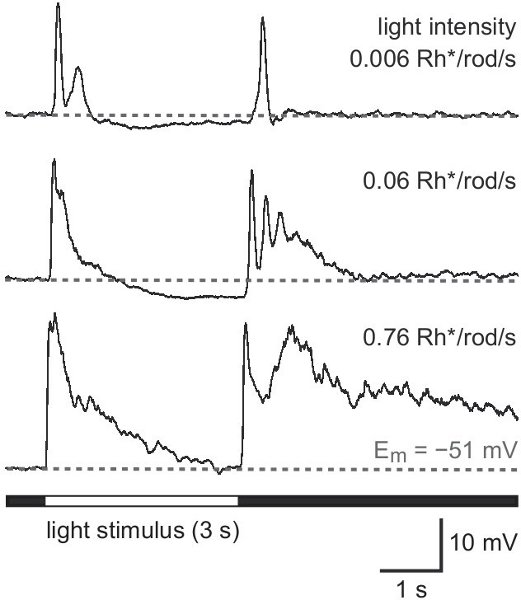
Figure 4. Lumière des réponses d'une cellule de type 2 situé dans le GCL. Modèle de réponse à la lumière blanche plein champ d'illumination d'intensité croissante dans la gamme scotopique. L'intensité du stimulus est donné dans photoisomerizations par canne par seconde (Rh * / tige / s). Un stimulus prolongé de 3 s a été utilisé pour une meilleure distinctesions des éléments de réponse au début du stimulus (sur la réponse) et offset (OFF réponse).
Discussion
Cette méthode offre la possibilité d'étudier les propriétés électriques des neurones spécifiques de la rétine intacte sous guidage visuel sans influencer la condition d'adaptation de la rétine. Il est particulièrement adapté pour la caractérisation des cellules qui sont à présent assez mal étudiés en raison de la faible densité démographique, comme la plupart des populations de cellules amacrines. Excitation à deux photons permet l'imagerie à haute résolution et haut contraste même de parties plus profondes du tissu 17, une condition préalable pour un ciblage précis et réussi le patch-clamp de cellules en particulier dans l'INL avec sa forte densité de corps cellulaires.
La rétine de souris isolé est viable pour les 3-4 h dans les conditions expérimentales. Si la rétine seconde est stocké dans l'obscurité totale dans le gazage carbogène continue, il conserve la couleur pourpre du photopigment écrus et peut être utilisé après avoir terminé les expériences avec la rétine en premier. Au début, en ciblant lescellule sélectionnée à la micropipette dans la rétine wholemount est un peu difficile et requiert une certaine pratique, surtout quand on travaille dans l'obscurité. Incluant un colorant fluorescent dans la micropipette peut simplifier la procédure, car la cellule et micropipette sont visibles sous excitation à deux photons dans le même temps. Toutefois, l'ajout de composants de la solution intracellulaire peut entraver la formation ou de causer gigaseal la qualité d'enregistrement à souffrir. Une fois réalisée avec succès, un bon enregistrement peut durer pendant environ 1 h.
Alors que la lumière d'excitation infrarouge lui-même est seulement mal absorbée par les photorécepteurs rétiniens, excité exprimant la GFP cellules émettent de la lumière dans la partie visible du spectre. Toutefois, les fluorophores sont excités seulement dans un petit volume focal qui n'est pas susceptible de modifier la condition d'adaptation de la rétine. D'autant plus, l'excitation est nécessaire seulement pour le ciblage et peut être désactivée pendant l'enregistrement des réponses de lumière.
Le usefulnESS de cette approche est déjà démontré par des études sur des populations spécifiques de cellules amacrines 14,18 à partir de laquelle des enregistrements électrophysiologiques, autrement, aurait été possible que par accident 12. Enfin, cette technique puissante peut encore être prolongée par une approche pharmacologique incluant 14, Ca 2 + imagerie 19 ou en utilisant des cellules injectées pour des études immunocytochimiques ou la microscopie électronique. De cette façon, la position fonctionnelle d'un type cellulaire donné dans le circuit de la rétine peut être démêlé.
Déclarations de divulgation
Les souris ont été traitées et euthanasiés conformément aux directives institutionnelles pour la protection des animaux et les lois sur l'expérimentation animale délivré par le gouvernement allemand.
Remerciements
Ce travail a été soutenu par la Deutsche Forschungsgemeinschaft (WE849/16 1 / 2 à KD et RW). Nous sommes reconnaissants à Thomas d'Euler (Töbingen, Allemagne) pour le QDS la lumière du logiciel de stimulation.
matériels
| Name | Company | Catalog Number | Comments |
| Réactif / Equip-ment | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Lunettes de vision nocturne | Gutzeit GmbH, Warthausen, Allemagne | Xtron F1 | comprend une source de lumière à 800 nm |
| Filtre optique | Schott, Mayence, Allemagne | RG9 | longpass filtre avec coupure à 690 nm |
| Ciseaux Iris | Outils Fine Science | 14061-09 | courbé avec lame 22 mm |
| Ciseaux de printemps | Outils Fine Science | 15000-00 | droite avec 3 lames mm |
| Chambre d'enregistrement | Luigs & Neumann GmbH, Ratingen, Allemagne | 200 à 100 500 0180 type A (TC) | Teflon chambre avec fond monté sur lamelle de verre (environ 0,15 mm, n ° 200-100 500 0182) |
| Chauffe-eau | Systèmes multicanaux, Reutlingen, Allemagne | PH01, TC01 | canule de perfusion chauffable avec la température scontrôleur de température et Ensor |
| Microscope à balayage laser | Leica Microsystems | DM EPA | contrôlée par Leica Confocal Software |
| Air de table | Newport | VH 3036W-OPT | |
| Laser | Spectra-Physics | Mode verrouillé tsunami Ti: saphir au laser | |
| La caméra CCD | BCP SA, Kelheim, Allemagne | PixelFly QE | y compris les logiciels de contrôle |
| Micropipette de verre capillaires | Hilgenberg, Malsfeld, Allemagne | 1408411 | |
| Micropipette extracteur | Instrument Sutter | P-97 | |
| Alexa Fluor 594 | Invitrogen | A-20004 | colorant fluorescent |
| Neurobiotin | Axxora | VC-SP-1120-M050 | non fluorescent traceur |
| Streptavidine-Cy3 | Dianova | 016-160-084 | |
| Micromanipulator | Luigs & Neumann GmbH, Ratingen, Allemagne | 210-100 000 0010 | motorisée Mini25 unité de manipulateur avec affichage SM-5 |
| Amplificateur de patch-clamp | npi electronic GmbH, Tamm, Allemagne | SEC-05LX npi | |
| Digitizer | National Instruments | BNC-2090 | |
| L'acquisition de données du logiciel WinWCP | John Dempster, Université de l'Ecosse, Glasgow, Royaume-Uni | http://spider.science.strath. ac.uk / sipbs / software.htm | |
| QDS générateur de stimulus visuel | Thomas Euler, Université de Tübingen, Allemagne | doit être exploité sur un ordinateur séparé la commande de 2 moniteurs (interface utilisateur, relance le moniteur) | |
| Les filtres neutres | ITOS, Mainz, Allemagne |
Références
- Masland, R. H. The fundamental plan of the retina. Nat. Neurosci. 4, 877-886 (2001).
- Baccus, S. A. Timing and computation in inner retinal circuitry. Annu. Rev. Physiol. 69, 271-290 (2007).
- Haverkamp, S., Inta, D., Monyer, H., Wässle, H. Expression analysis of green fluorescent protein in retinal neurons of four transgenic mouse lines. Neuroscience. 160, 126-139 (2009).
- Siegert, S., Gross-Scherf, B., Del Punta, K., Didkovsky, N., Heintz, N., Roska, B. Genetic address book for retinal cell types. Nat. Neurosci. 12, 1197-1204 (2009).
- Svoboda, K., Yasuda, R. Principles of two-photon excitation microscopy and its applications to neuroscience. Neuron. 50, 823-839 (2006).
- Euler, T., Detwiler, P. W., Denk, B. Directionally selective calcium signals in dendrites of starburst amacrine cells. Nature. 418, 845-852 (2002).
- Sakmann, B., Neher, E. Single-Channel Recording. , Plenum Press. (1995).
- Jackson, M. B. Whole-cell voltage clamp recording. Current Protocols in Neuroscience. Gerfen, C. , Wiley. (1997).
- Majewska, A., Yiu, G., Yuste, R. A custom-made two-photon microscope and deconvolution system. Pfügers Arch. - Eur. J. Physiol. 441, 398-408 (2000).
- Yuste, R., Konnerth, A. maging in Neuroscience and Development: A Laboratory Manual. , Cold Spring Harbor Laboratory. (2005).
- Euler, T., Hausselt, S. E., Margolis, D. J., Breuninger, T., Castell, X., Detwiler, P. B., Denk, W. Eyecup scope - optical recordings of light stimulus-evoked fluorescence signals in the retina. Pflügers Arch. - Eur. J. Physiol. 457, 1393-1414 (2009).
- Wei, W., Elstrott, J., Feller, M. B. Two-photon targeted recording of GFP-expressing neurons for light responses and live-cell imaging in the mouse retina. Nat. Protoc. 5, 1347-1352 (2010).
- Matsushita, N., Okada, H., Yasoshima, Y., Takahashi, N., Kiuchi, K., Kobayashi, K. Dynamics of tyrosine hydroxylase promoter activity during midbrain dopaminergic neuron development. J. Neurochem. 82, 295-304 (2002).
- Knop, G. C., Feigenspan, A., Weiler, R., Dedek, K. Inputs underlying the ON-OFF light responses of type 2 wide-field amacrine cells in TH-GFP mice. J. Neurosci. 31, 4780-4791 (2011).
- Zhang, D. Q., Stone, J. F., Zhou, T., Ohta, H., McMahon, D. G. Characterization of genetically labeled catecholamine neurons in the mouse retina. Neuroreport. 15, 1761-1765 (2004).
- Contini, M., Lin, B., Kobayashi, K., Okano, H., Masland, R. H., Raviola, E. Synaptic input to ON-biploar cells onto the dopaminergic neurons of the mouse retina. J. Comp. Neurol. 518, 2035-2050 (2010).
- Helmchen, F., Denk, W. Deep tissue two-photon microscopy. Nat. Methods. 2, 932-940 (2005).
- Dedek, K., Breuninger, T., de Sevilla Müller, L. P., Maxeiner, S., Schultz, K., Janssen-Bienhold, U., Willecke, K., Euler, T., Weiler, R. A novel type of interplexiform amacrine cell in the mouse retina. Eur. J. Neurosci. 30, 217-228 (2009).
- Denk, W., Detwiler, P. B. Optical recording of light-evoked calcium signals in the functionally intact retina. Proc. Natl. Acad. Sci. U.S.A. 96, 7035-7040 (1999).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon