Method Article
Análisis de la posición del ciclo celular en células de mamífero
En este artículo
Resumen
Determinar la posición del ciclo celular de una población de células, o la comprensión de cómo afectan a la proliferación de señales, puede ser fácilmente medido por citometría de flujo utilizando este protocolo. Se presenta un enfoque simple experimental para la tinción de células y la cuantificación de su posición en el ciclo celular.
Resumen
La regulación de la proliferación celular es esencial para la morfogénesis de tejidos durante el desarrollo de organismos multicelulares. Además, la pérdida de control de la proliferación celular subyace a la patología de enfermedades como el cáncer. Como tal, hay una gran necesidad de ser capaces de investigar la proliferación celular y cuantificar la proporción de células en cada fase del ciclo celular. También es de vital importancia para identificar indistintamente las células que se replican su ADN dentro de una población más grande. Desde la decisión de una célula a proliferar se realiza en la fase G1 inmediatamente antes de iniciar la síntesis de ADN y el avance en el resto del ciclo celular, la detección de la síntesis de ADN en esta etapa permite una determinación inequívoca de la situación de la regulación del crecimiento en cultivo celular experimentos.
Contenido de ADN en las células pueden ser fácilmente cuantificado por citometría de flujo de células teñidas con yoduro de propidio, un tinte de ADN intercalantes fluorescentes.Del mismo modo, la síntesis de ADN activo puede ser cuantificada por el cultivo de células en presencia de la timidina radiactiva, de recoger las células, y midiendo la incorporación de radiactividad en una fracción insoluble en ácido. Tenemos una experiencia considerable con el análisis del ciclo celular y recomendar un enfoque diferente. Se investiga la proliferación celular utilizando bromodesoxiuridina / fluorodesoxiuridina (abreviado simplemente como BrdU) tinción que detecta la incorporación de estos análogos de la timina en el ADN sintetizado recientemente. El etiquetado y la tinción de las células con BrdU, junto con la tinción de ADN total de yoduro de propidio y análisis por citometría de flujo 1 ofrece la medida más precisa de las células en las distintas fases del ciclo celular. Es nuestro método preferido, ya que combina la detección de la síntesis de ADN activa, mediante la tinción de BrdU basados en anticuerpos, con un contenido total de ADN de yoduro de propidio. Esto permite la separación clara de las células en el G1 de primera fase S, o S a finales de la fase G2 / M.Además, este enfoque puede ser utilizado para investigar los efectos de muchos estímulos diferentes de células y agentes farmacológicos en la regulación de la progresión a través de estas diferentes fases del ciclo celular.
En este informe se describen los métodos para el etiquetado y la tinción de las células en cultivo, así como su análisis por citometría de flujo. También se incluyen ejemplos experimentales de cómo este método puede ser utilizado para medir los efectos de las señales que inhiben el crecimiento de las citocinas como el TGF-β1, y los inhibidores de proliferación, como el inhibidor de la quinasa dependiente de ciclina, p27Kip1. También se incluye un protocolo alternativo que permita el análisis de la posición del ciclo celular en una subpoblación de células dentro de una cultura más amplia 5. En este caso, se demuestra cómo detectar una detención del ciclo celular en células transfectadas con el gen del retinoblastoma, aun cuando en gran medida superados en número por las células no transfectadas en la misma cultura. Estos ejemplos ilustran las muchas formas en que la tinción de ADN ycitometría de flujo pueden ser utilizados y adaptados para investigar cuestiones fundamentales de control de ciclo celular de mamífero.
Protocolo
1. El etiquetado y la fijación de las células
- Añadir 1 l de reactivo de marcaje proliferación celular (BrdU) por ml de medio de cultivo celular (1 a 1000 de dilución) 1 hora antes de la cosecha. El período de etiquetado puede ser necesario alargar más lento crecimiento de las células.
- A las células de la cosecha, medio de cultivo, aspire y lave a fondo con solución salina de fosfato (PBS). Repita la operación para eliminar completamente los rastros de mediano plazo.
- Lávese las culturas rápidamente por tercera vez con PBS que contenía 3 mM EDTA y aspire a fondo.
- Añadir un pequeño volumen de PBS que contenía 3 mM EDTA para cada plato, de 0,5 ml para una placa de 6 cm es ideal. Se incuba a 22 ° C durante aproximadamente 5 minutos para separar las células. Transferir a un tubo cónico de 15 ml.
- Las células se centrifugan a 500 xg durante 5 minutos para que sedimenten, eliminar el sobrenadante y se resuspenden a fondo en 100 l de PBS.
- Fijar las células mediante la adición de 5 ml de EtOH al 95%, gota a gota, mientras agitación. En esta etapa, las células pueden ser almacenadas a 4 º C durante al menos unmes.
2. La desnaturalización y la tinción de BrdU y el ADN
- Centrifugar las células a 500 xg durante 5 minutos para precipitar las células y eliminar EtOH al 95%. Resuspender en 1 ml de HCl 2N y el 0,5% Tx-100 mediante la adición de una forma gota a gota mientras agitación. Incube a temperatura ambiente durante 30 minutos.
- Centrifugar como antes en la sección 2.1 y cuidadosamente aspirado sobrenadante ya que las células forman un sedimento muy suelto en este paso. Resuspenda suavemente en 1 ml de 0,1 M NaB 4 O 7 (pH 8,5) y se incuba durante al menos 30 minutos a temperatura ambiente.
- Precipitar las células como anteriormente en la sección 2.1 y resuspender en 0,5 ml de solución de anticuerpos (PBS con BSA al 1% y el 0,2% de Tween-20) con el ratón anti-BrdU anticuerpos diluido 1 a 50. Incube a temperatura ambiente durante 30 minutos.
- Precipitar las células de nuevo y volver a suspender en 50 ml de solución de anticuerpos de conejo que contiene anticuerpos anti-ratón secundario conjugado con FITC diluido 1 a 25. Incubar durante 30 minutosmesa de trabajo y protegerlo de la luz.
- Centrifugar las células por última vez y volver a suspender en 0,5 ml de yoduro de propidio y RNasa solución (PI-RNasa solución PBS con BSA al 1%, 10 mg / ml de yoduro de propidio, 0,25 mg / mL de RNasa A) y se incuban en la oscuridad a 37 ° C durante 30 minutos. Por otra parte el ARN puede ser digerido la noche a 4 ° C en la oscuridad.
- Pase solución a través de un colador para eliminar los agregados de células y recoger las células individuales en un tubo apropiado para la captación de muestras en el citómetro de flujo. Una vez más, las muestras deben ser protegidos de la exposición directa a la luz.
3. El análisis por citometría de flujo
- Las células deben ser analizados por un citómetro de flujo estándar que es capaz de discriminar a los dobletes (dos células que pasan a través de la celda de flujo como una sola) con capacidad de detección adecuados para yoduro de propidio y FITC. Las células individuales se pueden detectar en esta solicitud de citometría de flujo por puerta de enlace para los eventos basados en dispersión frontal y lateral emergente de dispersiónpoblaciones, y mediante el uso de las propiedades de tinción de ADN yoduro de propidio. La apariencia de un gráfico de puntos discriminar doblete varía entre citómetros de flujo y se basa en las propiedades de yoduro de propidio tinción, consulte a su centro local de citometría de flujo para el asesoramiento en la creación de un discriminador de doblete en su análisis. En general, en una población de forma asíncrona la proliferación de las células, las células individuales son por lo general los dos picos más abundante (2N y 4N ADN) en la parcela discriminar doblete y una puerta debe ser dibujado a su alrededor. Se seleccionará un solo eventos celulares que se utilizan para todos los análisis posteriores a continuación.
- La primera muestra a analizar debe ser una cultura de forma asíncrona proliferación que sirve como un control positivo para la tinción y citometría de flujo de configuración. Ajustar la sensibilidad de los tubos fotomultiplicadores para la tinción de yoduro de propidio de tal manera que los picos de 2N y 4N a partir de células singlete se centran en 200 y 400 (unidades arbitrarias) en el eje X. A menudo una mancha s abundanteSUMINISTRO de estas células para asegurarse de que todos los parámetros de la citometría de flujo se han ajustado adecuadamente sin necesidad de utilizar esta muestra. Este control positivo es también útil para los nuevos usuarios se familiaricen con el funcionamiento del citómetro de flujo.
- Ajustar la sensibilidad del tubo fotomultiplicador para la detección de FITC de tal manera que las poblaciones de G1 y G2 / M están por encima del fondo. Células BrdU positivas debe ser aproximadamente 10 veces más brillante y el eje Y debe mostrarse como una escala logarítmica. A veces es útil incluir un control negativo para la tinción de BrdU (mediante la sustitución de los anticuerpos anti-BrdU con no específica de IgG en el paso 2.3) para distinguir claramente las células marcadas positivamente.
- Ajuste la compensación entre yoduro de propidio y FITC de tal manera que solo los eventos capturados por la forma citómetro de flujo de un arco en forma de herradura de G1 en la parte inferior izquierda hasta la fase S y hacia abajo en la parte inferior derecha de G2 / M. Por favor, consulte la siguiente referencia para un análisis más profundo disdiscusión de los principios y el uso de citometría de flujo y las referencias allí para aplicaciones específicas 2.
4. Análisis de datos
- 5 000 a 10 000 eventos de células individuales con el rango deseado de contenido de ADN se deben recoger para cada muestra con el fin de tener confianza en que la población de células en el cultivo han sido totalmente incluidos en la muestra.
- Una vez que las células se han medido de yoduro de propidio y BrdU contenido que necesitan para ser asignados a las fases G1, S o G2 / M. Para ello, la elaboración puertas alrededor de las dos poblaciones BrdU negativa centrada en 200 y 400 (G1 y G2 / M, respectivamente). Todo por encima de estas cajas deben ser incluidos en una sola puerta que las medidas de la fase S (Fig. 1A). El porcentaje de células en cada puerta representa el número relativo de células en G1, S y G2 / M (Fig. 1B).
5. Protocolo alternativo para el análisis del ciclo celular en una población mixta de células
- Este protocolo alternativomás útil cuando la transfección de vectores de expresión habitualmente resulta en un bajo porcentaje de células que expresan el producto del gen de interés, o cuando el tratamiento farmacológico para seleccionar una población pura de células no es práctico. Esto se traduce en una proporción relativamente pequeña de células de interés están contaminados con una gran población de células untransduced. En este caso, co-transfectar plásmidos que expresan el gen o del shRNA de interés junto con un plásmido que expresa un marcador para la detección de células transfectadas mediante citometría de flujo, tales como una membrana anclada GFP 3, o un marcador de superficie celular CD19 extranjeros como 4 o CD20 5.
- A los efectos de este protocolo vamos a utilizar CD20 tinción como un ejemplo, sin embargo, la tinción de CD19 es esencialmente idéntico. En el caso de la transfección con CD20, no hay necesidad de etiquetar BrdU, sólo las células de la cosecha tal como se describe en los pasos 1,2 a 1,5 por encima de la mancha y por la adición de 20 l FITC conjugado con anticuerpos anti-CD20 a las células en el ice durante 20 minutos en la oscuridad. Fijar las células como se describe en 1.6 paso. Las células una vez más se pueden almacenar por lo menos durante un mes a 4 ° C en la oscuridad. Para la detección de buenas prácticas agrarias, omita la tinción de anticuerpos a partir de este paso y fijar y almacenar las células como se describe.
- Re-hidratar las células de granulación en la centrífuga a 500 xg durante 5 minutos y resuspender en 5 ml de PBS con 1% BSA.
- Vuelva a que sedimenten las células a 500 xg durante 5 minutos y suspender las células en 0,5 ml de yoduro de propidio y la solución de RNasa como se describió anteriormente en la sección 2.5.
- Continúe siguiendo las instrucciones de preparación de células en el 2,6 y el análisis de las instrucciones en 3.1 y 3.2.
- Ajustar la sensibilidad del tubo fotomultiplicador para la detección de FITC de tal manera que las células teñidas están por encima del fondo. Idealmente, CD20-FITC células positivas se 10X a 100X más intensamente teñido de fondo y el eje de esta trama debe mostrarse como una escala logarítmica (Fig. 2A). Células CD20 positivas que son más brillantes que backg 10 vecesronda (y con la tinción de yoduro de propidio entre 200 y 400) deben ser seleccionados para la exhibición en un yoduro de propidio frente a los recuentos de células histograma como se muestra en la fig. 2C. Para las líneas celulares que expresan marcadores que sean fácilmente teñidas brillantes (es decir, 10 veces más de 100 veces por encima del fondo), el CD20 positivo de corte se debe establecer en el fondo 10 veces. La inclusión de tinción de las células más débil aumenta la variabilidad en estos experimentos, presumiblemente debido a que el gen de interés es también débilmente expresado en estas células. Para las líneas celulares que sólo el rendimiento débilmente teñidas CD20 positivos (es decir, menos de 10 veces de fondo), la determinación de un punto de corte debe realizarse con un control negativo que consiste en células CD20 manchado, no transfectadas.
- Por lo menos 1000 CD20 acontecimientos positivos se deben recoger para cada muestra. Los experimentos con menos que 1000 eventos se producen una alta variabilidad. Los paquetes de software tales como ModFit LT (Verity Software), Multi Ciclo de AV (Phoenix Flow Systems), y flujo de Jo (Árbol estrella) utilizar estimaciones matemáticas delas poblaciones G1, S y G2 / M que contribuyen a la forma de la curva en los histogramas, como los que se muestran en la figura. 2B y C.
6. Los resultados representativos:
Ofrecemos tres ejemplos de análisis experimental del ciclo celular utilizando nuestros enfoques. El primero utiliza la expresión retroviral de la dependiente de ciclina p27Kip1 inhibidor de la cinasa en fibroblastos de embriones de ratón. Veinticuatro horas después de la selección de medicamentos para la infección viral se completa, las células fueron pulso marcado con BrdU durante una hora. En este experimento, la expresión ectópica del inhibidor se utiliza para detener la proliferación de las células (Fig. 3 A y B). Como se muestra en la fig. 3B poco eventos BrdU positivos son evidentes en la puerta de la fase S en respuesta a p27. Asimismo, el porcentaje de células en fase S de células que expresan p27 es muy bajo como el diagrama de la figura. 3C. Este tipo de análisis ha sido muy eficaz en la caracterización de los defectos de control del ciclo celular en células derivadas de varias cepas de gene-dirigido ratones 6, 7, 8.
En el segundo experimento, sin transformar las células epiteliales mamarias (MCF10A) fueron tratados con la citoquina inhibidora del crecimiento, factor de crecimiento transformante beta uno (TGF-β1) durante 24 horas. Las células fueron marcadas con BrdU durante cuatro horas, inmediatamente antes de la cosecha. Como se muestra en la fig. 4 BrdU etiquetado en células en fase S disminuye en gran medida por el TGF-β1 señalización, la especificidad de nuestra coloración también se valida con un control de IgG negativo (Fig. 4C). La cuantificación de las diferentes fases del ciclo celular confirma que el TGF-β1 inhibe la proliferación de todo en la fase G1 del ciclo celular, dando lugar a una acumulación en esta fase.
En nuestro último ejemplo, el PRB deficiente SAOS-2 células son transfectadas con un vector CMV-CD20 y la expresión ya sea CMV-RB o CMV-β-Gal como control. Tres días después de transfección las células fueron cosechadas, se tiñe y fija. Análisis por citometría de flujo de estas célulass se muestra en la fig. 5. Esto demuestra la distribución del ciclo celular de las células transfectadas de control negativo (Fig. 5) en comparación con la distribución de las 72 horas siguientes de expresión pRb (Fig. 5B). Después de ajuste de curvas por el software de ciclo múltiple, una comparación directa de la proporción de las fases del ciclo celular se muestra en la fig. 5C. Esto revela la acumulación de células en la expresión G1 siguientes pRb y la disminución relativa de las células de las fases S y G2 / M. Hemos utilizado las variaciones en este ensayo para probar los mecanismos de G1 arresto ampliamente 9, 10, 11, 12, 13.
Estos ejemplos demuestran cómo el control del ciclo celular puede ser medida en respuesta a una variedad de estímulos o manipulaciones de la célula. Este enfoque por lo tanto, puede adaptarse a muchas aplicaciones que requieren la medición de la posición del ciclo celular en los experimentos de tipo cultural.

Figura 1. Quantitción de las fases del ciclo celular con yoduro de propidio combinado y la tinción de BrdU (PI-BrdU). (A) Este panel muestra tres dimensiones de la citometría de flujo con yoduro de propidio y las células BrdU manchado. Tenga en cuenta que las células con el contenido de ADN 2N y 4N se centran en los 200 y 400 marcas en la escala del eje X para la intensidad de tinción con yoduro de propidio. La intensidad de la tinción de BrdU se mide en una escala logarítmica en el eje. Tenga en cuenta la posición de compuertas utilizadas para cuantificar las células en el G1, S y G2 / M fases del ciclo celular. (B) La proporción relativa de células en cada una de las puertas de la G1, S y G2 / M de A se muestran en este gráfico.
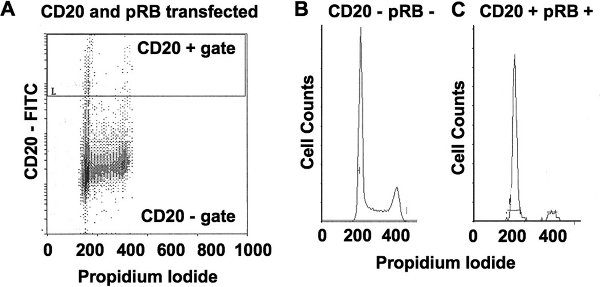
Figura 2. La cuantificación de las fases del ciclo celular en las células seleccionadas con yoduro de propidio y el CD20 de la superficie celular marcador. (A) Este panel muestra yoduro de propidio y CD20 tinción de una mezcla de células, algunas de las cuales ectópica expresan CD20 y pRB. Tenga en cuenta que las células con2N y 4N del ADN (las poblaciones más abundantes) se centran en los 200 y 400 marcas en el eje X. La posición de la puerta de CD20 + selecciona las celdas que están manchados por lo menos 10 veces más brillante que el fondo. (B) Un gráfico de los recuentos de células en comparación con tinción con yoduro de propidio se muestra de células CD20 negativas en el panel A que están proliferando de forma asíncrona. (C) Un gráfico similar se muestra de células CD20 positivas desde el panel A, que han sido inducidos a la detención con la expresión de pRb y contienen células con contenido de ADN principalmente 2N. Esto demuestra que un detenido sub-población se puede distinguir de otras células en esta cultura a través de esta técnica de tinción.

Figura 3. La inhibición de la proliferación celular por p27Kip1. (A) PI-BrdU análisis se utiliza para medir las fases del ciclo celular en una población de forma asíncrona la proliferación de células que se transduced con un vacío vecto retroviral pBaber. (B) Un análisis similar de las células transducidas con pBabe-p27. Nótese la ausencia de células en la fase S y la mayor intensidad de los eventos en G1 y puertas G2 / M. (C) La cuantificación de las células en las respectivas fases del ciclo celular en forma asíncrona de control y la proliferación de las células que expresan p27.
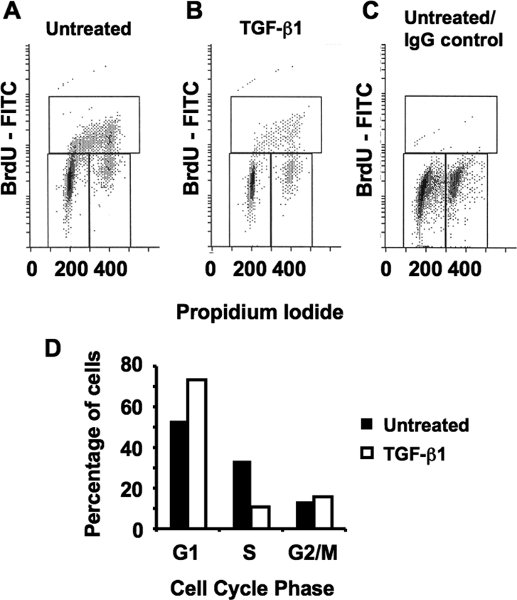
Figura 4. La inhibición de la proliferación celular por el TGF-β1 (A) PI-BrdU análisis de la proliferación de células MCF10A forma asíncrona. (B) Análisis de las células tratadas con 100 pM de TGF-β1 durante 24 horas. Tenga en cuenta la acumulación de células principalmente en la fase G1 del ciclo celular. (C) Validación de la tinción de BrdU sustituyendo el anticuerpo anti-BrdU primaria con un control no IgG específica en las células proliferan de forma asíncrona. (D) la cuantificación gráfica de las fases del ciclo celular respectivos de A y B.
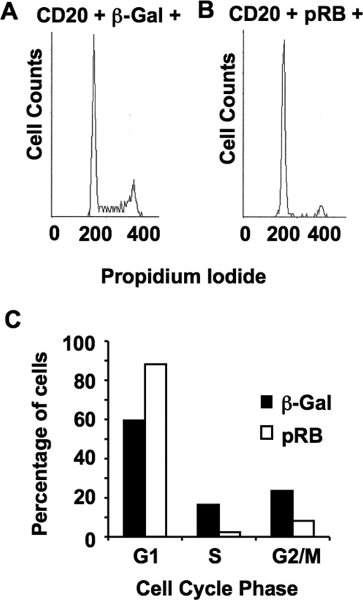
Figura 5. La inhibición de la proliferación celular por pRB. (A) Los recuentos de células en comparación con la tinción con yoduro de propidio de CD20 y ß-gal células transfectadas se muestra. Este es un importante control como parte de la transfección se puede sincronizar las células, haciendo que la población no transfectadas (CD20 - las células) como un control inadecuado de la transfectadas sub-población. Transfectadas las células deben ser comparadas con otras células transfectadas de forma análoga. (B) Los recuentos de células en comparación con el gráfico de yoduro de propidio de CD20 y pRB transfectadas las células. Tenga en cuenta la presencia casi exclusiva de un máximo de 2N. (C) La representación gráfica de las proporciones de células determinada fase del ciclo de A a B y el uso de métodos de ajuste de curvas en el software de ciclo múltiple.
Discusión
En nuestra experiencia, el éxito de estas técnicas depende de unos pocos controles clave y las condiciones experimentales. Uno de ellos es el establecimiento de un control de la proliferación de manera asíncrona para su uso en estos experimentos. Este control tiene tres propósitos importantes. En primer lugar, asegura que las condiciones de cultivo utilizado para todas las muestras experimentales son suficientes para apoyar la proliferación continua de la ausencia de tratamiento. Este ejemplo también sirve el propósito de un control positivo de la metodología de tinción para asegurarse de que BrdU o células CD20 positivas se pueden detectar cuando están presentes. Por último, la muestra se utiliza para calibrar el citómetro de flujo. Esta muestra de control se puede utilizar para ajustar la intensidad de tinción con yoduro de propidio para detectar células 2N y 4N a 200 y 400, respectivamente. Además, la sensibilidad de detección de BrdU o CD20 se puede ajustar para que las señales positivas y negativas se centran, como se muestra en las figuras 1A y 2A. Cuando todas las muestras tienen una concentración similar de células en el PI-RNase solución, entonces algunos ajustes en el citómetro se necesitan muestras posteriores se ejecutan. Esto es importante por razones de la figura. 4B y 5B, donde la acumulación de G1 fuerte crea esencialmente un pico G1 único que podría ser mal interpretada como G2 / M.
Los experimentos representante también hacen otros puntos importantes. En primer lugar, demuestran que la captación de BrdU y el etiquetado pueden variar entre los tipos de células. Por esta razón es importante para determinar empíricamente la duración del pulso y de las condiciones de coloración necesarias para detectar adecuadamente las células en fase-S. En general, los tipos de células que hacen las veces de la cultura en 24 horas o menos se pueden etiquetar con BrdU en una hora. De crecimiento más lento tipos de células pueden requerir más tiempo las legumbres y las alteraciones a las condiciones de la tinción de anticuerpos y la duración. MCF10A células son un excelente ejemplo en este sentido, ya que fueron marcadas con BrdU durante cuatro horas y se tiñeron con el doble de la concentración normal de anticuerpos en cuatro veces más. Los investigadoresdebe tener cuidado de no exceder de 6 horas de BrdU a pesar de las células de crecimiento muy lento, ya que erróneamente puede conducir a la inclusión de G2 / M en la población de células en fase S. En segundo lugar, en la comparación de los efectos de p27Kip1 expresión con los de TGF-β1, está claro que p27 puede inducir a una acumulación en cualquiera de las fases G1 y G2 / M, mientras que el TGF-β1 señalización induce una detención en G1. Los medios tradicionales de detección de la proliferación como la 3 H-timidina y recuento de centelleo son incapaces de distinguir estas posibilidades.
En nuestro protocolo alternativo que demuestran la detección de una subpoblación de células en una población mayor no transfectadas. Es importante determinar empíricamente el reportero más apropiado para la detección de las células transfectadas. En nuestra experiencia, algunos tipos de células de la superficie celular o bien expresan marcadores de mal, o no puede apropiadamente el tráfico a la membrana plasmática, resultando en una incapacidad para detectar las células transfectadas. Likewise no todas las células tolerar la forma unida a la membrana de las buenas prácticas agrarias. La selección de la reportera más apropiado debe ser hecha por la evaluación de la eficacia de transfección de la periodista, así como la intensidad relativa de expresión en comparación con los controles no transfectadas. Lo ideal es la expresión heteróloga de estas moléculas es bien tolerado y esto sugiere que los marcadores tienen poco o ningún efecto sobre la distribución del ciclo celular.
Una limitación de este tipo de métodos de citometría de flujo es que sólo son capaces de establecer las abundancias relativas de las fases del ciclo celular en comparación con los otros. Por esta razón, es ambigua si la expresión de p27 en la Figura 3 realmente induce un arresto en G1 y G2 / M, o si sólo se disminuye la progresión a través de estas fases en relación con la fase S. Estas posibilidades pueden ser investigados aún más por el tratamiento de una muestra paralela de células con un inhibidor de la mitosis, como nocodazole, o G1 / S, como inhibidor de la aphidicolin. Ya que estos fármacos crear una dominaciónnt arresto en la fase M o principios de la fase S, respectivamente, las células proliferan lentamente se acumula en el punto de arresto por drogas inducida. Por ejemplo, células detenidas en G1, debido a la expresión pRb se mantendrá en el G1 a pesar del tratamiento, mientras que nocodazole control de las células se acumulan en la fase-M 13.
En conjunto, estos enfoques experimentales ofrecen una metodología flexible que puede aplicarse a una amplia gama de preguntas de investigación de células de mamíferos ciclo. Ellos fácilmente pueden detectar alteraciones en la progresión del ciclo celular y cuantificar las diferencias en comparación con los controles.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a los Institutos Canadienses de Investigación en Salud (CIHR) y la Sociedad Canadiense del Cáncer para financiar la investigación del ciclo celular en el laboratorio. MJC es un beneficiario de una beca de MD / PhD de la CIHR. MJC y MA son miembros del programa de formación CaRTT.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / equipo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| La proliferación de células de etiquetado de reactivos | GE Amersham | RPN201 | |
| Los anticuerpos anti-BrdU | BD Biosciences | 347580 | |
| Anti-ratón conjugado con FITC Anticuerpos | Vector de los laboratorios | FI-2000 | |
| Filtros de células cepa | BD Falcon | 352235 | |
| Anticuerpos anti-CD20 | BD Biosciences | 347673 | |
| Cycle Software Multi | Phoenix Sistemas de Flujo | N / A |
Referencias
- Dolbeare, F., Gratzner, H., Pallavicini, M. G., Gray, J. W. Flow cytometric measurement of total DNA content and incorporated bromodeoxyuridine. Proc. Natl. Acad. Sci. U. S. A. 80, 5573-5573 (1983).
- Givan, A. L. Flow cytometry: an introduction. Methods. Mol. Biol. 699, 1-1 (2011).
- Kalejta, R. F., Brideau, A. D., Banfield, B. W., Beavis, A. J. An integral membrane green fluorescent protein marker, Us9-GFP, is quantitatively retained in cells during propidium iodide-based cell cycle analysis by flow cytometry. J. Exp. Cell. Res. 248, 322-322 (1999).
- Qin, X. -Q. The transcription factor E2F-1 is a downstream target of RB action. Molecular and Cellular Biology. 15, 742-742 (1995).
- van den Heuvel, S., Harlow, E. Distinct roles for cyclin-dependent kinases in cell cycle control. Science. 262, 2050-2050 ( ).
- Henley, S. A. A cancer derived mutation in the retinoblastoma gene with a distinct defect for LXCXE dependent interactions. Cancer Cell. Int. 10, 8-8 (2010).
- Francis, S. M. A functional connection between pRB and transforming growth factor beta in growth inhibition and mammary gland development. Mol. Cell. Biol. 29, 4455-4455 (2009).
- Isaac, C. E. The retinoblastoma protein regulates pericentric heterochromatin. Mol. Cell. Biol. 26, 3659-3659 (2006).
- Julian, L. M. Characterization of an E2F1-specific binding domain in pRB and its implications for apoptotic regulation. Oncogene. 27, 1572-1572 (2008).
- Hirschi, A. An overlapping kinase and phosphatase docking site regulates activity of the retinoblastoma protein. Nat. Struct. Mol. Biol. 17, 1051-1051 (2010).
- Dick, F. A., Dyson, N. pRB contains an E2F1-specific binding domain that allows E2F1-induced apoptosis to be regulated separately from other E2F activities. Mol. Cell. 12, 639-639 (2003).
- Dick, F. A., Sailhamer, E., Dyson, N. J. Mutagenesis of the pRB pocket reveals that cell cycle arrest functions are separable from binding to viral oncoproteins. Mol. Cell. Biol. 20, 3715-3715 (2000).
- Dick, F. A., Dyson, N. J. Three regions of the pRB pocket domain affect its inactivation by human papillomavirus E7 proteins. J. Virol. 76, 6224-6224 (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados