Method Article
Анализ сотового Позиция цикла в клетках млекопитающих
В этой статье
Резюме
Определение позиции клеточного цикла популяции клеток, или понимание того, как сигналы влияют на распространение, можно легко измерить с помощью проточной цитометрии с использованием этого протокола. Мы сообщаем о простой экспериментальный подход к окрашиванию клеток и количественного их положение в клеточный цикл.
Аннотация
The regulation of cell proliferation is central to tissue morphogenesis during the development of multicellular organisms. Furthermore, loss of control of cell proliferation underlies the pathology of diseases like cancer. As such there is great need to be able to investigate cell proliferation and quantitate the proportion of cells in each phase of the cell cycle. It is also of vital importance to indistinguishably identify cells that are replicating their DNA within a larger population. Since a cell′s decision to proliferate is made in the G1 phase immediately before initiating DNA synthesis and progressing through the rest of the cell cycle, detection of DNA synthesis at this stage allows for an unambiguous determination of the status of growth regulation in cell culture experiments.
DNA content in cells can be readily quantitated by flow cytometry of cells stained with propidium iodide, a fluorescent DNA intercalating dye. Similarly, active DNA synthesis can be quantitated by culturing cells in the presence of radioactive thymidine, harvesting the cells, and measuring the incorporation of radioactivity into an acid insoluble fraction. We have considerable expertise with cell cycle analysis and recommend a different approach. We Investigate cell proliferation using bromodeoxyuridine/fluorodeoxyuridine (abbreviated simply as BrdU) staining that detects the incorporation of these thymine analogs into recently synthesized DNA. Labeling and staining cells with BrdU, combined with total DNA staining by propidium iodide and analysis by flow cytometry1 offers the most accurate measure of cells in the various stages of the cell cycle. It is our preferred method because it combines the detection of active DNA synthesis, through antibody based staining of BrdU, with total DNA content from propidium iodide. This allows for the clear separation of cells in G1 from early S phase, or late S phase from G2/M. Furthermore, this approach can be utilized to investigate the effects of many different cell stimuli and pharmacologic agents on the regulation of progression through these different cell cycle phases.
In this report we describe methods for labeling and staining cultured cells, as well as their analysis by flow cytometry. We also include experimental examples of how this method can be used to measure the effects of growth inhibiting signals from cytokines such as TGF-β1, and proliferative inhibitors such as the cyclin dependent kinase inhibitor, p27KIP1. We also include an alternate protocol that allows for the analysis of cell cycle position in a sub-population of cells within a larger culture5. In this case, we demonstrate how to detect a cell cycle arrest in cells transfected with the retinoblastoma gene even when greatly outnumbered by untransfected cells in the same culture. These examples illustrate the many ways that DNA staining and flow cytometry can be utilized and adapted to investigate fundamental questions of mammalian cell cycle control.
протокол
1. Маркировка и фиксации клеток
- Добавить 1 мкл клеточной пролиферации маркировка реагентов (BrdU) на мл клеточной среде культуры (от 1 до 1000 разбавления) за 1 час до сбора урожая. Маркировка период, возможно, придется быть увеличена для более медленных растущих клеток.
- Для уборки клетки, аспирацию культуральной среде и тщательно промыть фосфатным буферным раствором (PBS). Повторите, чтобы полностью удалить следы среды.
- Вымойте культур быстро третий раз PBS содержащего 3 мМ ЭДТА и аспирата тщательно.
- Добавить небольшим объемом PBS содержащего 3 мМ ЭДТА к каждому блюду, 0,5 мл для 6 см блюдо идеально. Инкубировать при 22 ° С в течение примерно 5 минут, чтобы отделить клетки. Трансфер в 15 мл коническую трубку.
- Центрифуга клетки при 500 мкг в течение 5 минут, чтобы шарик, удалить супернатант, и ресуспендируют тщательно в 100 мкл PBS.
- Fix клетки, добавляя 5 мл 95% этанола, по каплям, а вортексе. На данном этапе клетки можно хранить при температуре 4 ° С в течение по крайней мерев месяц.
2. Денатурирующих и окрашивание BrdU и ДНК
- Центрифуга клетки при 500 мкг в течение 5 минут для осаждения клеток и удаляет 95% этанола. Ресуспендируют в 1 мл 2N HCl и 0,5% ТХ-100, добавив в капле мудрый моде в то время как вортексе. Инкубируйте при комнатной температуре в течение 30 минут.
- Центрифуга, как до этого в разделе 2.1 и тщательно аспирата супернатант с клетки образуют очень свободной гранул на этот шаг. Аккуратно ресуспендируют в 1 мл 0,1 М NaB 4 O 7 (рН 8,5) и инкубировали в течение не менее 30 минут при комнатной температуре.
- Гранул клетки, что и выше в разделе 2.1 и ресуспендируют в 0,5 мл раствора антител (PBS, содержащим 1% BSA и 0,2% Твин-20) с помощью мыши анти-BrdU антителами разбавленного 1 до 50. Инкубируйте при комнатной температуре в течение 30 минут.
- Гранул клетки снова и ресуспендируют в 50 мл раствора, содержащего антитела кролика антимышиным вторичных антител, конъюгированных с FITC разбавленного 1 до 25. Инкубируйте в течение 30 минут нанастольный и защиты от света.
- Центрифуга клетки последний раз и ресуспендируют в 0,5 мл пропидий йодида и РНКазы решение (PI-РНКазы решение, PBS с 1% BSA, 10 мг / мл пропидий йодид, 0,25 мг / мл РНКазы) и инкубировать в темноте при 37 ° С в течение 30 минут. Кроме РНК могут быть переварены в течение ночи при 4 ° С в темноте.
- Pass раствор через сито ячейка для удаления агрегатов и собирать отдельные клетки в соответствующей трубки для образца поглощение на проточный цитометр. Опять же, образцы должны быть защищены от прямого воздействия света.
3. Анализ с помощью проточной цитометрии
- Клетки должны быть проанализированы стандартные цитометр потока, способного дискриминации дублеты (две клетки, которые проходят через проточную ячейку как один) с соответствующими возможностями обнаружения пропидий йодида и FITC. Отдельные клетки могут быть обнаружены в этом приложении цитометрии потока стробирования для проведения мероприятий на основе рассеяния вперед и боковые разброс попulations, и, используя свойства ДНК окрашивания йодистым пропидий. Появление дублета дискриминацию участок точка колеблется от потока цитометров и полагается на пропидий свойств окрашивания йодид, обратитесь к местному пункту проточной цитометрии для консультаций по созданию дублет дискриминатора в вашем анализе. В общем, в асинхронном пролиферирующих популяцию клеток, отдельных клеток, как правило, два самых распространенных пиков (2N и 4N ДНК) в дублет дискриминацию сюжет и ворота должны быть сделаны вокруг них. Это позволит выбрать отдельные события ячейки, которые используются для последующего анализа все ниже.
- Первый образец для анализа должно быть асинхронно пролиферирующие культуры, которая выступает в качестве положительного контроля для окрашивания и проточного цитометра настройки. Отрегулируйте чувствительность фотоэлектронных умножителей для пропидий йодида окрашивания, что 2N и 4N пиков от синглетного клетки с центром в 200 и 400 (условных единицах) на оси абсцисс. Мы часто пятна обильные ыupply этих клеток, чтобы все параметры потока цитометр были скорректированной надлежащим образом, не используя этот образец. Это положительный контроль также полезна для новых пользователей, чтобы лучше ознакомиться с работой проточного цитометра.
- Настройка чувствительности ФЭУ для обнаружения FITC, что G1 и G2 / M популяции выше фона. BrdU-положительных клеток должна быть примерно в 10 раз ярче и Y-оси должны быть отображены как в логарифмической шкале. Это иногда полезно включить отрицательного контроля для окрашивания BrdU (заменив анти-BrdU антител с неспецифическим IgG в шаге 2.3 выше), чтобы четко различать положительно окрашенных клеток.
- Настройте компенсацию между пропидий йодида и FITC, что единичные события, захваченные форме потока цитометр подковы форму дуги от G1 в левом нижнем углу до S-фазе и вниз в правом нижнем углу для G2 / M. Пожалуйста, смотрите следующие ссылки для более глубокого расдение принципов и использование проточной цитометрии и ссылки там для определенных приложений 2.
4. Анализ данных
- 5 000 до 10 000 единичных событий ячейки с желаемый диапазон содержания ДНК должны быть собраны для каждого образца, чтобы иметь уверенность, что популяция клеток в культуре были тщательно выборку.
- Как только клетки были измерены пропидий йодида и BrdU содержания, они должны быть возложены на G1, S, G2 / M фазах. Для этого рисунок ворот вокруг двух BrdU отрицательные населения с центром в 200 и 400 (G1 и G2 / M, соответственно). Все, что выше этих ящиках должны быть включены в одну ворота, что меры, S-фазе (рис. 1А). Процент клеток в каждых ворот представляет относительное число клеток в G1, S и G2 / M (рис. 1б).
5. Альтернативный протокол для анализа клеточного цикла в смешанной популяции клеток
- Этот дополнительный протоколНаиболее полезно при трансфекции векторов экспрессии обычно приводит к низким процентом клеток, экспрессирующих ген продукт представляет интерес, или когда наркологические выбрать чистую популяцию клеток нецелесообразно. Это приводит к относительно небольшой части клеток интерес будучи загрязненными большой популяции untransduced клеток. В этом случае, со-трансфекции плазмиды выражения вашей гена или shRNA интерес наряду с плазмиды, что выражает маркером для выявления трансфицированных клеток методом проточной цитометрии, таких как мембраны закреплены GFP 3, или иностранные маркер клеточной поверхности, такие как CD19 4 или CD20 5.
- Для целей настоящего Протокола, мы будем использовать CD20 окрашивания в качестве примера, однако, окрашивание на CD19 по сути идентичны. В случае трансфекции CD20, нет необходимости маркировать BrdU, просто урожай клетки как описано в шагах 1,2 до 1,5 выше, и пятно, добавляя 20 мкл FITC сопряженных анти-CD20 антитела к клеткам на ясе в течение 20 минут в темноте. Fix клетки, как описано в пункте 1.6. Клетки могут снова быть сохранена, по крайней мере месяц при 4 ° С в темноте. Для обнаружения GFP, опустите антител окрашивания от этого шага и закрепить и сохранить клетки, как описано.
- Re-гидрата клеток гранулирования в центрифуге при 500 мкг в течение 5 минут и ресуспендирования в 5 мл PBS, содержащим 1% BSA.
- Re гранул клетки при 500 мкг в течение 5 минут и ресуспендируют клеток в 0,5 мл пропидий йодида и РНКазы раствора, как описано выше в разделе 2.5.
- Продолжайте следовать инструкциям ячейки препарата в 2,6 и анализ инструкциям в 3.1 и 3.2.
- Настройка чувствительности ФЭУ для обнаружения FITC, что неокрашенные клетки выше фона. В идеале, CD20-FITC-положительных клеток будет 10х до 100х более интенсивно окрашенной, чем фоном и Y-оси этого графика должны отображаться как логарифмическая шкала (рис. 2A). CD20-положительных клеток, которые в 10 раз ярче, чем backgкруглые (и с пропидий йодида окрашивание между 200 и 400) должны быть выбраны для показа в пропидий йодид против клеток гистограммы, как показано на рис. 2C. Для клеточных линий, выражающих маркеры, которые легко окрашенных ярко (т.е. в 10 раз до 100X выше фона) CD20 положительных отсечения должна быть установлена на 10X фоне. Включение слабого окрашивания клетки увеличивается изменчивость в этих экспериментах, предположительно потому, что интерес гена также слабо выражены в этих клетках. Для клеточных линий, что только выход слабо окрашенных CD20 срабатываний (т.е. в 10 раз меньше, чем фон), определение отрезаны должны быть сделаны с помощью негативного контроля, состоящий из CD20 с пятнами, untransfected клеток.
- По крайней мере, 1000 CD20 позитивных событий следует собирать для каждого образца. Эксперименты с меньшим количеством событий, что 1000 будет производить высокую изменчивость. Пакеты программ, таких как ModFit LT (Verity Software), Multi цикла А. В. (Phoenix потока системы), и поток Джо (Tree Star) использовать математические оценкиG1, S и G2 / M населения, которые способствуют форму кривой гистограммы таких, как показано на рис. 2B и C.
6. Представитель Результаты:
Мы предлагаем три примера экспериментальных клеточного цикла анализа с использованием наших подходов. Первый использует ретровирусных выражение циклинзависимой p27KIP1 ингибитор киназы в мышиных эмбриональных фибробластов. Двадцать четыре часа после приема отбора на вирусную инфекцию была завершена, клетки были помечены импульса BrdU в течение одного часа. В этом эксперименте эктопической экспрессии ингибитора используется для ареста пролиферации клеток (рис. 3А, Б). Как показано на рис. 3B немного BrdU позитивных событий очевидны в S-фазе ворота в ответ на р27. Кроме того, процент клеток в S-фазе клеток, экспрессирующих р27 является довольно низким, как схематически на рис. 3C. Этот тип анализа был очень эффективным для характеристики клеточного цикла контроля дефектов в клетках, взятых из различных штаммов ген-целевых 6 мышей, 7, 8.
Во втором эксперименте, непреобразованных молочной эпителиальных клеток (MCF10A) лечили ингибирования роста цитокинов, трансформирующий фактор роста бета-один (TGF-β1) в течение 24 часов. Клетки были помечены BrdU в течение четырех часов непосредственно до сбора урожая. Как показано на рис. 4 BrdU маркировки в S-фазе клеток значительно уменьшается на TGF-β1 сигнализации, специфика нашего окрашивание также подтверждены IgG отрицательного контроля (рис. 4в). Количественная оценка разных фазах клеточного цикла подтверждает, что TGF-β1 в первую очередь подавляет пролиферацию в G1 фазе клеточного цикла, что приводит к накоплению в этой фазе.
В нашем последнем примере, PRB недостаточно SaOS-2 клетки трансфицированных ЦМВ-вектор экспрессии CD20 и либо ЦМВ-RB или ЦМВ-β-Gal в качестве контроля. Через три дня после трансфекции клетки собирали, с пятнами, и фиксированный. Проточная цитометрия Анализ этих клеточныхS показана на рис. 5. Это показывает, распределение клеточного цикла отрицательного контроля трансфекции клеток (рис. 5а) по сравнению с распределением следующих 72 часов выражение PRB (рис. 5б). После построения кривой по многопользовательская программного цикла, прямое сравнение доли фазы клеточного цикла показана на рис. 5C. Это показывает накопление клеток в G1 следующее выражение PRB и относительное истощение клеток из S и G2 / M фазах. Мы использовали вариации на этом анализе, чтобы исследовать G1 арест механизмы широко 9, 10, 11, 12, 13.
Эти примеры демонстрируют, как контроль клеточного цикла может быть измерена в ответ на различные раздражители или клеточных манипуляций. Этот подход может быть адаптирован для многих приложений, которые требуют измерения клеточного цикла позиции в экспериментах культуры типа.

Рисунок 1. Quantitation фаз клеточного цикла комбинированной йодида пропидий и BrdU окрашивание (PI-BrdU). () На этой панели отображаются трехмерные цитометрии потока пропидий йодида и клетки BrdU окрашенные. Обратите внимание, что клетки с 2N и 4N содержание ДНК сосредоточены более 200 и 400 баллов по оси абсцисс шкала пропидий интенсивности окрашивания йодида. BrdU интенсивность окрашивания измеряется по логарифмической шкале по оси ординат. Обратите внимание на положение ворота использовались для количественного клеток в G1, S и G2 / M фазах клеточного цикла. (B), относительная доля клеток в каждом из G1, S и G2 / M от ворот показаны на графике.
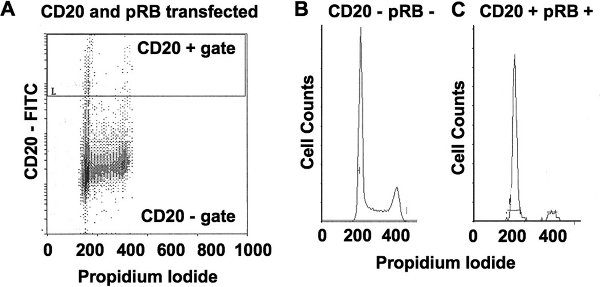
Рисунок 2. Количественный анализ клеточного цикла фазы в отдельных клеток с использованием пропидий йодида и маркер CD20 клеточной поверхности. () Эта панель показывает пропидий йодида и CD20 окрашивание на смесь клеток, некоторые из которых эктопически выразить CD20 и PRB. Обратите внимание, что клетки с2N и 4N ДНК (наиболее распространенных групп населения) сосредоточены более 200 и 400 баллов по X-оси. Положение CD20 + ворота отбирает клетки, которые окрашивали по крайней мере 10 раз ярче, чем фон. (Б) график клеток по сравнению с окрашиванием йодида пропидий показана для CD20 негативные клетки в панели, которые асинхронно распространяются. (C) аналогичный график приведен для CD20 позитивных клеток из панелей, которые были вызваны на арест с выражением PRB и содержат клетки с ДНК, в первую очередь 2N содержания. Это показывает, что арестован подгруппы населения можно отличить от других клеток в этой культуре с помощью этой техники окрашивания.

Рисунок 3. Ингибирование пролиферации клеток путем p27KIP1. (А) PI-BrdU анализ используется для измерения фазы клеточного цикла в асинхронном пролиферирующих популяцию клеток, которые были трансдуцированных с пустыми pBABE ретровирусных Vectoг. (B) Аналогичный анализ клеток трансдуцированных с pBABE-р27. Обратите внимание на отсутствие клеток в S-фазе и большей интенсивностью событий в G1 и G2 / M ворота. (C) Количественный клеток в соответствующих фазах клеточного цикла в асинхронном пролиферирующих контроля и р27 экспрессирующие клетки.
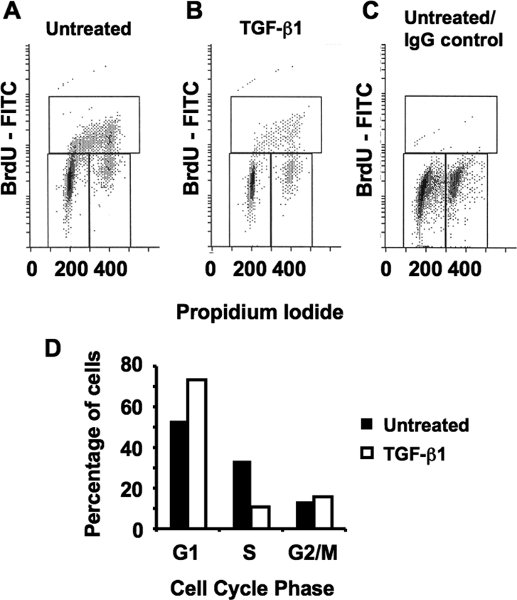
Рисунок 4. Ингибирование пролиферации клеток на TGF-β1 () PI-BrdU анализ асинхронно пролиферирующих MCF10A клеток. (B) Анализ клеток, обработанных 100 мкм ТФР-β1 в течение 24 часов. Обратите внимание, накопление клеток в первую очередь в G1 фазе клеточного цикла. (C) Проверка BrdU окрашивание заменив анти-BrdU первичных антител с неспецифические IgG контроля в асинхронном пролиферирующих клеток. (D) Графический количественного определения соответствующих фазах клеточного цикла от А и В.
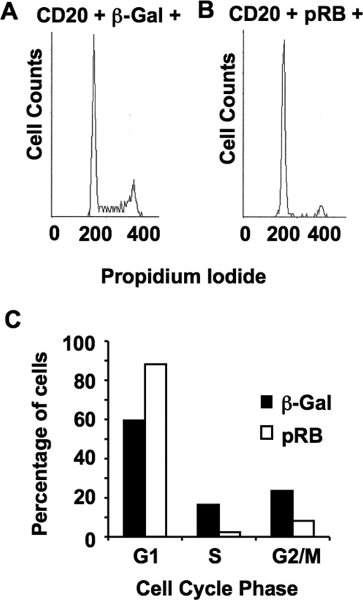
Рисунок 5. Ингибирование пролиферации клеток от PRB. (А)-клеток по сравнению с пропидий окрашивания иодид CD20 и ß-гал трансфекции клеток показано на рисунке. Это очень важный контроль как трансфекции может частично синхронизировать клетки, оказание untransfected населения (CD20 - клеток), как неуместно управления для трансфекции подгруппы населения. Трансфицированных клеток должны быть по сравнению с другими аналогично трансфекции клеток. (B)-клеток по сравнению с пропидий график иодид CD20 и PRB трансфекции клеток. Обратите внимание почти исключительно наличием 2N пика. (C) Графическое представление клеточного цикла пропорций фазы определяется из А и В, использованием методов подгонки кривой в Мульти программного цикла.
Обсуждение
По нашему опыту, успех этих методов зависит от нескольких ключевых элементов управления и условий эксперимента. Одним из них является создание асинхронно пролиферирующих управления для использования в этих экспериментах. Этот регулятор служит трем важным целям. Во-первых, это гарантирует, что условия культивирования используется для всех экспериментальных образцов являются достаточными для поддержки постоянной распространения в отсутствие лечения. Этот пример также служит для положительного контроля для окрашивания методологии для обеспечения того, чтобы BrdU или CD20 позитивных клеток могут быть обнаружены, когда они присутствуют. Наконец, этот образец используется для калибровки проточного цитометра. Этот контрольный образец может быть использован для настройки пропидий интенсивности окрашивания йодистым обнаружить 2N и 4N клетки при 200 и 400 соответственно. Кроме того, выявление чувствительности BrdU или CD20 может быть отрегулирована так, что негативные и позитивные сигналы в центре, как показано на рисунках 1А и 2А. Когда все образцы аналогичной концентрации клеток в PI-RNase решение, то некоторые корректировки цитометр нужны как последующие образцы перспективе. Это важно по причинам, показанный на рис. 4B и 5B, где сильны накопления G1 создает принципиально одного пика G1, которые могут быть ошибочно интерпретированы как G2 / M.
Представитель эксперименты также сделать другие важные моменты. Прежде всего, они демонстрируют, что BrdU поглощения и маркировки может варьироваться от типа клеток. По этой причине важно, чтобы эмпирически определить длину импульса и окрашивание условия, необходимые для адекватного обнаружения клеток в S-фазе. В общем, типов клеток, что двойные в культуре в течение 24 часов или меньше могут быть помечены BrdU в час. Медленнее растущих типов клеток может потребоваться больше импульсов и изменения условий окрашивания антител и продолжительность. MCF10A клетки являются отличным примером в этом отношении, как они были помечены BrdU в течение четырех часов и окрашивают два раза стандартной концентрации антител в четыре раза дольше. Следователидолжны быть осторожны, чтобы не превышать 6 часов BrdU маркировки даже с очень медленно растущих клеток, поскольку это может ошибочно привести к включению G2 / M клеток в S-фазе населения. Во-вторых, при сравнении эффектов p27KIP1 выражения с теми, ТФР-β1, ясно, что р27 может вызывать накопление в любом G1 или G2 / M фазах в то время как TGF-β1 сигнализации вызывает G1 ареста. Традиционные средства обнаружения распространения, такие как 3 H-тимидина и сцинтилляционных счет не в состоянии отличить эти возможности.
В нашем альтернативный протокол мы демонстрируем выявления субпопуляции клеток в больших untransfected населения. Важно, чтобы эмпирически определить наиболее подходящий для обнаружения репортер трансфекции клеток. По нашему опыту некоторые типы клеток, либо четко выраженной клеточной поверхности маркеры плохо, или не может должным образом трафик их плазматическую мембрану, что приводит к невозможности обнаружить трансфекции клеток. Likewise, не все клетки переносят мембраносвязанных форма GFP. Выбор наиболее подходящего репортера должны быть сделаны на основе оценки эффективности трансфекции с репортером, а также относительной интенсивности выражении по сравнению с untransfected управления. В идеале, гетерологичных Экспрессия этих молекул будет хорошо переносится, и это наводит на мысль, что маркеры практически не имеют влияния на распределения клеток цикла.
Одним из ограничений такого рода подходов проточной цитометрии является то, что они только в состоянии установить относительное содержание фаз клеточного цикла по сравнению друг с другом. По этой причине он является неоднозначным, если выражение p27 на рисунке 3 действительно вызывает арест в G1 и G2 / M, или если он просто замедляет прогрессию через эти фазы по отношению к S-фазе. Эти возможности могут быть предметом дальнейшего расследования, рассматривая параллельно образец клеток с митотическим ингибитором, таких как нокодазолом или G1 / S ингибитор как aphidicolin. Поскольку эти препараты создают доминант ареста в М-фазе или в начале S-фазе, соответственно, медленно пролиферирующих клеток будут собираться у наркотиками индуцированных арест точки. Например клетки арестован в G1 из-за выражения PRB останется в G1, несмотря на лечение нокодазолом в то время как контрольные клетки накапливаются в М-фазу 13.
Взятые вместе, эти экспериментальные подходы предлагаем гибкую методологию, которая может быть применена к широкому кругу вопросов млекопитающих клеточного цикла исследований. Они могут легко обнаружить изменения в клеточного цикла и количественного различия при сравнении с контрольной группой.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы выражают благодарность Канадских институтов исследований в области здравоохранения (CIHR) и Канадского общества рака для финансирования научных исследований клеточного цикла в их лаборатории. MJC является получателем MD / PhD стипендий, начиная CIHR. MJC и М. А. являются членами программы подготовки CaRTT.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / оборудование | Компания | Номер по каталогу | Комментарии (необязательно) |
|---|---|---|---|
| Сотовые распространения маркировки реагента | GE Amersham | RPN201 | |
| Анти-BrdU Антитела | BD Biosciences | 347580 | |
| Анти-мышь FITC сопряженных Антитела | Векторные Labs | FI-2000 | |
| Фильтры клеточный штамм | BD Сокол | 352235 | |
| Анти-CD20 антитела | BD Biosciences | 347673 | |
| Многопользовательская цикла программного обеспечения | Феникс Системы Потока | N / A |
Ссылки
- Dolbeare, F., Gratzner, H., Pallavicini, M. G., Gray, J. W. Flow cytometric measurement of total DNA content and incorporated bromodeoxyuridine. Proc. Natl. Acad. Sci. U. S. A. 80, 5573-5573 (1983).
- Givan, A. L. Flow cytometry: an introduction. Methods. Mol. Biol. 699, 1-1 (2011).
- Kalejta, R. F., Brideau, A. D., Banfield, B. W., Beavis, A. J. An integral membrane green fluorescent protein marker, Us9-GFP, is quantitatively retained in cells during propidium iodide-based cell cycle analysis by flow cytometry. J. Exp. Cell. Res. 248, 322-322 (1999).
- Qin, X. -Q. The transcription factor E2F-1 is a downstream target of RB action. Molecular and Cellular Biology. 15, 742-742 (1995).
- van den Heuvel, S., Harlow, E. Distinct roles for cyclin-dependent kinases in cell cycle control. Science. 262, 2050-2050 ( ).
- Henley, S. A. A cancer derived mutation in the retinoblastoma gene with a distinct defect for LXCXE dependent interactions. Cancer Cell. Int. 10, 8-8 (2010).
- Francis, S. M. A functional connection between pRB and transforming growth factor beta in growth inhibition and mammary gland development. Mol. Cell. Biol. 29, 4455-4455 (2009).
- Isaac, C. E. The retinoblastoma protein regulates pericentric heterochromatin. Mol. Cell. Biol. 26, 3659-3659 (2006).
- Julian, L. M. Characterization of an E2F1-specific binding domain in pRB and its implications for apoptotic regulation. Oncogene. 27, 1572-1572 (2008).
- Hirschi, A. An overlapping kinase and phosphatase docking site regulates activity of the retinoblastoma protein. Nat. Struct. Mol. Biol. 17, 1051-1051 (2010).
- Dick, F. A., Dyson, N. pRB contains an E2F1-specific binding domain that allows E2F1-induced apoptosis to be regulated separately from other E2F activities. Mol. Cell. 12, 639-639 (2003).
- Dick, F. A., Sailhamer, E., Dyson, N. J. Mutagenesis of the pRB pocket reveals that cell cycle arrest functions are separable from binding to viral oncoproteins. Mol. Cell. Biol. 20, 3715-3715 (2000).
- Dick, F. A., Dyson, N. J. Three regions of the pRB pocket domain affect its inactivation by human papillomavirus E7 proteins. J. Virol. 76, 6224-6224 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены