Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La inducción de la enfermedad de injerto contra huésped y
En este artículo
Resumen
Trasplante de médula ósea murina es una técnica ampliamente utilizada para estudiar los mecanismos inmunológicos que regulan injerto contra huésped enfermedad en los seres humanos. La capacidad para monitorear los patrones de tráfico de células T In vivo Permite el análisis detallado del desarrollo y perpetuación de la respuesta de células T durante la enfermedad de injerto contra huésped.
Resumen
Enfermedad de injerto contra huésped (EICH) es la barrera limitante para el uso amplio de trasplante de médula ósea como terapia curativa para una variedad de deficiencias hematológicas. GVHD es causada por las células T maduras alorreactivas presentes en el injerto de médula ósea que se infunden en el receptor y causar daños en los órganos receptores. Sin embargo, en ratones, las células T se debe añadir al inóculo de médula ósea a causan la GVHD. Aunque extenso trabajo que se ha hecho para caracterizar células T después del trasplante, respuestas, bioluminiscente tecnología de imagen es un método no invasivo para monitorizar los patrones de tráfico de células T in vivo.
Después de la irradiación letal, los ratones receptores se trasplantan con células de médula ósea y esplenocitos de ratones donantes. Subconjuntos de células T de L2G85.B6 (ratones transgénicos que expresan constitutivamente luciferasa) se incluyen en el trasplante. Por sólo trasplantar ciertos subconjuntos de células T, uno es capaz de rastrear específicos subconjuntos de células T in vivo,y en base a su ubicación, el desarrollo de hipótesis con respecto a la función de subconjuntos de células T específicas en la promoción de la GVHD en diversos puntos temporales. En trasplante predeterminado después de intervalos, los ratones receptores son imágenes utilizando una cámara CCD Xenogen IVIS. La intensidad de luz puede ser cuantificado usando software Living imagen para generar una imagen de pseudo-color en función de la intensidad de fotones (rojo = alta intensidad, violeta intensidad = bajo).
Entre 4-7 días después del trasplante, los ratones receptores comienzan a mostrar signos clínicos de la GVHD. Cooke et al. 1 desarrolló un sistema de puntuación para cuantificar la progresión de la enfermedad en función de la textura de la piel destinatario ratones, integridad de la piel, la actividad, pérdida de peso y la postura. Los ratones se obtuvo diariamente, y sacrificados cuando se convierten moribundo. Los ratones receptores se convierten generalmente en moribundo 20-30 días después del trasplante.
Los modelos murinos son herramientas valiosas para el estudio de la inmunología de la GVHD. Selectivamente trasplante particular, subconjuntos de células T almínimos para la identificación cuidadosa de las funciones que cada subconjunto juega. No invasiva seguimiento de las respuestas de células T in vivo agrega otra capa de valor para los modelos murinos GVHD.
Protocolo
1. Irradiación letal
- Coloque hasta 10 ratones receptores en una jaula microisolator compatible con el irradiador para ser utilizado.
- Irradiar en 2 dosis iguales de suma dosis total (dosis total = 9 cGy para los receptores BALB.B). En segundo lugar irradiación debe ser de 3 horas después de la primera. La inyección debe tener lugar entre 4-6 horas después de la irradiación final. Irradiar ratones, ya sea en origen o Cs 137 RS2, 000 irradiador,.
- Después de la segunda dosis de radiación, ratones tiendas en microisolator jaula con agua acidulada hasta el momento del trasplante.
2. Preparación de esplenocitos
- Eutanasia a un ratón donante de acuerdo con las directrices institucionales. Cada donante generalmente produce 75x10 6 - 125x10 6 esplenocitos. Uso de kits de purificación de CD8, cada ratón generalmente produce 6x10 6 - 12x10 6 células T CD8.
- Extirpar el bazo haciendo primero una incisión verticales 2 cm 2 cm a la derecha de la línea media directamentedebajo de las costillas. Cortar a través de la piel, la piel y membrana visceral.
- Eliminar el bazo y crear suspensión de células individuales mediante la colocación de bazo en 40 tamiz de malla l en una placa de Petri con medio RPMI 1640 con FBS al 5%. Utilice un émbolo de la jeringa para romper el bazo hasta el bazo entero ha sido pasado a través de tamiz de malla.
- Repita este proceso para cada donante WT y L2G85.B6. Recoge todas las suspensiones de células individuales en WT 1-50 ml tubo cónico, y recoger todas las L2G85.B6 suspensiones de células individuales en un tubo cónico separado 50 ml.
- Centrifugar las células a 1.200 rpm durante 10 min a 4 ° C. Volver a suspender las pastillas en 1640 RPMI con FBS al 5% y las células de recuento.
3. Bone Marrow Preparación
- Quitar la piel de una extremidad posterior de un ratón donante.
- Corte con cuidado el tejido muscular como sea posible a partir de fémur y de la tibia / peroné.
- Quite la extremidad posterior cortando fémur nivel de la articulación coxofemoral. Cortar la pata trasera justo debajo de tibia / peroné intersección. Todos los cortes óseos debe hacerse con unas tijeras resistentes.
- Retire con cuidado el tejido muscular restante. Corte el peroné-relativamente poco médula ósea se encuentra en el peroné y no vale la pena el esfuerzo.
- Coloque la extremidad posterior en frío RPMI 1640 al 5% de SFB y repita el proceso con la segunda pata trasera. Cada ratón debe producir entre 6 20x10 - 40x10 6 células de la médula ósea.
4. Bone Marrow eliminación
- Retire una extremidad posterior de los medios de comunicación y el lugar en gran placa de Petri con una pequeña cantidad de medio frío (~ 1 ml).
- Corte la articulación de la rodilla. Usando una jeringa (volumen> 5 ml), la aguja de inserción subcutánea en la tibia y deprimir jeringa hasta que todo el material de color rojo se retira del interior de la tibia. Repita el proceso con el fémur. Descartar huesos restantes desprovistos de médula ósea. Repita el proceso con las extremidades posteriores segundo.
- Crear suspensión de células individuales por medios de comunicación de pipeteado que contienen médula ósea en gran placa de Petri y el émbolo de jeringa y uso l 40malla. Pipetear única suspensión de células en 50 ml de tubo cónico y se mantiene en hielo.
5. CD3 agotamiento
Hay una variedad de maneras para agotar las células CD3 + de la médula ósea. Nuestro laboratorio utiliza un kit compuesto por Miltenyi Biotec (CD3-biotina - 130-093-021). Agotan las células CD3 + de la médula ósea después de protocolo del fabricante. El tampón de Miltenyi para los kits de ahora en adelante se llamará MACS Buffer (2 mM EDTA, 0,5% de BSA en PBS, pH 7,2).
- Lavar las células por centrifugación de esplenocitos y células de la médula ósea a 1200 rpm durante 10 min a 4 ° C, las células y el recuento.
- Quite todo el sobrenadante. Volver a suspender las células de médula ósea en 100 l por 10 millones de células de médula ósea en el tampón de MACS.
- Continuar con CD3 agotamiento fabrica utilizando protocolo.
- Lavar CD3 depleción de células de médula ósea 3 veces en PBS estéril. Conde CD3 agotado las células de la médula ósea y se resuspende en un volumen apropiado para inyectar 10 7 células.
6. L2G85.B6 CD8 + T purificación celular
Hay una variedad de maneras de purificar las células T CD8 de L2G85.B6 ratones. Además, hay varias maneras para agotar las células T CD8 de donantes WT esplenocitos. Nuestro laboratorio utiliza kits de Miltenyi Biotec (CD8 agotamiento - 130-049-401, CD8 purificación - 130-095-236).
- Resuspender el pellet en 90 PESO Buffer MACS l por 10 7 células. Continuar con la depleción de células T CD8 de acuerdo a las manufacturas "protocolo (CD8 agotamiento - 130-049-401).
- Resuspender el pellet en 40 L2G85.B6 Buffer MACS l por 10 7 células. Continuar con la purificación de células T CD8 de acuerdo a las manufacturas "protocolo (CD8 purificación - 130-095-236).
- Contar cada población celular y lavar cada población 3 veces con PBS estéril. Resuspender cada población en volumen apropiado inyectar 18x10 6 WT (CD8 empobrecido) esplenocitos y 2x10 6 L2G85.B6 purificó células T CD8.
7. Inyección Preparación
- Combinar 10 7 CD3 agotadas las células de médula ósea, 18x10 6 esplenocitos WT (CD8 empobrecido) y 2x10 L2G85.B6 6 purificadas las células T CD8 en un tubo de microcentrífuga. Lavar con PBS estéril y se resuspende en 300 l.
- Inyectar la preparación de células en la vena de la cola de ratones receptores. Las inyecciones se debe realizar con agujas de calibre 28.
- Tienda de ratones en jaulas microisolator con agua acidulada. Calificación de ratones diariamente con sistema de puntuación de puntuación desarrollado GVHD por Cooke et al 1.
8. Bioluminiscente de imágenes
- Seis días después del trasplante, se inyectan ratones receptores con 4 mg de D-luciferina. Permitir 5 min para luciferina para reaccionar con luciferasa.
- Se anestesia el ratón en la cámara de isoflurano imager bioluminiscencia y receptores de imagen de 5 min con binning pequeño. Esto creará una imagen de alta resolución mientras se obtienen tantos eventos como sea posible.
- Analizar datos usando LivingImagen de software. La escala de la imagen de pseudo-color se puede cambiar para obtener los mejores resultados. Sin embargo, es imperativo que la misma escala que se utiliza a través de experimentos.
- Las regiones de interés pueden ser creados usando software Living imagen y la emitancia luz puede ser cuantificado mediante el cálculo del flujo (fotones / seg) que se emite desde cada región de interés.
9. Los resultados representativos
Aproximadamente 7-10 días después del trasplante, los ratones comienzan a mostrar signos clínicos de la GVHD. Los ratones parecen desaliñados debido a la falta de preparación. Los receptores también comenzará a perder peso entre 7-10 días después del trasplante. La actividad y la postura de los ratones receptores se mantendrá relativamente normal hasta aproximadamente el día después del trasplante 12-14. Acumulativos puntuaciones de GVHD aumentará constantemente a través de la primera 2-3 semanas después del trasplante (Figura 1A). Curso de la enfermedad es muy variable entre los ratones, sin embargo, los beneficiarios de manera uniforme debe sucumbir a la GVHD por 30-40 days después del trasplante (Figura 1B).
La Figura 2 muestra que los ratones receptores fueron fotografiadas 6 días después del trasplante. Pseudo-coloreado escala muestra diversos emitancia luz por todo el cuerpo con la mayor intensidad de la luz que se emite en el bazo y el intestino. Acumulación de células T CD8 en el intestino es coherente con resultados anteriores 6. Los ratones receptores se pueden colocar de nuevo en la jaula de microisolator a ser reflejado en un punto temporal posterior o a eutanasia por ex vivo de imágenes.
| Criterios | Grado 0 | Grado 1 | Grado 2 |
| Pérdida de peso (wkly.) | <10% | > 10% - <25% | > 25% |
| Postura | Normal | Encorvando sólo en reposo | Varios encorvado; perjudica movemeNuevo Testamento |
| Actividad | Normal | Leve a moderada disminución en la actividad | Estacionaria menos que se estimule |
| Fur textura | Normal | Leve a moderado revolviendo | Fruncido grave / mala preparación |
| Textura de la piel | Normal | El escalado de las patas traseras / | Áreas obvias de piel desnuda |
Tabla 1. Cooke et al desarrollaron este sistema de puntuación en 1996 1. Los ratones se anotó diariamente en cada uno de los criterios de la izquierda. Cada ratón se le da una puntuación de 0-2 para cada criterio y la puntuación total es la suma de todas las puntuaciones individuales.

Figura 1. Letalmente BALB.B irradiados fueron trasplantados con 10 7 óseacélulas de la médula solos o con 18x10 6 agotada de células T CD8 esplenocitos WT y 6 2x10 purificados L2G85.B6 células T CD8. A) los datos de puntuación clínica de los receptores de médula ósea solo o con CD8 agotada de células T WT esplenocitos y se purificó L2G85.B6 células T CD8. B) Los datos de supervivencia de los receptores de médula ósea sola o con células T CD8 agotado esplenocitos WT y purificado L2G85.B6 células T CD8. Haga clic aquí para ampliar la cifra .
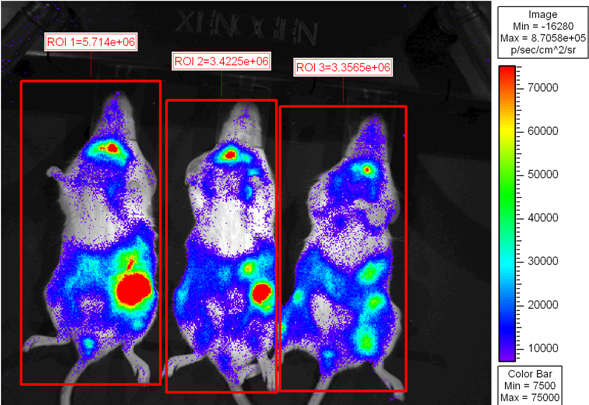
Figura 2. BALB.B ratones letalmente irradiados fueron trasplantados con 10 7 células de la médula ósea solo o con 18x10 6 agotada de células T CD8 esplenocitos WT y 6 2x10 purificados L2G85.B6 células T CD8. Los receptores fueron inyectados con 4 mg de D-luciferina mediante inyección intraperitoneal y se obtuvieron imágenes utilizando Xenogen IVIS durante 5 min a binning pequeño. Saleudo de color imágenes se muestran en púrpura representa la intensidad baja y el rojo representa las regiones de alta intensidad de interés se extrajeron alrededor de todo el ratón y el flujo total (fotones / s) fueron cuantificados.
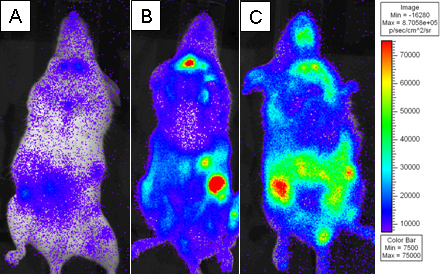
Figura 3. BALB.B ratones letalmente irradiados fueron trasplantados con 10 7 células de la médula ósea solo o con 18x10 6 agotada de células T CD8 esplenocitos WT y 6 2x10 purificados L2G85.B6 células T CD8. Los receptores fueron inyectados con 4 mg de D-luciferina mediante inyección intraperitoneal y se obtuvieron imágenes utilizando Xenogen IVIS durante 5 min a binning pequeño. Pseudo-color imágenes se muestran en púrpura representa la intensidad baja y el rojo representa la intensidad alta. Los beneficiarios fueron imágenes en un día) 4, B) el día 6, y C) el día 8 después de la transferencia.
Discusión
El protocolo para la inducción de la GVHD en ratones presentados aquí representa un modelo clínicamente relevante de GVHD murino. Originalmente establecida por Berger et al., En 1994, la C57Bl / 6 en combinación cepa BALB.B es MHC-emparejado, con una mortalidad GVHD mediada por CD4, CD8 efectoras dependientes de T 2, muy similares a las del escenario clínico más común 3. Se sabe que el trasplante de las células T CD8 solo no causa GVHD en este modelo, sin embargo, la progresión de...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Estamos en deuda con Alice Wang Jiao Gaughan y Jing-cuyo excelente soporte técnico, aportación intelectual, y el apoyo moral jugaron un papel decisivo en el movimiento de estos estudios por delante. Estos estudios fueron apoyados por el NIH AI036532 subvención a GAH.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de Reactivo | Empresa | Número de catálogo | Comentarios |
| RPMI 1640 | Invitrogen | 12633-012 | |
| Suero de ternero fetal | Invitrogen | 10439016 | |
| 40 mM filtro de células | BD Biosciences | 352340 | |
| CD3e-Biotina | Miltenyi Biotech | 130-093-021 | |
| Anti-biotina microperlas | Miltenyi Biotech | 130-091-147 | |
| CD8a microperlas | Miltenyi Biotech | 130-049-401 | Se utiliza para agotar las células T CD8 de bazo. |
| Purificación de anticuerpos CD8a Cocktail | Miltenyi Biotech | 130-095-236 | Se utiliza para purificarCélulas T CD8 de bazo. |
| D-luciferina | Caliper Life Sciences | 122796 |
Referencias
- Cooke, K. R. An experimental model of idiopathic pneumonia syndrome after bone marrow transplantation: The roles of minor H antigens and endotoxin. Blood. 88, 3230-3239 (1996).
- Berger, M. T cell subsets involved in lethal graft-versus-host disease directed to immunodominant minor histocompatibility antigens. Transplantation. 57, 1095-1102 (1994).
- Nimer, S. D. Selective depletion of CD8+ cells for prevention of graft-versus-host disease after bone marrowtransplantation. A randomized controlled trial. Transplantation. 57, 82-87 (1994).
- Korngold, R., Sprent, J. Surface markers of T cells causing lethal graft-vs-host disease to class I vs class II H-2 differences. Journal of Immunology. 135, 3004-3010 (1985).
- Cao, Y. A. Molecular imaging using labeled donor tissues reveals patterns of engraftment, rejection, and survival in transplantation. Transplantation. 80, 134-139 (2005).
- Asady, R. E. l. TGF-{beta}-dependent CD103 expression by CD8(+) T cells promotes selective destruction of the host intestinal epithelium during graft-versus-host disease. J. Exp. Med. 201, 1647-1657 (2005).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol Rev. 114, 181-217 (1990).
- Karecla, P. I. Recognition of E-cadherin on epithelial cells by the mucosal T cell integrin alpha M290 beta 7 (alpha E beta 7). Eur. J. Immunol. 25, 852-856 (1995).
- Cepek, K. L. Adhesion between epithelial cells and T lymphocytes mediated by E-cadherin and the alpha E beta 7 integrin. Nature. 372, 190-193 (1994).
- Malarkannan, S. The molecular and functional characterization of a dominant minor H antigen, H60. J. Immunol. 161, 3501-3509 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados