Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'induction de la réaction du greffon contre l'hôte et des maladies
Dans cet article
Résumé
Murin de transplantation de moelle osseuse est une technique largement utilisée pour étudier les mécanismes immunologiques qui régissent la réaction du greffon contre l'hôte chez l'homme. La capacité de surveiller les tendances du trafic de cellules T In vivo Permet une analyse détaillée de l'évolution et de la perpétuation de la réponse des lymphocytes T au cours de la réaction du greffon contre l'hôte.
Résumé
La réaction du greffon contre l'hôte (GVHD) est la barrière limitant l'utilisation à grande échelle de la greffe de moelle osseuse comme traitement curatif pour une variété de déficiences hématologiques. GVHD est causée par les cellules T matures alloréactifs présents dans la greffe de moelle osseuse qui sont infusés dans le récipient et causer des dommages aux organes accueil. Cependant, chez la souris, les cellules T doivent être ajoutés à l'inoculum de moelle osseuse pour provoquer une GVHD. Bien que le travail considérable a été fait pour caractériser T post-transplantation de cellules réponses, la technologie d'imagerie bioluminescente est une méthode non-invasive pour surveiller les habitudes de trafic de cellules T in vivo.
Après irradiation létale, les souris receveuses sont transplantés avec des cellules de moelle osseuse et des splénocytes de souris donneuses. Sous-ensembles de cellules T à partir de L2G85.B6 (souris transgéniques qui expriment de manière constitutive luciférase) sont inclus dans la greffe. En seulement certains sous-ensembles de transplantation de cellules T, on est capable de suivre les sous-ensembles spécifiques de lymphocytes T in vivo,et en fonction de leur emplacement, de formuler des hypothèses concernant le rôle des sous-ensembles spécifiques de lymphocytes T dans la promotion de GVHD à divers moments. À intervalles prédéterminés après la greffe, les souris receveuses sont imagées par un Xenogen IVIS caméra CCD. L'intensité lumineuse peut être quantifiée à l'aide du logiciel d'image de séjour pour générer une image pseudo-couleur sur la base de l'intensité des photons (rouge = forte intensité, violet = faible intensité).
Entre 4-7 après la greffe jours, les souris receveuses commencent à montrer des signes cliniques de GVHD. Cooke et al. 1 développé un système de notation pour quantifier la progression de la maladie basée sur la texture de la fourrure destinataire souris, intégrité de la peau, l'activité, la perte de poids, et la posture. Les souris sont notés tous les jours, et euthanasiés quand ils deviennent moribonds. Les souris receveuses généralement devenue moribonde après la greffe 20-30 jours.
Les modèles murins sont des outils précieux pour l'étude de l'immunologie de la GVHD. Sélective transplantation particulier des cellules T sous-ensembles albas pour une identification précise des rôles joue chaque sous-ensemble. De façon non invasive le suivi des réponses des lymphocytes T in vivo ajoute une autre couche de la valeur à des modèles murins GVHD.
Protocole
1. L'irradiation mortelle
- Placer un maximum de 10 souris receveuses dans une cage microisolation compatible avec le dispositif d'irradiation à être utilisé.
- Irradier en 2 doses égales de sommation dose totale (dose totale = 9 cGy pour les bénéficiaires BALB.B). Seconde irradiation devrait être de 3 heures après la première. L'injection doit se produire entre 4-6 heures après l'irradiation finale. Souris irradier dans les deux Cs 137 source ou RS2, 000, irradiateur.
- Après la deuxième dose de rayonnement souris en magasin, dans la cage microisolation avec de l'eau acidifiée jusqu'à ce que le moment de la transplantation.
2. Préparation des splénocytes
- Euthanasier une souris donneuse selon les directives hospitalières. Chaque donateur donne généralement 75x10 6 - 125x10 6 splénocytes. Utilisation CD8 kits de purification, chaque souris donne généralement 6x10 6 - 12x10 6 cellules CD8 T.
- Enlever la rate en faisant d'abord un 2 verticales cm incision de 2 cm à droite de la ligne médiane directementsous la cage thoracique. Couper à travers la fourrure, la peau et la membrane viscérale.
- Enlever la rate et de créer suspension cellulaire unique en plaçant la rate dans 40 ul tamis dans une boîte de Pétri avec du RPMI 1640 avec 5% de FBS. Utilisez un piston de la seringue pour briser la rate rate jusqu'à ce que le tout a été passé à travers tamis.
- Répétez ce processus pour chaque WT et L2G85.B6 des bailleurs de fonds. Ramassez tous les WT suspensions de cellules isolées dans 1-50 ml tube conique, et de collecter toutes les L2G85.B6 suspensions de cellules isolées dans un tube conique séparée 50 ml.
- Centrifuger les cellules à 1200 rpm pendant 10 min à 4 ° C. Remettre les boulettes en 1640 RPMI avec 5% de FBS et des cellules de comptage.
3. Préparation de moelle osseuse
- Enlever la peau d'un membre postérieur d'une souris donneuse.
- Retirez soigneusement le tissu musculaire autant que possible du fémur et du tibia / péroné.
- Retirer du membre postérieur du fémur en réduisant l'écart à l'articulation de la hanche. Couper la patte arrière juste au-dessous du tibia / péroné intersection. Toutes les coupes osseuses doivent être faites en utilisant des ciseaux robustes.
- Retirez délicatement le tissu musculaire restante. Coupez-péroné relativement peu de moelle osseuse se trouve dans péroné et ne vaut pas la peine.
- Placez des membres postérieurs dans le froid RPMI 1640 5% FBS processus et répéter avec la seconde branche postérieure. Chaque souris devrait produire entre 20x10 6 - 40x10 6 cellules de moelle osseuse.
4. Suppression de moelle osseuse
- Retirer une patte arrière à partir du support et les placer dans une boîte de Pétri grande avec une petite quantité de milieux froids (~ 1 ml).
- Coupez l'articulation du genou. En utilisant une seringue (volume> 5 ml), insérer l'aiguille sous-cutanée dans le tibia et appuyer sur la seringue jusqu'à ce que tout le matériel rouge est retiré de l'intérieur du tibia. Répéter l'opération avec le fémur. Jeter os restant dépourvues de moelle osseuse. Répéter l'opération avec les membres postérieurs seconde.
- Créer suspension cellulaire unique par les médias de pipetage contenant moelle osseuse dans une boîte de Pétri grand piston de la seringue utilisation et 40 plmaille de l'écran. Pipette suspension cellulaire unique en tube de 50 ml conique et garder sur la glace.
5. CD3 épuisement
Il existe une variété de façons de appauvrissent cellules CD3 + de la moelle osseuse. Notre laboratoire utilise un kit composé par Miltenyi Biotec (CD3-biotine - 130-093-021). Appauvrissent cellules CD3 + de la moelle osseuse selon le protocole du fabricant. Le tampon pour les kits de Miltenyi sera désormais appelé MACS tampon (2 mM EDTA, 0,5% de BSA dans du PBS, pH 7,2).
- Laver les cellules par centrifugation splénocytes et des cellules de moelle osseuse à 1200 rpm pendant 10 min à 4 ° C et le nombre de cellules.
- Retirez TOUS surnageant. Remettre les cellules de moelle osseuse de 100 pi par 10 millions de cellules de moelle osseuse dans le tampon MACS.
- Continuer avec le CD3 l'épuisement en utilisant le protocole fabrique ».
- Lavez-CD3 cellules déplétées moelle osseuse 3 fois dans du PBS stérile. Comte CD3 épuisé cellules de moelle osseuse et remettre en suspension dans un volume approprié d'injecter 10 7 cellules.
6. L2G85.B6 CD8 + Purification des lymphocytes T
Il existe une variété de façons de purifier les lymphocytes T CD8 de souris L2G85.B6. En outre, il existe plusieurs façons de appauvrissent lymphocytes T CD8 à partir de splénocytes WT donateurs. Notre laboratoire utilise des kits de Miltenyi Biotec (CD8 épuisement - 130-049-401, CD8 purification - 130-095-236).
- Reprendre le culot dans 90 WT tampon MACS pi par 10 7 cellules. Continuer avec la déplétion des cellules T CD8 selon fabrique "protocole (CD8 épuisement - 130-049-401).
- Reprendre le culot dans 40 L2G85.B6 tampon MACS pi par 10 7 cellules. Continuer avec les CD8 purification des lymphocytes T en fonction de fabrique "protocole (CD8 purification - 130-095-236).
- Comptez chaque population de cellules et laver chaque population 3 fois avec du PBS stérile. Resuspendre chaque population en volume suffisant d'injecter 6 WT 18x10 (CD8 appauvri) splénocytes et 2x10 6 L2G85.B6 purifiée des cellules T CD8.
7. Préparation injectable
- Mélanger 10 7 CD3 épuisés cellules de moelle osseuse, 18x10 6 WT (CD8 appauvri) splénocytes, et 2x10 6 L2G85.B6 lymphocytes T CD8 purifiés dans un microtube. Laver avec du PBS stérile et remettre en suspension dans 300 ul.
- Injecter préparation de cellules dans la veine de la queue des souris receveuses. Les injections doivent se faire en utilisant des aiguilles de calibre 28.
- Boutique de souris en cage microisolation avec de l'eau acidifiée. Score souris quotidiennement en utilisant système de notation de notation GVHD développé par Cooke et al 1.
8. Bioluminescent Imaging
- Six jours après la transplantation, injecter souris receveuses avec 4 mg de D-luciférine. Laisser 5 minutes pour luciférine de réagir avec la luciférase.
- Anesthésier la souris dans la chambre de l'isoflurane imageur bioluminescence et les bénéficiaires d'image pendant 5 min en binning petite. Cela va créer une image haute résolution tout en recueillant autant d'événements que possible.
- Analyser les données à l'aide de séjourLe logiciel Image. L'échelle de l'image pseudo-couleur peut être modifiée pour obtenir les meilleurs résultats. Cependant, il est impératif que la même échelle être utilisé dans les expériences.
- Régions d'intérêt peuvent être créés en utilisant un logiciel image vivante et l'émissivité de lumière peut être quantifiée par le calcul du flux (photons / s) émise par chaque région d'intérêt.
9. Les résultats représentatifs
Environ 7-10 jours après la transplantation, les souris commencent à montrer des signes cliniques de GVHD. Les souris semblent délabré en raison du manque de toilettage. Les lauréats seront également commencer à perdre du poids de 7-10 après la greffe jours. Activité et la posture des souris receveuses restera relativement normale jusqu'à environ 12-14 jours après la transplantation. Cumulatifs scores GVHD ne cessera d'augmenter à travers le premier 2-3 semaines après la greffe (figure 1A). Évolution de la maladie est très variable entre les souris, mais les bénéficiaires doivent uniforme succomber à la GVHD de 30-40 days post-transplantation (figure 1B).
La figure 2 montre que les souris receveuses ont été imagés 6 post-transplantation jours. Pseudo-couleur variant échelle montre émittance la lumière à travers le corps avec la plus forte intensité de la lumière émise dans la rate et l'intestin. CD8 accumulation de cellules T dans l'intestin est compatible avec les conclusions précédentes 6. Les souris receveuses peuvent être remis en cage microisolation à imager à un moment ultérieur ou euthanasiés pour l'imagerie ex vivo.
| Critères | Grade 0 | Grade 1 | Grade 2 |
| La perte de poids (wkly.) | <10% | > 10% - <25% | > 25% |
| Posture | Normal | Courbant seulement au repos | Plusieurs se courber; altère movement |
| Activité | Normal | Légère à modérée diminution de l'activité | Stationnaire à moins que stimulé |
| Texture de la fourrure | Normal | Légère à modérée ébouriffant | Fronçage grave / mauvais toilettage |
| Texture de la peau | Normal | Mise à l'échelle des pattes arrière / | Domaines évidents de peau dénudée |
Tableau 1. Cooke et al développé ce système de notation en 1996 1. Les souris doivent être notées chaque jour sur chacun des critères sur la gauche. Chaque souris reçoit un score de 0-2 pour chaque critère et le score total est la somme de tous les scores individuels.

Figure 1. Lethally BALB.B irradiés ont été transplantés avec 10 7 oscellules de la moelle seul ou avec 18x10 6 cellules CD8 T épuisés splénocytes WT et 2x10 6 purifiés L2G85.B6 lymphocytes T CD8. A) les données cliniques notes des bénéficiaires de la moelle osseuse, seul ou avec des lymphocytes T CD8 appauvri splénocytes WT et purifié L2G85.B6 lymphocytes T CD8. B) Les données de survie des bénéficiaires de la moelle osseuse, seul ou avec des lymphocytes T CD8 appauvri splénocytes WT et purifié L2G85.B6 lymphocytes T CD8. Cliquez ici pour agrandir la figure .
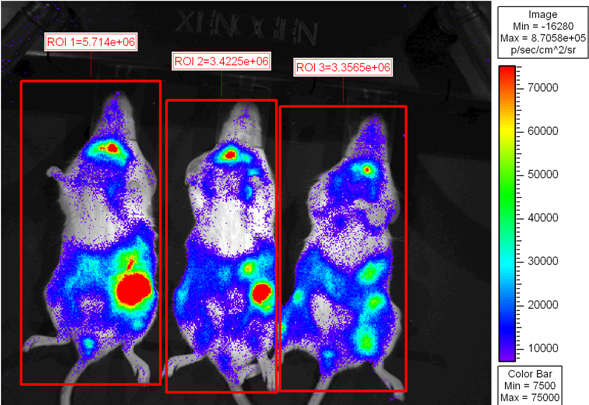
Figure 2. BALB.B souris irradiées de façon létale ont été transplantés avec 10 7 cellules de moelle osseuse, seul ou avec 18x10 6 cellules CD8 T épuisés splénocytes WT et 2x10 6 purifiés L2G85.B6 lymphocytes T CD8. Les récipiendaires ont été injectés avec 4 mg de D-luciférine par injection intrapéritonéale et ont été imagées par IVIS XENOGEN pendant 5 min à petite binning. PsEudes de couleur des images sont indiqués lorsque pourpre représente une faible intensité et le rouge représente les régions à haute intensité d'intérêt ont été établis autour de la souris tout flux total (photons / s) ont été quantifiés.
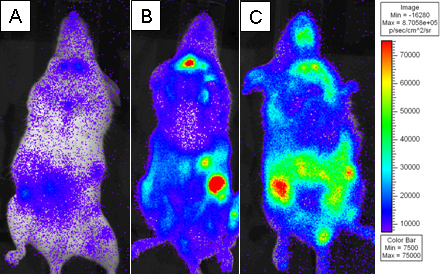
Figure 3. BALB.B souris irradiées de façon létale ont été transplantés avec 10 7 cellules de moelle osseuse, seul ou avec 18x10 6 cellules CD8 T épuisés splénocytes WT et 2x10 6 purifiés L2G85.B6 lymphocytes T CD8. Les récipiendaires ont été injectés avec 4 mg de D-luciférine par injection intrapéritonéale et ont été imagées par IVIS XENOGEN pendant 5 min à petite binning. Pseudo-couleurs des images sont indiqués lorsque pourpre représente une faible intensité et le rouge représente l'intensité élevée. Les récipiendaires ont été vus sur une journée) 4, B) Jour 6, et C) après le transfert le jour 8.
Discussion
Le protocole pour induire une GVHD chez les souris présentées ici représente un modèle cliniquement pertinente de la GVH murine. Initialement créé par Berger et al., En 1994, les souris C57BL / 6 en combinaison souche BALB.B est MHC-appariés, avec une mortalité GVHD médiée par CD4, CD8 effecteurs dépendants T 2, très similaires au scénario clinique la plus commune 3. Il est connu que la transplantation des cellules T CD8 ne suffit pas à provoquer une GVHD dans ce modèle, mai...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous sommes redevables à Alice Gaughan et Jiao-Jing Wang dont l'encours de soutien technique, l'apport intellectuel et le soutien moral ont contribué à faire progresser ces études à venir. Ces études ont été soutenues par le AI036532 NIH pour GAH.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| RPMI 1640 | Invitrogen | 12633-012 | |
| Sérum de veau foetal | Invitrogen | 10439016 | |
| 40 Crépine cellulaire uM | BD Biosciences | 352340 | |
| CD3e-biotine | Miltenyi Biotech | 130-093-021 | |
| Anti-Biotine Microbilles | Miltenyi Biotech | 130-091-147 | |
| CD8a Microbilles | Miltenyi Biotech | 130-049-401 | Utilisée pour appauvrir les lymphocytes T CD8 de la rate. |
| Cocktail CD8a purification d'anticorps | Miltenyi Biotech | 130-095-236 | Utilisé pour purifier l'Les cellules T CD8 de la rate. |
| D-luciférine | Caliper Life Sciences | 122796 |
Références
- Cooke, K. R. An experimental model of idiopathic pneumonia syndrome after bone marrow transplantation: The roles of minor H antigens and endotoxin. Blood. 88, 3230-3239 (1996).
- Berger, M. T cell subsets involved in lethal graft-versus-host disease directed to immunodominant minor histocompatibility antigens. Transplantation. 57, 1095-1102 (1994).
- Nimer, S. D. Selective depletion of CD8+ cells for prevention of graft-versus-host disease after bone marrowtransplantation. A randomized controlled trial. Transplantation. 57, 82-87 (1994).
- Korngold, R., Sprent, J. Surface markers of T cells causing lethal graft-vs-host disease to class I vs class II H-2 differences. Journal of Immunology. 135, 3004-3010 (1985).
- Cao, Y. A. Molecular imaging using labeled donor tissues reveals patterns of engraftment, rejection, and survival in transplantation. Transplantation. 80, 134-139 (2005).
- Asady, R. E. l. TGF-{beta}-dependent CD103 expression by CD8(+) T cells promotes selective destruction of the host intestinal epithelium during graft-versus-host disease. J. Exp. Med. 201, 1647-1657 (2005).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol Rev. 114, 181-217 (1990).
- Karecla, P. I. Recognition of E-cadherin on epithelial cells by the mucosal T cell integrin alpha M290 beta 7 (alpha E beta 7). Eur. J. Immunol. 25, 852-856 (1995).
- Cepek, K. L. Adhesion between epithelial cells and T lymphocytes mediated by E-cadherin and the alpha E beta 7 integrin. Nature. 372, 190-193 (1994).
- Malarkannan, S. The molecular and functional characterization of a dominant minor H antigen, H60. J. Immunol. 161, 3501-3509 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon